在低蛋白质饲料中补充必需氨基酸对大口黑鲈生长、体组成和免疫指标的影响
2014-05-27陈乃松梁勤朗肖温温周恒永马秀丽
陈乃松 梁勤朗 肖温温 周恒永 马秀丽 赵 明
在低蛋白质饲料中补充必需氨基酸对大口黑鲈生长、体组成和免疫指标的影响
陈乃松 梁勤朗 肖温温 周恒永 马秀丽 赵 明
(上海海洋大学水产与生命学院, 上海 201306)
为了研究在低蛋白质饲料中补充晶体必需氨基酸对大口黑鲈生长、体组成和免疫指标的影响, 根据鱼体的必需氨基酸组成模式设计了7种等能的试验饲料。其中4种饲料(45CP、40CP、35CP和30CP)的粗蛋白质水平分别为45%、40%、35%和30%, 另3种饲料(40AA、35AA和30AA)是在低蛋白质饲料(40CP、35CP和30CP)的基础上添加必需氨基酸, 使它们的必需氨基酸含量与45CP(对照组)相一致。用上述饲料对初始体重为(10.13 ± 0.01) g的大口黑鲈进行了89d的饲养试验。饲养试验在室内循环水养殖系统中进行, 每种饲料设3个重复, 每重复放养30尾鱼。方差分析显示: 试验鱼的生长性能、饲料效率、全鱼和肌肉的粗蛋白质含量、成活率以及免疫指标均随着饲料蛋白质含量的降低而显著降低(<0.05)。添加必需氨基酸的35AA和30AA的饲料效率和蛋白质保留率分别显著高于对应的未添加必需氨基酸的35CP和30CP组(<0.05), 但仍显著低于45CP组(<0.05)。40AA的试验鱼血清溶菌酶活性和血清补体活性与45CP组差异不显著(>0.05)。35AA和30AA组的头肾白细胞呼吸爆发活性显著高于35CP和30CP组(<0.05)。30AA组的全鱼粗蛋白质含量以及肥满度显著高于30CP(<0.05)。各组试验鱼的水分和灰分均无显著差异(>0.05)。回归分析显示: 在低蛋白质饲料中补充晶体必需氨基酸对大口黑鲈幼鱼的生长、饲料效率和蛋白质保留率所产生的影响与其引起增加了的饲料蛋白质水平而不是饲料的必需氨基酸水平正相关。研究表明, 在低蛋白质饲料中补充的晶体必需氨基酸对大口黑鲈的生长、体组成和免疫指标产生的有益作用不及等量的以蛋白质为来源的必需氨基酸。
大口黑鲈; 饲料; 蛋白质; 必需氨基酸; 生长; 体组成; 免疫指标
蛋白质是动物生长、发育和健康等不可缺少的营养素。动物摄取蛋白质即是为了获得氨基酸, 尤其是平衡的必需氨基酸[1]。研究表明, 鱼类(特别是肉食性鱼类)的饲料蛋白质最适需求量远高于陆上动物[2]。这使得蛋白质时常是鱼类饲料成本中花费最大的营养成分。同时, 当饲料中的蛋白质水平过高时, 还会因蛋白质的分解代谢引起过多的氮排放而产生水环境的污染。
在禽畜的低蛋白质饲料中, 补充晶体必需氨基酸能有效地改善饲料氨基酸平衡, 促进动物生长, 提高饲料效率和减少氮排放等[3]。然而, 在鱼类的低蛋白质饲料中补充晶体必需氨基酸能否发挥同样的效果则有不尽一致的研究报道[4, 5]。因而评价特定的养殖鱼类对晶体必需氨基酸的利用效果, 对于了解其氨基酸代谢特点和开拓蛋白质饲料的来源具有理论和实践意义。
大口黑鲈(), 俗名加州鲈, 具有生长快、抗病力强和产量高等特点, 是我国重要的淡水养殖鱼类。但大口黑鲈专用人工配合饲料在我国尚未研发成功, 养殖生产中以冰鲜杂鱼作饲料。大口黑鲈属于典型的肉食性鱼类, 理应其饲料蛋白质的需求量应当较高, 但已有的研究却未得出一致的最适饲料蛋白质需求量的结论[6—10]。关于大口黑鲈对饲料中必需氨基酸的需求量的研究只见有赖氨酸[11]、蛋氨酸[12]和精氨酸[13]的最适需求量的报道。因此, 关于大口黑鲈饲料的蛋白质和必需氨基酸需求量的研究尚有待进一步地深入。
本研究通过养殖试验评估不同饲料蛋白质水平以及在低蛋白质水平基础上补充晶体必需氨基酸对大口黑鲈生长、体组成和免疫指标的影响, 着重探讨在较低蛋白质饲料中添加晶体必需氨基酸的有效性, 进一步丰富大口黑鲈的蛋白质和必需氨基酸的营养学知识。
1 材料与方法
1.1 饲料配制
本试验设计了7种等能的试验饲料, 其配方与组成如表1。其中4种饲料(45CP、40CP、35CP和30CP)的粗蛋白质水平分别为45%、40%、35%和30%, 其必需氨基酸与非必需氨基酸含量比值均相同。另3种饲料(40AA、35AA和30AA)是在40CP、35CP和30CP的基础上添加晶体必需氨基酸, 使它们的必需氨基酸含量与45CP相一致, 但这3种饲料的非必需氨基酸含量仍与原各自的基础饲料相同。因此, 45CP被作为3种添加晶体必需氨基酸饲料的对照组。所有试验饲料的必需氨基酸组成模拟与大口黑鲈全鱼相似的必需氨基酸组成模式, 但其中赖氨酸(未发表数据)、蛋氨酸[12]含量参照本实验室先前取得的大口黑鲈对它们的最适需求量的研究结果。试验饲料的氨基酸组成分析值如表2。
所添加的晶体氨基酸事先经过如下的包膜处理:称取待包膜晶体氨基酸质量的5%的醇溶玉米蛋白, 将其溶解于95%的乙醇中制成10%的玉米蛋白乙醇溶液, 向该溶液中加入待包膜的晶体氨基酸并混合均匀, 于50 ℃烘干后粉碎备用。
所有饲料原料都经过粉碎且过80目标准筛。各组分混合均匀后, 加35%水再一次混合均匀。按实验鱼生长过程中个体的变化, 用绞肉机制成直径3—5 mm长条, 再切成长约5—10 mm颗粒, 于–20 ℃下保存备用。
1.2 养殖试验
试验用鱼购自于一个商业性的大口黑鲈育苗场, 在室内循环水养殖系统中驯化4周, 以适应养殖环境。经驯化后, 实验鱼被饥饿24h, 选取体重相近的鱼分组作养殖试验。试验鱼按上述7种饲料处理, 每处理3重复, 被随机分配于21个800 L的水槽中, 每水槽放养初始平均体重为(10.13±0.01) g的试验鱼30尾。本试验采取表观饱食投喂, 每天投饲两次(8:00和16:00)。养殖水槽处于一个共同的循环水控制系统之中, 养殖用水经海绵层和珊瑚砂过滤, 紫外灯杀菌并且不间断充气。水温控制在(28 ± 1)℃, 氨氮为(0.25 ± 0.05) mg/L, pH为7.2 ± 0.2。光周期为自然光照。养殖试验共持续89d。
1.3 样品采集
在养殖试验开始前, 随机选取40尾试验鱼作初始样本, 以测定全鱼体组成。在养殖试验过程中按Lee[14]的方法收集粪便样品。养殖试验结束后, 饥饿24h, 以各养殖水槽为单元称取体重, 并随机抽取10尾鱼, 其中5尾作全鱼营养成分分析, 另外5尾在量取体重和体长后, 进行尾静脉取血, 采集内脏和背部两侧肌肉。上述样品均于–80℃超低温冰箱中保存以待分析。剩余的鱼继续饲养用于免疫试验的活体采样。
1.4 化学分析
采用105℃常压干燥法, 凯氏定氮法(Kjeltec- 2200, Foss Tecator, 瑞典)和550℃下灼烧法分别测定饲料和鱼体的水分、粗蛋白质和灰分。采用索氏脂肪测定仪(Sox-416, Gerhardt, 德国)测定饲料的粗脂肪[15], 采用氯仿-甲醇法[16]测定鱼体的粗脂肪。总能量用氧弹量热仪(6200, Parr, 美国)测定。饲料中的氨基酸测定参照文献[17]的方法, 用氨基酸自动分析仪(S-433D, Sykam, 德国)分析。饲料中色氨酸因酸解破坏而不能被分析, 其含量是根据NRC (2011)[18]提供的各饲料原料中所含色氨酸的理论值和晶体色氨酸的添加量计算而得。
1.5 免疫测定
血清溶菌酶活性采用比浊法测定[19]。经典途径血清补体活性测定参照Zhou,[13]的方法, 采用抗绵羊红细胞溶血素(浙江玉环生物制品厂)致敏绵羊红细胞, 以其作为靶细胞进行补体经典途径溶血分析。头肾白细胞分离参照陈乃松[12]的方法。呼吸爆发活性测定参照Secombes[20]的方法。
1.6 计算公式
特定生长率(Specific growth rate,, %/d)= 100 × (ln终末体重–ln初始体重)/试验天数;
摄食量(Feed intake,, g/尾) = 饲料摄入量/[(初始鱼尾数+终末鱼尾数)/2];
饲料效率(Feed efficiency,)= (终末体重–初始体重)/摄食量;
蛋白质保留率(Protein retention,, %)=100 ×体组织蛋白质增加量/蛋白质摄入量;
肥满度(Condition factor,, g/cm3)=100 ×鱼体重/鱼体长3;
肝体比(Hepatosomatic index,, %)=100 ×肝脏重/鱼体重;
脏体比(Viscerasomatic index,, %)=100 ×内脏重/鱼体重;
成活率(Survival rate,, %)=100 ×终末鱼尾数/初始鱼尾数。
1.7 数据分析
相关数据采用平均值±标准误表示, 采用SPSS 17.0统计软件以饲料为单因素作方差分析(one-way ANOVA), 差异显著时用Duncan’s法作多重比较。统计显著水平设定为<0.05。
表1 试验饲料配方及概略组成(%,风干基础)

Tab.1 Formulation and approximate composition of experimental diets (%, on air-dry basis)
注:1)基础蛋白质成分(风干基础): 鱼粉56.72%, 玉米蛋白粉7.46%, 谷朊粉11.94%, 豆粕16.42%, 喷干血球粉7.46%;2)预混料: 鱿鱼内脏粉1.00%, 酵母粉1.00%, 酵母提取物1.00%, 大豆磷脂粉1.00%, 多维a)0.80%, 多矿b)1.00%, 维生素C 0.05%, 三氧化二铬0.50%, 氯化胆碱0.30%;3)包膜必需氨基酸: 蛋氨酸4.98%, 赖氨酸13.11%, 苏氨酸7.28%, 缬氨酸12.90%, 异亮氨酸9.33%, 亮氨酸20.92%, 苯丙氨酸10.52%, 组氨酸6.18%, 精氨酸12.49%, 色氨酸2.28%;a)每千克饲料中添加: A 16000 IU, D38000 IU, K314.72 mg, B117.80 mg, B248.00 mg, B629.52 mg, Bl20.24 mg, E 160 mg, C 800 mg, 烟酸胺79.20 mg, 泛酸钙73.60 mg, 叶酸6.40 mg, 生物素0.64 mg, 肌醇320 mg, 氯化胆碱1500 mg,-肉碱100 mg;b)每千克饲料中添加: 铜(CuSO4·5H2O) 2.00 mg, 锌 (ZnSO4·5H2O) 34.44 mg, 锰(MnSO4·75H2O) 6.20 mg, 铁 (FeSO4·7H2O) 21.09 mg, 碘(Ca(IO3)2)1.63 mg, 硒 (Na2SeO3) 0.18 mg, 钴 (CoCl2·5H2O) 0.24 mg, 镁(MgSO4·H2O) 52.70 mg
Note:1)Basal protein ingredients (air-dry basis): fish meal 56.72%, corn gluten meal 7.46%, wheat gluten meal 11.94%, soybean meal 16.42%, spray-dried blood meal 7.46%;2)Premix: squid viscera meal 1.00%, brewer’s yeast meal 1.00%, brewer’s yeast extract 1.00%, soybean phospholipid 1.00%, vitamin premixa)0.80%, mineral premixb)1.00%, ascorbic acid 0.05%, chromic oxide 0.50%, choline chloride 0.30%;3)Coated essential amino acids: methionine 4.98%, lysine 13.11%, threonine 7.28%, valine 12.90%, isolecine 9.33%, lecinine 20.92%, phenylalanine 10.52%, histidine 6.18%, arginine 12.49%, tryptophane 2.28%;a)Added to a kilogram of diet: vitamin A 16000 IU, vitamin D38000 IU, vitamin K314.72 mg, vitamin B117.80 mg, vitamin B248.00 mg, vitamin B629.52 mg, vitamin Bl20.24 mg, vitamin E 160 mg, ascorbic acid 800 mg, niacinamide 79.20 mg, calcium--pantothenate 73.60 mg, folic acid 6.40 mg, biotin 0.64 mg, inositol 320 mg, choline chloride 1500 mg,-carnitine 100 mg;b)Added to a kilogram of diet: Cu (CuSO4·5H2O) 2.00 mg, Zn (ZnSO4·5H2O) 34.44 mg, Mn (MnSO4·75H2O) 6.20 mg, Fe (FeSO4·7H2O) 21.09 mg, I (Ca(IO3)2)1.63 mg, Se (Na2SeO3) 0.18 mg, Co (CoCl2·5H2O) 0.24 mg, Mg (MgSO4·H2O) 52.70 mg

表2 试验饲料的氨基酸组成分析(%, 风干基础)
注:a)和b)分别为大口黑鲈饲料中蛋氨酸[12]和赖氨酸(待发表)需求量;c)色氨酸含量根据NRC(2011)[18]提供的各饲料原料中所含色氨酸含量和晶体色氨酸的添加量计算而得
Note:a)andb), the dietary methionine[12]and lysine (unpublished) requirements of largemouth bass.c), tryptophane concentrations are calculated according to the ingredient data from NRC (2011)[18]and the amounts of supplemented crystalline tryptophan
2 结果
2.1 试验鱼的生长、饲料利用率和成活率
表3显示, 饲料的蛋白质水平和晶体必需氨基酸的补充对试验鱼的生长、饲料利用率和成活率均产生显著影响(<0.05)。随着饲料蛋白质水平的降低, 试验鱼的特定生长率、饲料效率、蛋白质保留率和成活率呈显著下降趋势(<0.05)。添加必需氨基酸的35AA和30AA组的饲料效率、蛋白质保留率和成活率分别显著高于对应的未添加必需氨基酸的35CP组和30CP组(<0.05), 但40AA组与40CP组之间的生长、饲料效率和成活率无显著性的差异(>0.05)。在生长方面, 仅有30AA组的特定生长率显著高于30CP组(<0.05), 而40AA组和35AA组均与对应的40CP组和35CP组无显著性差异(>0.05)。添加必需氨基酸的40AA、35AA和30AA组与对照组45CP相比, 除40AA组的特定生长率与对照组无显著性差异外, 其他添加必需氨基酸的两组的特定生长率、饲料效率和蛋白质保留率均显著地低于45CP对照组(<0.05)。
回归分析得出, 无论是没有添加晶体必需氨基酸的45CP、40CP、35CP和30CP的饲料还是添加了晶体必需氨基酸的40AA、35AA和30AA饲料, 它们的蛋白质水平(CP和AA)与试验鱼的生长(1SGR和2SGR)、饲料效率(1FE和2FE)和蛋白质保留率(1PR和2PR)之间都存在着高度相关的线性关系。关系式分别为:1SGR= 0.0311CP+ 0.7196,2= 0.9892;2SGR= 0.0261AA+ 0.9360,2= 0.8354;1FE= 0.0431CP– 0.4365,2= 0.9955;2FE= 0.0351AA– 0.1984,2= 0.9764;1PR= 1.2057CP– 3.1931,2= 0.9814;2PR= 0.5743AA+ 22.231,2= 0.9748。然而, 就3种添加了晶体必需氨基酸的饲料而言, 它们的必需氨基酸水平却与生长、饲料效率和蛋白质保留率不呈现出线性正相关。
2.2 试验鱼的体组成、体型、脏体比和肝体比
由表4可知, 试验鱼全鱼和肌肉的粗蛋白质水平随着饲料蛋白质含量减少而显著降低(<0.05)。全鱼的粗脂肪含量则呈递增趋势, 但肌肉中的粗脂肪含量未受显著的影响(>0.05)。添加晶体必需氨基酸的饲料35AA和30AA与各自对应的35CP和30CP相比, 能显著增加全鱼的蛋白质含量, 但仍低于对照组45CP试验鱼的蛋白质含量(<0.05)。全鱼和肌肉的水分和粗灰分未受饲料的影响(>0.05)。
试验鱼肥满度、脏体比和肝体受到饲料蛋白质水平和添加晶体必需氨基酸的影响(表5)。饲料蛋白质水平降低, 试验鱼的肥满也降低; 30AA组的肥满度显著高于30CP组(<0.05)。脏体比和肝体比受饲料蛋白质水平的影响呈现由下降到上升的趋势, 但添加必需氨基酸并未使这两个指标呈现显著的不同(>0.05)。
2.3 试鱼的免疫指标
如表6所示, 试验鱼的血清溶菌酶活性、补体活性和头肾白细胞呼吸爆发活性随饲料蛋白质水平降低而显著下降(<0.05)。在饲料中添加必需氨基酸能不同程度地提高有关免疫指标。40AA组的血清溶菌酶活性和血清补体活性与45CP组相比, 均无显著差异(>0.05), 但30AA组显著低于45CP组(<0.05)。35AA和30AA的头肾白细胞呼吸爆发活性均显著高于相对应的35CP和30CP组, 但显著低于45CP 对照组(<0.05)。
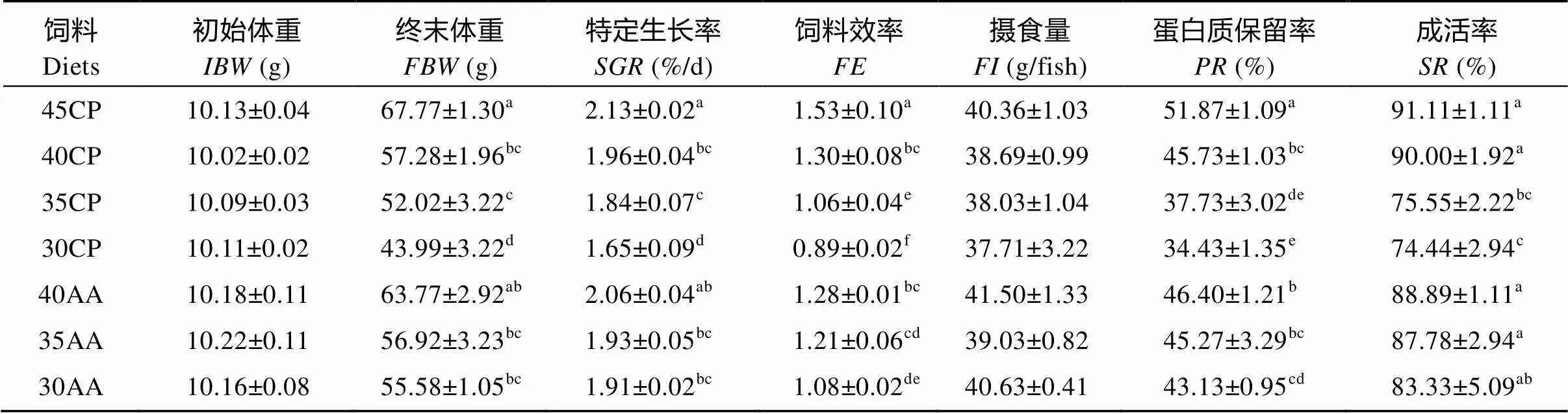
表3 饲料蛋白质水平和必需氨基酸的补充对大口黑鲈生长和饲料利用的影响(平均值±标准误)
注: 同列数据无字母或具相同上标字母表示差异不显著(>0.05)。下表同
Note: In the same column, values with no letter or the same superscript means no significant difference (>0.05). The same applies bellow
表4 饲料蛋白质水平和必需氨基酸的补充对大口黑鲈体组成的影响(平均值±标准误)
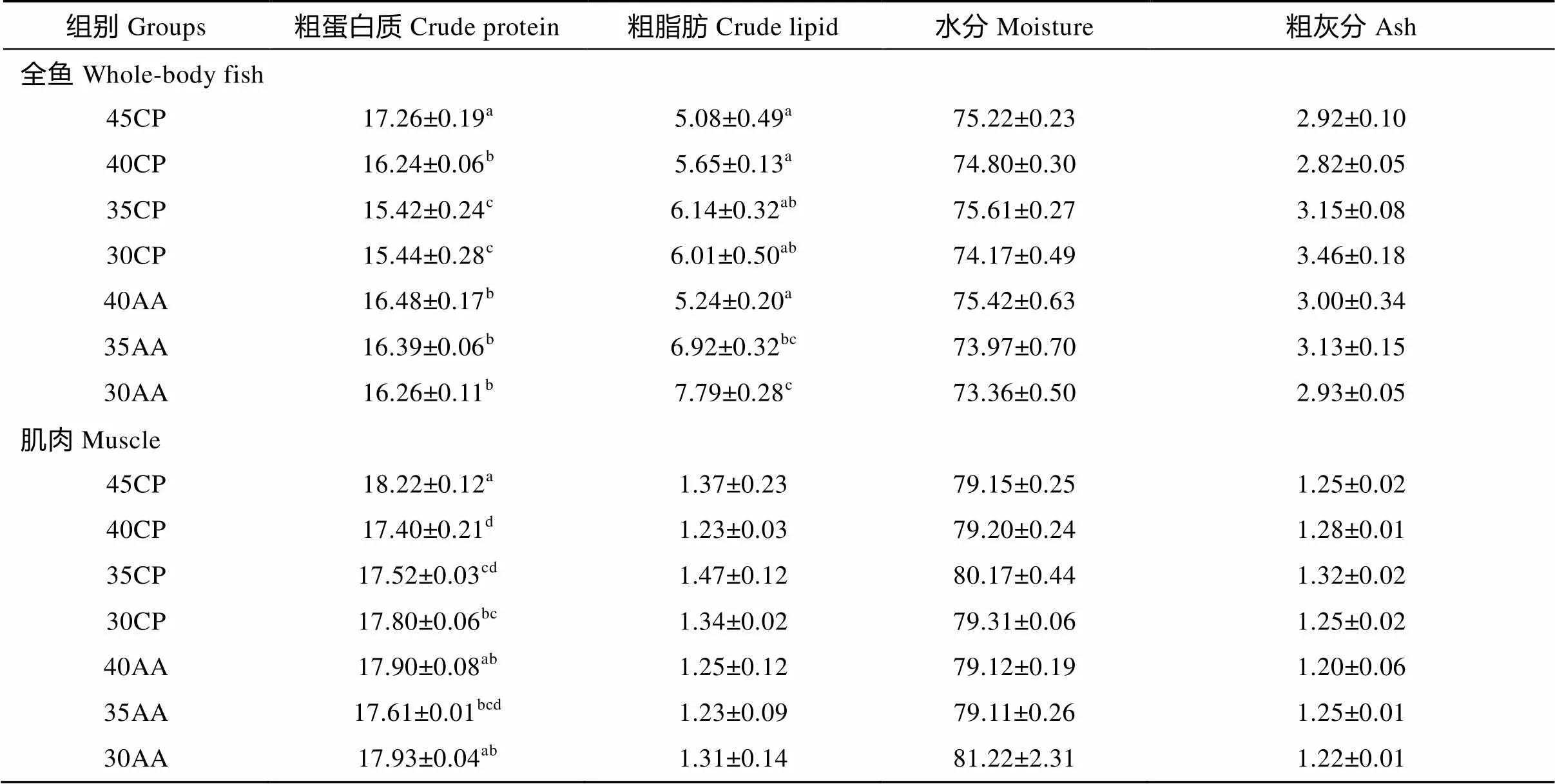
Tab.4 Effects of dietary protein levels and EAA supplementation on composition of largemouth bass (mean ± SE)

表5 饲料蛋白质水平和必需氨基酸的补充对大口黑鲈体型、肝体比、脏体比的影响(平均值±标准误)
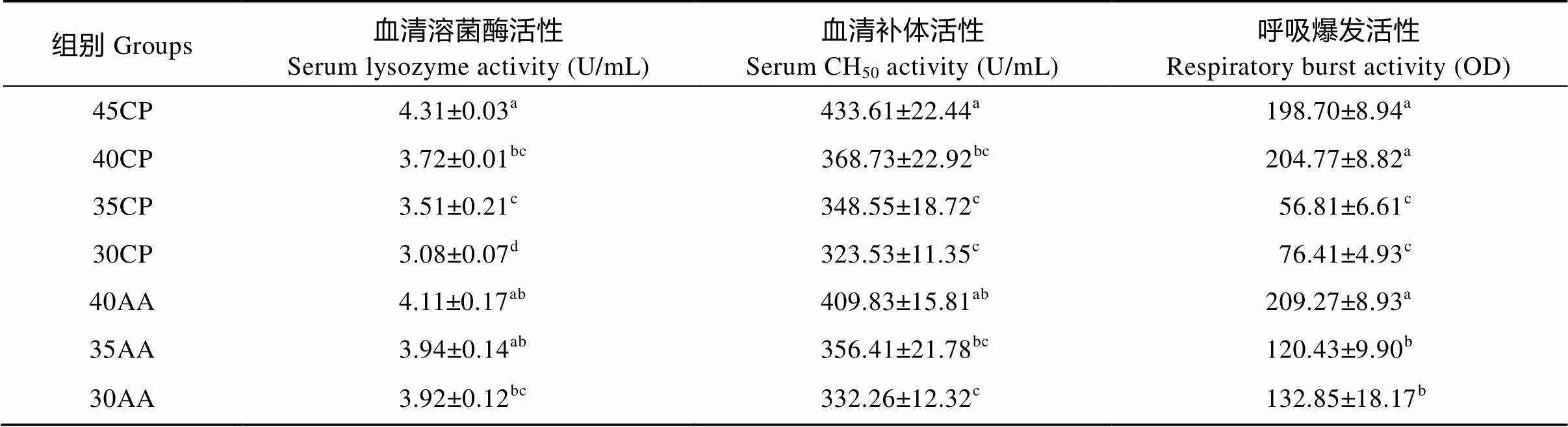
表6 饲料蛋白质水平和必需氨基酸的补充对大口黑鲈免疫指标的影响(平均值±标准误)
3 讨论
3.1 饲料的蛋白质水平对大口黑鲈生长、体组成和免疫指标的影响
本研究的45CP至30CP饲料的蛋白质水平呈梯度下降, 但这些饲料的氨基酸的组成模式相同。因此, 上述饲料引起的生长等指标的变化应归因于饲料的蛋白质水平。随着饲料蛋白质水平从45%降至30%, 试验鱼的生长、饲料利用率和免疫指标均显著降低(表3和表6)。饲料的蛋白质水平对牙鲆()[21]和宝石鲈()[22]等鱼类的生长也有类似的情形。如果以本研究的特定生长率、饲料效率和蛋白质保留率作判断, 大口黑鲈饲料适宜的蛋白质需要量应在45%或以上。但就饲料效率和蛋白质保留率而言, 45CP和40CP饲料已取得了比其他研究更加优异的效果[11—13]。本研究在这一方面所取得的突破也将为大口黑鲈高效实用饲料的配制提供借鉴。

饲料的蛋白质水平对鱼类的免疫力影响的研究报道尚不多见。Kiron,[29]对虹鳟()的研究显示, 摄食35%蛋白质饲料的试验鱼的血清溶菌酶活性显著高于摄食较低蛋白质饲料组, 但与高蛋白饲料组的差异不显著。蔡春芳等[30]的试验表明, 饲料蛋白质水平对异育银鲫()免疫力有显著影响, 饲料蛋白质水平在28%时免疫力最高, 过低或过高的饲料蛋白质水平都将导致试验鱼的免疫力下降。王吉桥等[31]在对黄颡鱼()的研究也同样发现, 与投喂蛋白质为30%和46%的饲料相比, 投喂蛋白质含量为38%的饲料时, 试验鱼的免疫指标最佳。在本试验中, 摄取45CP与40CP的试验鱼的血清补体活性、头肾呼吸暴发活性均无显著差异, 但随着饲料蛋白质含量进一步的降低, 试验鱼的这两个免疫指标呈现出显著降低的趋势。这说明适宜的饲料蛋白质水平为大口黑鲈拥有良好的免疫力所必需, 但饲料蛋白质水平过高对其免疫指标则无明显的促进作用。
3.2 饲料中添加晶体必需氨基酸对大口黑鲈生长、体组成和免疫指标的影响
本研究得出, 在较低蛋白质的饲料中添加晶体必需氨基酸能发挥改善生长和蛋白质保留率的作用。由35AA与35CP 以及30AA与30CP相比可知, 摄食添加必需氨基酸饲料的试验鱼的特定生长率和饲料效率分别提高了4.89%—15.76%和14.15%— 21.35%。40AA与对照组45CP相比却发现, 摄食40AA的试验鱼的蛋白质保留率、特定生长率与摄食45CP的试验鱼相比差异不显著, 但饲料效率仍有显著的差异; 而35AA和30AA的试验鱼与45CP的试验鱼相比, 上述各项指标均有显著差异。这一方面表明, 在低蛋白质饲料中, 以晶体氨基酸补足必需氨基酸能改善大口黑鲈的生长、饲料效率和蛋白质利用率; 另一方面又说明, 仅仅补足必需氨基酸的饲料难以全面提高至以鱼粉为主要蛋白源并具有适宜水平的饲料所产生的总体效用。这与Gaylord,[32]在虹鳟()的试验中得出的结论相似。该试验通过向饲料中补充晶体赖氨酸、蛋氨酸和苏氨酸, 虹鳟饲料的蛋白质水平由46%降至41.5%, 对虹鳟()的生长无影响。Cheng,[33]和Botaro,[34]的研究也指出, 补足晶体必需氨基酸能够分别降低5%和3%的饲料蛋白质水平而不影响试验鱼的正常生长。但上述情况与Yamamot,[35]关于虹鳟()的研究结果有所不同。该研究通过向以鱼粉为主要蛋白源的试验饲料中添加晶体必需氨基酸至需求量的1.2倍, 饲料的粗蛋白质含量从45%降至30.6%, 不仅对试验鱼的生长没有负面影响, 而且还提高蛋白质的利用率。
本研究得出, 添加晶体必需氨基酸的饲料, 能显著增加全鱼的蛋白质含量, 在一定程度上也能提高肥满度, 降低肝体比和脏体比。这与在草鱼()[36]和虹鳟()[35]的研究结果基本相一致, 表明在饲料的必需氨基酸缺乏时, 晶体必需氨基酸的补充有助于改善体组成。
本研究结果显示, 40AA、35AA和30AA的试验鱼的免疫指标呈下降态势, 但均高于各自对应的40CP、35CP和30CP的试验鱼, 唯40AA组的血清溶菌酶活性能达到45CP对照组的水平。这表明在低蛋白质饲料中添加晶体必需氨基酸可提高大口黑鲈机体的免疫指标。陈乃松等[11]关于大口黑鲈蛋氨酸需求量的研究表明, 饲料中的蛋氨酸缺乏时, 晶体蛋氨酸的补充也有利于试验鱼的非特异性免疫力的提高。在对幼建鲤(Jian)的研究中发现, 添加晶体色氨酸[37]、苏氨酸[38]可促进鱼类免疫器官的生长, 增强鱼类非特异性免疫力。
3.3 影响大口黑鲈对饲料中晶体必需氨基酸利用效率的因素
在补充晶体必需氨基酸的饲料中, 尽管40AA、35AA和30AA中的必需氨基酸的组成模式与含量基本与45CP相一致(表2), 但除了40AA外, 试验鱼的生长性能、体组成和免疫指标均未达到45CP对照组的水平。这种现象的产生可能有两方面的原因。一方面, 添加的晶体氨基酸可能未被充分地有效利用[39]。有研究表明, 在一些鱼类中, 饲料中游离态的氨基酸与结合态的氨基酸存在着吸收不同步的现象。晶体氨基酸在肠道被吸收远快于结合态氨基酸, 导致与结合态氨基酸的合成代谢不同步, 饲料中的部分氨基酸被氧化分解, 从而参与合成蛋白质的氨基酸减少。也有研究表明, 晶体氨基酸的包膜有助于延迟晶体氨基酸在肠道中的被吸收时间, 从而提高水产动物对饲料中两种来源的氨基酸的利用率[40, 41]。本研究采用我们先前的方法[12, 13]对晶体氨基酸作了包膜处理, 这被证明对解决氨基酸的同步吸收是有效的。另一方面, 饲料中的非必需氨基酸的缺乏或不平衡也可能影响动物的蛋白质代谢。有学者提出, 非必需氨基酸在调节动物代谢和生理过程中具有多种独特的功能, 从而影响试验动物的健康和饲料转化率。Krizova,[42]认为, 非必需氨基酸是猪体蛋白质分解产生的氨基酸重复利用的限制性因素, 或者是作为肠道微生物氨基酸合成过程中的前提物质。在鱼类中, Gaye,[43]研究得出, 饲料中非必需氨基酸能显著影响试验鱼的脂肪和蛋白质的积累以及能量的获得。Tarik,[44]发现, 在大西洋鲑()处于维持状态时非必需氨基酸对于鱼体内蛋白质代谢起着很重要的作用。在本研究的40AA、35AA和30AA中尽管它们的必需氨基酸是等量的, 但非必需氨基酸是递减的。基于上述非必需氨基酸的营养与生理功用的重要性, 可以推理: 在大口黑鲈的饲料中非必需氨基酸对于其生长、体组成和免疫指标也许有着重要的影响。这将值得进一步的研究与证实。
4 结论
以特定生长率、饲料效率和蛋白质保留率为评价指标, 大口黑鲈幼鱼的饲料蛋白质水平在45%或以上较为适宜。在低蛋白质饲料中补充晶体必需氨基酸在不同程度上能提高大口黑鲈幼鱼的生长、饲料利用效率和免疫指标, 但仅补充游离必需氨基酸的饲料依然不及以蛋白质配制的饲料的总体效能。
[1] Wilson R P. Animal Acids and Proteins [M]. New York: Academic Press. 2002, 143—148
[2] Kaushik S J, Seiliez I. Protein and amino acid nutrition and metabolism in fish: current knowledge and future needs [J]., 2010, 41(3): 322—332
[3] Verstegen M W A, Jongbloed A W. Crystalline Amino Acids and Nitrogen Emission [M]. Wallingford: CABI Publishing. 2003, 449—458
[4] Rodehutscord M, Becker A, Pack M,. Response of rainbow trout () to supplements of individual essential amino acids in a semipurified diet, including an estimate of the maintenance requirement for essential amino acids [J]., 1997, 127(6): 1166—1175
[5] Konrad D, Zhang Y F, Karolina K,. Effects of protein-, peptide- and free amino acid-based diets in fish nutrition [J]., 2010, 41(5): 668—683
[6] Anderson R J, Kienholz E, Flickinger S,. Protein requirements of smallmouth bass and largemouth bass [J]., 1981, 111(6): 1085
[7] Qian G Y. Effects of dietary protein, fibre and fat of the growth of largemouth bass () [J]., 1998, 7(3): 193—199[钱国英. 饵料中不同蛋白质, 纤维素, 脂肪水平对大口黑鲈生长的影响. 上海水产大学学报, 1998, 7(3): 193—199]
[8] Tidwell J H, Webster C D, Coyle S D,. Effects of dietary protein level on second year growth and water quality for largemouth bass () raised in ponds [J]., 1996, 145(1—4): 213—223
[9] Portz J E P, Cyrino R C, Martino. Growth and body composition of juvenile largemouth bassin response to dietary protein and energy levels [J]., 2001, 7(4): 247—254
[10] Chen N S, Xiao W W, Liang Q L,. Effects of lipid to protein ratios on growth performance, body composition and non-specific immunity of largemouth bass () [J]., 2012, 36(8): 1270—1280 [陈乃松, 肖温温, 梁勤朗, 等. 饲料中脂肪与蛋白质比对大口黑鲈生长、体组成和非特异性免疫的影响. 水产学报, 2012, 36(8): 1270—1280]
[11] Dairiki J K, Dias C T, Cyrino J. Lysine requirements of largemouth bass,: a comparison of methods of analysis of dose-response trials data [J]., 2007, 19(4): 1—27
[12] Chen N S, Ma J Z, Zhou H Y,. Assessment of dietary methionine requirement in largemouth bass,[J]., 2010, 34(8): 1245—1253 [陈乃松, 马建忠, 周恒永, 等. 大口黑鲈对饲料中蛋氨酸需求量的评定. 水产学报, 2010, 34(8): 1245—1253]
[13] Zhou H, Chen N, Qiu X. Arginine requirement and effect of arginine intake on immunity in largemouth bass,[J]., 2012, 18(1): 107—116
[14] Lee S M. Apparent digetibility coeffidients of various feed ingredients for juvenile and grower rockfish () [J]., 2002, 207(1—2): 79—95
[15] AOAC. Official Methods of Analysis [M]. 16th edition. Arlington,V.A:Chemists:Association of Official Analytical Chemists.1995, 1234—1565
[16] Lee C, Trevino B, Chaiyawat M,. A simple and rapid solvent extraction method for determining total lipids in fish tissue [J]., 1996, 79(2): 487—492
[17] Liames C R, Fontaine J. Determination of amino acids in feeds: Collaborative study [J]., 1994, 77(6): 1362—1402
[18] NRC. Nutrient Requirements of Fish [M]. Washington, D C: National Academy Press. 2011, 337—339
[19] Sitj-Bobadilla A, Mingarro M, Pujalte M J,. Immunological and pathological status of gilthead sea bream (L) under different long-term feeding regimes [J]., 2003, 220(1—4): 707—724
[20] Secombes C J. Isolation of salmonid macrophages and analysis of their killing activity [J]. In: Stolen J S, Fletcher T C, Anderson D P, et al(Eds), TechniquesinFish Immunology(C). New Jersey: SOS Publications. 1990, 137—154
[21] Kim K W, Wang X J, Bai S C. Optimum dietary protein level for maximum growth of juvenile olive flounder(Temminck et Schlegel) [J]., 2002, (33): 673—679
[22] Shao Q J, Su X F. Effect of dietary protein levels on growth performance and body composition of jade perch () [J]., 2004, 28(4): 367—373 [邵庆均, 苏小凤. 饲料蛋白水平对宝石鲈生长和体组成影响研究. 水生生物学报, 2004, 28(4): 367—373]
[23] Tibbetts S M, Lall S P, Anderson D M. Dietary protein requirement of juvenile American eel () fed practical diets [J]., 2000, 186(1—2): 145—155
[24] Reis L M, Reutebuth E M. Protein to energy ratios in production diets and growth, feed conversion and body composition of channel catfish[J]., 1989, 77(1): 21—27
[25] Clark A E, Watanabe W O. Growth, feed conversion and protein utilization of Florida red tilapia fed isocaloric diets with different protein levels in seawater pools [J]., 1990, 88(1): 75—85
[26] Dabrowski K. Protein requirement of grass carp[J]., 1977, 12(1): 63—73
[27] Chen H Y, Tsai J C, Su M S,. Optimal dietary protein level for the growth of juvenile grouper,, fed semipurified diets [J]., 1994, 119(2—3): 265—271
[28] Shiau S Y, Lan C W. Optimal dietary protein level and protein to energy ratio for growth of grouper () [J]., 1996, 145(1—4): 259—266
[29] Kiron V. Protein nutrition and mechanisms in rainbow trout[J].:, 1995, 111(3): 351—359
[30] Cai C F, Wu K. The effects of protein nutrition on growth and immunological activity of allocgynogenetic silver crucian carp [J]., 2001, 25(6): 590—595 [蔡春芳, 吴康. 蛋白质营养对异育银鲫生长和免疫力的影响. 水生生物学报, 2001, 25(6): 590—595]
[31] Wang J Q, Wang W H, Li W K,Effects of dietary protein and vitam in C levels on growth and immunity of juvenile[J]., 2005, 29(4): 512—518 [王吉桥, 王文辉, 李文宽, 等. 饲料蛋白质和维生素C含量对黄颡鱼生长和免疫力的影响. 水产学报, 2005, 29(4): 512—518]
[32] Gaylord T G. Multiple amino acid supplementations to reduce dietary protein in plant-based rainbow trout ()feeds [J]., 2009, 287(1—2): 180—184
[33] Cheng Z J, Hardy R W. Plant protein ingredients with lysine supplementation reduce dietary protein level in rainbow trout () diets, and reduce ammonia nitrogen and soluble phosphorus excretion [J]., 2003, 218(1): 553—565
[34] Botaro D, Furuva W M. Dietary protein reduction based on ideal protein concept for Nile tilapia () cultured in net pens [J]., 2007, 36(3): 517—525
[35] Yamamto T, Sugita T. Essential amino acid supplementation to fish meal-based diets with low protein to energy ratios improves the protein utilization in juvenile rainbow trout[J]., 2005, 246(1—4): 379—391
[36] Ye Y T, Tan F F. Effects of microcapsule lysine and methionine supplementation on growth performance of grass crap () [J]., 2010, 22(3): 804—810. [叶元土, 谭芳芳. 补充微囊赖氨酸和蛋氨酸对草鱼生长性能的影响. 动物营养学报, 2010, 22(3): 804—810]
[37] Tang L. The study of the effects of tryptophan on digestive and absorbtive capacity, disease resistant, and the TOR expression in organs and tissue in Jian carp (var. Jian) [D]. Thesis Master of Science. Sichuan Agricultural University, Ya’an. 2009 [唐凌. 色氨酸对幼建鲤消化吸收能力和疾病抗病能力及其组织器官中TOR表达影响研究. 硕士学位论文, 四川农业大学, 雅安. 2009]
[38] Feng L. Effect of threonine on digestive, absorb, immune function and TOR gene expression in organ and tissues of juvenile Jian carp [D]. Thesis Master of Science. Sichuan Agricultural University, Ya’an. 2009 [冯琳. 苏氨酸对幼建鲤消化吸收能力和抗病力以及组织器官中蛋白质调控信号分子TOR表达的影响. 硕士学位论文, 四川农业大学, 雅安. 2009]
[39] Ambardekar A A, Reigh R C, Williams M B,. Absorption of amino acids from intact dietary proteins and purified amino acid supplements follows different time-courses in channel catfish () [J]., 2009, 291(3—4): 179—187
[40] Roelants I. Effective supplementation of arginine in the diets of juvenile marine shrimp,[J]., 1992, 108(1—2): 87—95
[41] Chen B A, Leng X J, Li X Q,Study on the effect of crystalline of coated amino acids for[J]., 2008, 32(5): 774—778 [陈丙爱, 冷向军, 李小勤, 等. 晶体或包膜氨基酸对鲤鱼的作用效果研究. 水生生物学报, 2008, 32(5): 774—778]
[42] Krizova K, Simecek K, Heger J,. Effect of nonessential amino acids on nitrogen retention in growing pigs fed on a protein-free diet supplemented with sulphur amino acids, threonine and tryptophan [J]., 2001, 85(9—10): 325—332
[43] Gaye S J, Focken U, Abel H J,. Influence of dietary non-essential amino acid profile on growth performance and amino acid metabolism of Nile tilapia,(L.) [J]., 2007, 146(1): 71—77
[44] Tarik A, Muriel M, Yvan L,. The effect of dispensable amino acids on nitrogen and amino acid losses in Atlantic salmon (L.) fry fed a protein-free diet [J]., 2009, 289(3—4): 327—333
Effects of Supplementing EAA to LowER protein diets on Growth, Body Composition and IMMUNOLOGICAL INDEX of Largemouth Bass ()
CHEN Nai-Song, LIANG Qin-Lang, XIAO Wen-Wen, ZHOU Heng-Yong, MA Xiu-Li and ZHAO Ming
(College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China)
An 89-day growth trial was undertaken to evaluate effects of essential amino acid (EAA) supplementation to diets with lower protein levels on growth performance, body composition and immunological parameters in largemouth bass (). Seven isoenergetic diets were formulated according to the EAA profile of whole body of largemouth bass. Four diets of them contained crude protein concentrations of 45%, 40%, 35% and 30%, respectively (designated as 45CP, 40CP, 35CP and 30CP). The other three diets (designated as 40AA, 35AA and 30AA) were formulated by adding EAA to three lower protein diets of 40CP, 35CP and 30CP to make their EAA levels consistent with that of 45CP (used as a control). Triplicate groups of thirty juvenile largemouth bass with initial body weight of (10.13±0.01) g were reared in an indoor water-circulating system. It was showed by one-way ANOVA that growth performance, feed utilization, crude protein concentrations of whole body and muscle, immunological index and survival rate declined significantly among fish fed the diets with a reduction of dietary protein from 45% to 30% (<0.05). Feed efficiency and protein retention in fish fed 35AA and 30AA were significantly higher than those of 35CP- and 30CP-fed fish (<0.05), respectively. There were no significances in serum lysozyme activity and serum complement activity between 40AA-fed fish and 45CP-fed fish (>0.05). Respiratory burst activity of head kidney leukocytes with 35AA-fed fish and 30AA-fed fish was significantly higher (<0.05), compared to those of 35CP and 30CP, respectively. Crude protein concentrations of whole-body and condition factor of 30AA-fed fish were significantly higher than those 30CP-fed fish (<0.05). Among all the treatments, moisture and ash of whole body and muscle of tested fish showed no significant differences (>0.05). It was suggested by regression analysis that the effects of supplementing EAA to lower protein diets on,andin juvenile largemouth bass were positively related with increased levels of dietary protein rather than those of dietary EAA. This study indicates that crystalline EAA supplemented to lower protein diets for juvenile largemouth bass can cause improvement in growth performance, feed efficiency and immunological index but the improvement is inferior to what is caused by the same levels of EAA deriving from proteins.
Largemouth bass (); Diet; Essential amino acid; Protein; Growth; Body composition; Immunological index
2013-05-30;
2013-12-09
上海市科委高校能力建设项目(10320503100); 上海高校知识服务平台(ZF1206)资助
陈乃松(1961—), 男, 江苏滨海人; 教授; 主要从事水产动物营养与饲料学专业。E-mail: nschen@shou.edu.cn
S965.1
A
1000-3207(2014)02-0262-10
10.7541/2013.39
