HPLC-ELSD法测定金线莲提取物中金线莲苷
2014-11-04熊富良
万 婷,熊富良
(武汉理工大学化学工程学院,湖北武汉 430070)
金线莲Anoectochilus roxburghi,即花叶开唇兰,又名金蚕、金线兰等,是兰科开唇兰属的一种多年生的草本植物[1]。它主要分布于亚洲的日本、中国、印度和尼泊尔等国,我国的福建、贵州、台湾等省也都有比较丰富的金线莲资源[2]。金线莲是我国传统的珍贵药材,有清热解毒、滋补养阴降火、消炎减轻疼痛等功效[3]。在现代中药研究中,金线莲多用于糖尿病、高脂血、乙型肝炎等疾病的治疗[4]。随着对金线莲研究的不断加深,金线莲的优良治疗效果日益得到瞩目,受到广大民众的青睐,具有广阔的开发前景。
金线莲苷 (kinsenoside)是金线莲的特质性成分,为葡萄糖与五元内酯环的手性碳以氧苷键形式连接形成的苷[5],据文献报道该属植物含金线莲苷的水提物有保护肝脏、降血脂、降低血糖、止痛、消炎等广泛的药理活性[6-7]。因此本研究主要是对金线莲中的金线莲苷类成分进行提取纯化,并对金线莲苷进行定量分析研究,建立HPLC-ELSD测定方法。有少量文献发表金线莲苷的定量测定方法[8],但是其检测方法分离度不高,准确性不是很好。
1 实验材料
美国戴安公司DIONEX P680高效液相色谱仪(P680型输液泵、真空脱气机、自动进样器、柱温箱、Chromeleon色谱工作站);SEDEX 75型蒸发光散射检测器 (法国迪马公司);Hypersil NH2色谱柱 (5 μm,4.6 mm ×250 mm);AB204-N型万分之一电子分析天平 (美国METTLER TOLEDO公司);LC-350A型超声波中药处理机 (山东济宁鲁超超声设备有限公司)[9]。
金线莲药材 (华中科技大学同济医学院药学院提供,经中国科学院武汉植物研究所王映明教授鉴定)。金线莲苷对照品为自制,纯度经 TLC、HPLC、质谱、熔点和旋光度测定等进行纯度鉴定,纯度在98%以上,符合“中药新药质量标准用对照品研究的技术要求”[10];金线莲提取物样品(自制,批号分别为20130401、20130502、20130503);乙腈为色谱纯 (美国Tedia公司);水为超纯水;其余试剂均为分析纯。
2 方法与结果
2.1 金线莲提取物样品制备 取干燥的金线莲药材,剪碎,加20倍量95%乙醇回流提取3次,每次2 h。将3次提取液合并,浓缩至无醇味,加入20倍水,搅匀,静置过夜,离心,过滤,得上清液。将上清液浓缩至比重为1.3左右,上DM131大孔吸附树脂,用水洗脱,收集流出液,减压浓缩,真空干燥即得金线莲提取物。
2.2 色谱条件与系统适用性试验 Hypersil NH2色谱柱 (5 μm,4.6 mm×250 mm);流动相为乙腈-水 (92 ∶8)[11];体积流量为1.0 mL/min;柱温30℃;蒸发光散射检测器雾化室温度为40℃;载气为高纯氮气,氮气压力为350 kPa[12];信号值为7。理论塔板数按金线莲苷峰计算不低于10000,系统适用性良好。
2.3 溶液制备
2.3.1 对照品溶液的制备 精密称取金线莲苷对照品适量,加甲醇制得每1 mL含0.5 mg的金线莲苷,摇匀,即得。
2.3.2 供试品溶液的制备 取本品,研细,精密称取约0.2 g,置100 mL具塞锥形瓶中,精密加入50 mL水,密塞,超声处理30 min,摇匀,滤过,取续滤液。精密量取1 mL续滤液,置于10 mL量瓶中,加乙醇至刻度,摇匀,即得。
2.3.3 空白溶剂样品溶液的制备 精密量取1 mL水,置于10 mL量瓶中,加乙醇至刻度,摇匀,即得。
2.4 专属性试验 分别精密吸取对照品溶液、供试品溶液和空白溶剂样品溶液各10 μL,注入液相色谱仪,记录色谱图。结果显示,本方法专属性较好,溶剂无干扰,见图1。
2.5 线性关系考察 精密量取对照品溶液 (金线莲苷 0.524 mg/mL)1.0、2.0、3.0、4.0、5.0、10 mL,置于10 mL量瓶中,加甲醇至刻度,摇匀,精密吸取上述溶液各10 μL,注入液相色谱仪,测定峰面积,以峰面积积分值 (mAu×min)的对数值为纵坐标 (Y),对照品的进样量 (μg)的对数值为横坐标 (X)进行线性回归,得金线莲苷回归方程为Y=0.7527X-1.2561(r=0.99993),线性范围为 0.524 ~5.24 μg。
2.6 检测限和定量限考察 量取对照品溶液,逐步稀释成一系列浓度由高到低的对照品溶液,按“2.2”项色谱条件进样,测得检测限 (S/N=3)和定量限 (S/N=10)分别为0.1514、0.5073 μg。
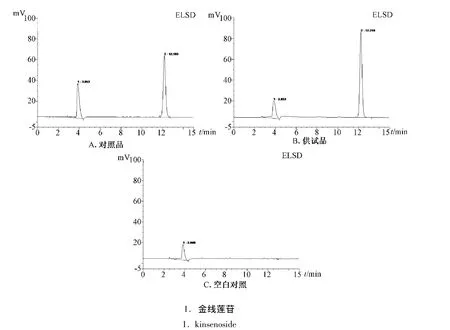
图1 高效液相色谱图Fig.1 HPLC chromatograms of kinsenoside reference substances,sample and negative sample
2.7 精密度试验 精密吸取上述供试品溶液,按“2.2”项色谱条件连续重复进样6次,测定峰面积。结果金线莲苷RSD为1.56%,表明仪器精密度良好。
2.8 稳定性试验 取供试品溶液,按“2.2”项色谱条件,分别于0、1、2、3、4、6 h进样,测定峰面积。结果金线莲苷峰面积的RSD为1.87%,表明供试品溶液在6 h内稳定性良好。当供试品溶液超过6 h进样后,峰面积的RSD值超过2%,达不到稳定性试验的要求。
2.9 重复性试验 取同一批号样品 (批号20130401)0.2 g,平行称取6份,按“2.3.2”项下处理,按“2.2”项色谱条件测定,计算。结果金线莲苷含有量为48.03%,RSD为1.64%,表明该方法重复性良好。
2.10 加样回收试验 取已知含有量的样品 (批号20130401)0.1 g,平行称取6份,精密称定,置50 mL量瓶中,精密加入对照品溶液10 mL(金线莲苷4.84 mg/mL,溶剂为水),加水至刻度,密塞,超声处理30 min,摇匀,滤过,取续滤液。精密量取续滤液1 mL,置于10 mL量瓶中,加乙醇至刻度,摇匀,即得。按“2.2”项色谱条件,测定,计算回收率,结果见表1。
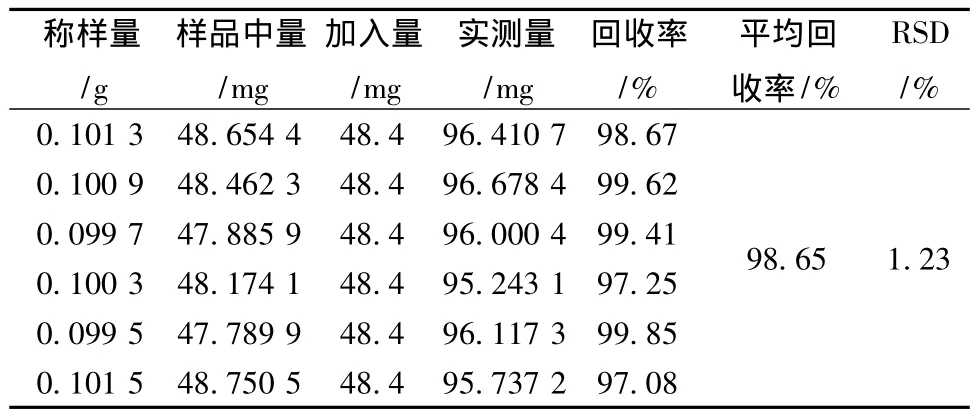
表1 加样回收试验结果 (n=6)Tab.1 Results of recovery tests(n=6)
2.11 样品测定 取3批样品,按上述“2.2”项色谱条件及方法测定,计算,结果见表2。

表2 样品测定结果 (n=5)Tab.2 Results of determination(n=5)
3 讨论
3.1 测定方法的选择 关于金线莲苷的成分定量测定的文献比较少,且都是采用的高效液相色谱与紫外检测器联用[8,13],作者也尝试按照文献的方法来测定金线莲苷的量,实验中发现金线莲苷的紫外吸收度非常小,而杂质的吸收很强,因此用紫外检测将无法正确测定金线莲苷的量。且采用C18柱时,金线莲苷极性较大,出峰时间过早,干扰较大,要达到分离度1.5的完全分离较困难,不适合作为药品的定量测定方法。后期研究发现采用HPLCELSD法,并且使用氨基柱,能够针对性地检测金线莲苷的量,金线莲苷出峰时间比较适当,分离度比较好,基本不存在干扰,检测方法灵敏度较高。
3.2 样品提取纯化方式的选择 根据金线莲苷结构得知,金线莲苷是一个五元环内酯与葡萄糖连接形成的苷类。所以金线莲苷极性偏大,易溶于水、乙醇和甲醇,但是由于金线莲苷的内酯环结构和苷类结构的影响,金线莲苷在酸碱性溶剂环境下不稳定,易开环分解。所以在前期对金线莲药材采取两种提取纯化方式,一种是水提醇沉,一种是醇提水沉。结果发现,醇提水沉效果要好于水提醇沉,可能跟金线莲苷在水环境下易分解有关系。
3.3 测定时,由于金线莲苷的不稳定性,所以供试品溶液在超过6 h后进针,峰面积的RSD超过2%。因此供试品溶液需要在配制的6 h内进针,才能准确地进行结果计算。另外,对流动相的组成和比例进行了研究,发现当提高乙腈在流动相中的比例时,金线莲苷的出峰时间推后,能够跟溶剂峰分离开来,但是当乙腈比例达到95%时,金线莲苷不出峰,因此要选择合适的流动相组成和比例。
[1]张红艳,潘 馨.金线莲化学成分及药理活性研究进展[J].海峡药学,2009,21(1):82-84.
[2]蔡金艳,张勇慧,吴继洲.药王金线莲挥发油及石油醚提取物的气相色谱-质谱-数据系统联用测定[J].时珍国医国药,2008,19(7):1550-1552.
[3]唐 菲,张小琼,徐江涛,等.金线莲降血糖活性部位的筛选[J].中草药,2011,42(2):340-342.
[4]何春年,王春兰,郭顺星,等.福建金线莲的化学成分研究[J].天然产物研究与开发,2005,17(3):259-262.
[5]张勇慧.金线莲苷及其衍生物及制备方法和用途:中国,CN200810236824.3[P].2008-12-12.
[6]Cui S C,Yu J,Zhang X H,et al.Antihyperglycemic and antioxidant activity of water extract from Anoectochilus roxburghii in experimental diabetes [J].Exp Toxicol Pathol,2013,65(5):485-488.
[7]张锦文,唐 菲,张小琼,等.高效液相色谱法测定金线莲中金线莲苷的含量[J].中国医院药学杂志,2011,31(4):261-263.
[8]蔡金艳.金线莲降血糖活性成分及作用机制的研究[D].武汉:华中科技大学,2006.
[9]万 婷,熊富良,高文天,等.骨康胶囊的质量控制研究[J].中成药,2012,34(6):1096-1099.
[10]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010.
[11]GB/T15038-2006,葡萄酒、果酒通用试验方法[S].北京:中国标准出版社,2006.
[12]季秀美,舒 展,徐琼明,等.HPLC-ELSD法测定白头翁总皂苷碱水解产物中8种皂苷[J].中草药,2013,44(11):1416-1419.
[13]Wu J B,Lin W L,Hsieh C C,et al.The hepatoprotective activity of kinsenoside from Anoectochilus formosanus[J].Wiley Inter Science,2007,24(21):58-61.
