党参ISSR-PCR反应体系的建立与优化△
2014-11-02张延红高素芳
张延红,高素芳
(甘肃中医学院 药学系,甘肃 兰州 730000)
党参ISSR-PCR反应体系的建立与优化△
张延红*,高素芳
(甘肃中医学院 药学系,甘肃 兰州 730000)
目的建立党参的ISSR-PCR反应体系,为今后利用ISSR标记技术进行党参鉴定及种质遗传多样性分析提供一个标准化程序。方法采用试剂盒法提取党参基因组DNA为模板,通过单因素实验分析了ISSR-PCR反应体系中MgCl2、dNTPs、引物浓度、TaqDNA聚合酶、模板DNA用量及退火温度对ISSR-PCR扩增的影响。结果建立了重复性好,分辨率高的ISSR-PCR反应体系,即在25μL反应体系中,含有10×PCR Buffer缓冲液2.5 μL,MgCl22.0 mmol·L-1,dNTPs 0.5 mmol·L-1,引物0.4 μmol·L-1,Taq DNA聚合酶1.0 U,模板DNA为30 ng;扩增程序为:94 ℃预变性5 min,然后94 ℃变性30 s,51.7 ℃退火1 min,72 ℃延伸1.5 min,共计35个循环,循环结束后在72 ℃延伸7 min,4 ℃保存。结论建立了适用于党参的ISSR-PCR反应体系,为应用ISSR技术鉴定党参种质资源、分子标记辅助选择育种及其遗传多样性研究奠定了基础。
党参;ISSR-PCR;反应体系;优化
党参为桔梗科植物党参CodonopsisPilosula(Franch.)Nannnf.的干燥根,为我国大宗、常用药材,也是甘肃道地药材之一,是中国常用的传统补益用药,具有补中益气、健脾益肺之功效,广泛用于脾肺虚弱、气短心悸、食少便溏、虚弱咳嗽等症[1]。近年来野生党参资源已十分稀少,个体间的距离也较远[2],因此,建立党参ISSR-PCR反应体系,进一步研究该物种的遗传多样性是一项十分必要的工作。
ISSR分子标记因具有操作简单、快速高效、遗传多态性高、重复性好等特点,近年来已广泛应用于植物品种鉴定,种质资源和遗传多样性的研究等方面。ISSR-PCR体系的专属性比较强,不同种植物,其反应体系有一定的差异,只有在最佳的条件下,才能获得稳定清晰的多态性条带[3-4]。本试验探讨了影响ISSR-PCR反应的多个因素,建立了党参ISSR-PCR反应体系,为进行党参种群间遗传分化的研究奠定基础。
1 材料与仪器
1.1 材料
试验所用党参种苗于2011年10月采自甘肃定西渭源县,以休眠芽为外植体进行组织培养,以试管苗的幼嫩茎叶作试材。
1.2 试剂
新型植物基因组DNA快速提取试剂盒(北京鼎国昌盛生物技术有限责任公司),10×PCR Buffer、Mg2+、dNTPs、TaqDNA聚合酶(科昊生物工程有限责任公司),ISSR引物(南京金斯瑞生物科技有限公司)。
1.3 仪器
DYY-7型转移电泳仪,DYCP-32型电泳槽,GelDox XR凝胶成像仪,Biometra-Tgradient PCR梯度扩增仪。
2 方法
2.1 基因组DNA的提取及检测
用试剂盒法并略做修改提取DNA:(1)在1.5 μL离心管中加入450 μL溶液A,然后加入β-巯基乙醇2.26 μL;(2)取样品70 mg,在研钵中加入液氮充分研磨成粉末状;(3)将研磨好的粉末加到以上预备好的溶液A中,65 ℃水浴25 min,期间颠倒混匀样品5次,(4)除RNA:水浴完后,加入10 μL RNase混匀,25 ℃下静置10 min;(5)加入400 μL溶液B,充分混匀,常温静置5 min;12 000 rpm离心5 min;(6)除蛋白:加入500 μL氯仿,12 000 rpm离心5 min;(7)小心将上清转到一个新的离心管中(勿将沉淀吸入),加入600 μL异丙醇,充分混匀,室温放置10 min;(8)12 000 rpm离心10 min,小心去上清(勿将DNA样品的沉淀倒出);(9)加入600 μL溶液C,颠倒混匀俩次,12 000 rpm离心5 min,弃废液;(10)重复步骤(9)一次;(11)于室温敞盖放置,至无明显乙醇味;(12)加入130 μL溶液D,离心管中即为基因组DNA溶液。在0.7%(M/V)琼脂糖凝胶中电泳后成像,检测提取的DNA质量,将质量好的于-20 ℃保存以备用。
2.2 ISSR-PCR反应的初始条件及程序
党参ISSR-PCR体系的建立参考其它几种药用植物的ISSR-PCR反应体系[5-7],确定初步的反应体系为:总体积25 μL,内含2.5 μL 10xPCR buffer,MgCl22.0 mmol·L-1,dNTPS 0.5 mmol·L-1,Primers 0.5 μmol·L-1,Taq DNA聚合酶0.5 U,模板DNA为30 ng。扩增程序为94 ℃预变性5 min,然后进行35个循环:94 ℃变性30 s,53.7 ℃退火1 min,72 ℃延伸1.5 min,循环结束后72 ℃延伸7 min,4 ℃保存。
2.3 退火温度的确定
利用梯度PCR模式,设定退火温度最低48.0 ℃,和最高58.0 ℃,扩增仪自动生成10个温度梯度:48.5、48.7、49.4、50.5、51.7、52.9、54.1、55.3、56.4、57.5 ℃;其余PCR扩增程序同2.2项下,以确定最佳退火温度。
2.4 ISSR-PCR反应体系的优化
党参ISSR-PCR反应体系的优化采用单因素试验,逐步确定体系中每个因素的最佳反应参数。MgCl2设以下5个浓度:1.5、2.0、2.5、3.0、3.5 mmol·L-1;dNTPs设以下5个浓度:0.1、0.2、0.3、0.4、0.5 mmol·L-1;引物(845)浓度设以下5个浓度:0.1、0.2、0.3、0.4、0.5 μmol·L-1;Taq DNA聚合酶设以下5个浓度0.5、1.0、1.5、2.0、2.5U;DNA模板的用量设以下5个:30、35、40、45、50 ng。
2.5 ISSR-PCR扩增产物的鉴定
取扩增产物6 μL和上样缓冲液1 μL混匀后点样,在1.5%的琼脂糖凝胶上电泳分离,以0.5xTBE为缓冲液,稳压100V,电泳至凝胶的2/3处结束。采用EB染色法染色20 min,在凝胶成像系统上照相。
3 结果与分析
3.1 党参试管苗基因组DNA的提取
本试验提取的DNA为无色沉淀,如图1,各泳道点样孔比较干净,DNA条带无拖尾,表明该方法所提的DNA质量较好,可用于ISSR-PCR体系优化的模板。
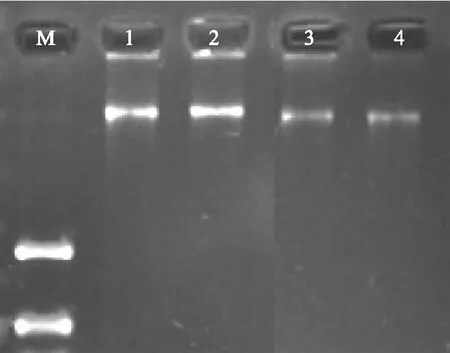
M:DNA marker 1~4为提取的基因组DNA 图1 党参基因组DNA的电泳结果
3.2 退火温度对ISSR扩增的影响
退火温度明显影响ISSR-PCR反应的进行,不同引物的退火温度通常也不一样,以845为引物,进行退火温度梯度试验,由PCR梯度扩增仪自动生成10个温度,确定了引物845以党参基因组DNA为模板扩增的最佳退火温度。由图2可知,退火温度为48.5、48.7 ℃时,背景有点模糊;温度为49.4、50.5、51.7 ℃时,条带清晰,亮度适宜;温度为52.9 ℃时,条带减少;温度为54.1、55.3 ℃时,条带之间界限不太明显;温度为56.4、57.5 ℃时,条带减少,模糊不清。因此,退火温度过高或过低都不利于产物扩增,在允许的范围内,选择较高的退火温度可减少引物与模板之间的非特异性结合,提高反应的特异性,因此,引物845的最佳退火温度为51.7 ℃,以下试验均采用51.7 ℃的退火温度。然后在这一条件下,研究ISSR-PCR反应中其他因素对扩增效果的影响,从中选择确定最优的反应条件。
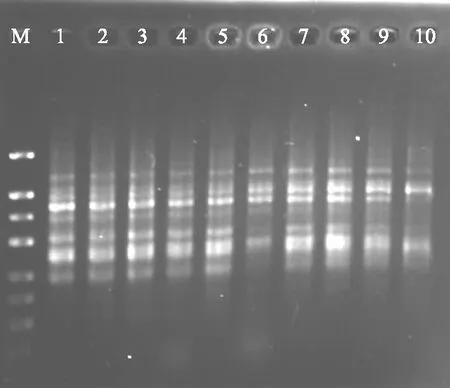
M:DNA marker 1~10温度为48.5、48.7、49.4、50.5、 51.7、52.9、54.1、55.3、56.4、57.5 ℃ 图2 退火温度对ISSR扩增的影响
3.3 MgCl2浓度对ISSR扩增的影响
MgCl2浓度对ISSR-PCR反应的特异性和扩增效率均有较大的影响,在反应体系中MgCl2浓度过低,会显著降低酶的活性,而MgCl2浓度过高时,又使酶催化非特异性扩增增强,试验设5个MgCl2浓度梯度进行筛选,如图3所示,MgCl2浓度为1.5 mmol·L-1时,扩增的条带较少;MgCl2浓度为2.0 mmol·L-1时,能得到清晰稳定的条带;MgCl2浓度为2.5~3.0 mmol·L-1时,扩增的产物只有个别几条带,而且模糊不清;MgCl2浓度为3.5 mmol·L-1时,条带较暗。因此,选择2.0 mmol·L-1MgCl2作为党参ISSR-PCR反应体系的最佳浓度。
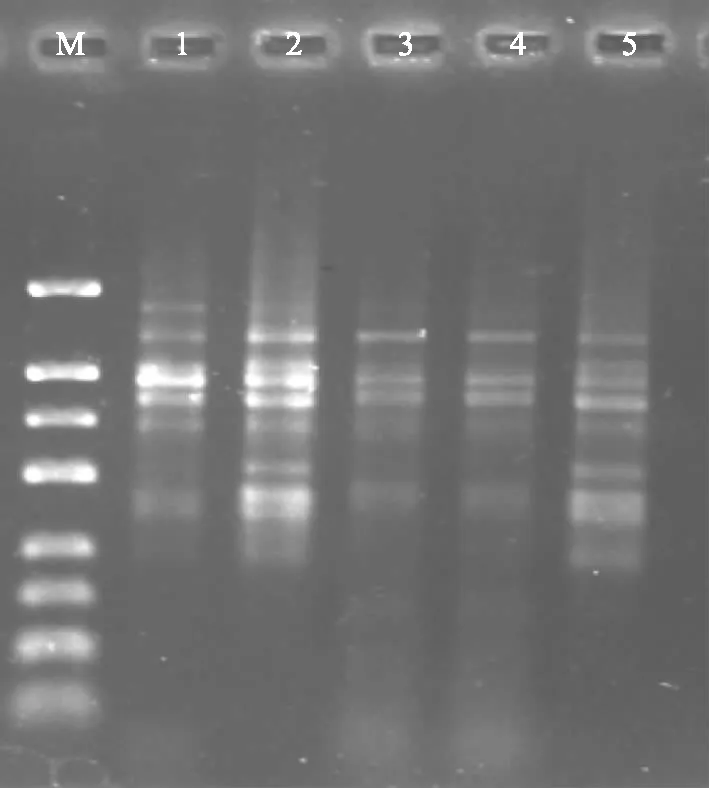
M:DNA marker 1~5 MgCl2浓度分别为1.5、2.0、2.5、3.0、3.5 mmol·L-1图3 MgCl2浓度对ISSR扩增的影响
3.4 dNTPs浓度对ISSR扩增的影响
适宜的dNTPs对于获得理想的ISSR-PCR扩增产物尤为重要,如图4所示,当dNTPs浓度为0.1~0.2 mmol·L-1时,扩增条带少且较弱;在0.3~0.5 mmol·L-1时,条带多而清晰,多态性好,相对而言0.5 mmol·L-1更清晰些;所以本试验选择0.5 mmol·L-1的dNTPs浓度作为党参ISSR反应体系的最佳浓度。
3.5 引物浓度对ISSR扩增的影响
引物浓度对PCR扩增的带型有明显的影响,浓度过低会导致ISSR-PCR产物量降低;而引物量过高,则会引起碱基错配和非特异性的扩增,生成引物二聚体,从而使目的DNA片段的扩增量下降。如图5所示,当引物浓度为0.1 μmol·L-1时的扩增条带最少;当引物浓度为0.2~0.3 μmol·L-1时,扩增条带较少,而且条带不清晰;浓度为0.4~0.5 μmol·L-1时,条带多而清晰,相对而言以0.4 μmol·L-1的条带最清晰明亮;因此,选择0.4 μmol·L-1的引物浓度作为党参ISSR-PCR反应体系的最佳浓度。
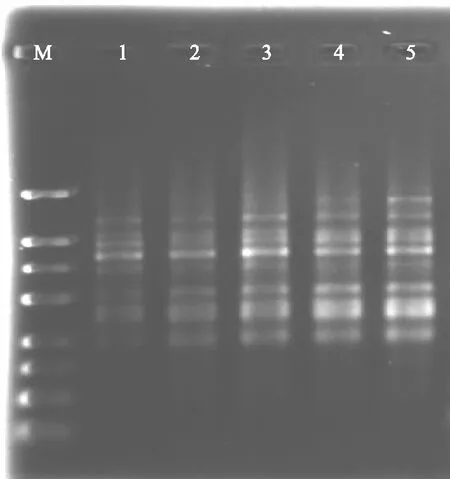
M:DNA marker 1~5 dNTPs浓度分别为0.1、0.2、0.3、0.4、0.5 mmol·L-1图4 dNTPs浓度对ISSR扩增的影响
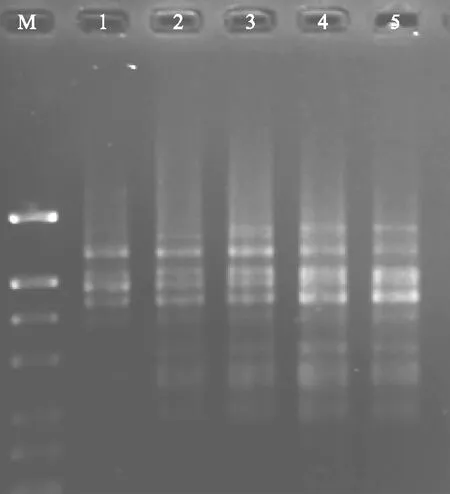
M:DNA marker 1~5引物浓度分别为0.1、0.2、0.3、0.4、0.5 μmmol·L-1图5 引物浓度对ISSR扩增的影响
3.6 Taq DNA聚合酶对ISSR扩增的影响
Taq DNA聚合酶在ISSR-PCR体系中的加入量也很重要,若量过少会影响靶序列扩增产量,而过多则会导致非特异性的扩增;如图6所示,Taq DNA聚合酶用量为0.5 U时扩增条带少而不清晰;Taq DNA聚合酶用量在1.0 U的条带背景较1.5~2.5 U的清晰,1U时的扩增条带明显,反应稳定;因此,选择1.0 U的Taq DNA聚合酶浓度作为党参ISSR-PCR反应体系的最佳浓度。
3.7 模板DNA的用量对ISSR扩增的影响
模板DNA用量对ISSR-PCR扩增产物的特异性和稳定性影响不大,如图7所示,本试验提取的DNA用量为30~50 ng的范围内,均可扩增出条带清晰的产物,因此30~50 ng的DNA模板均适合党参基因组DNA PCR反应的用量,相对而言,DNA用量30 ng时扩增条带较明显,因此本试验选择DNA用量为30 ng作为党参ISSR-PCR反应体系的最佳浓度。
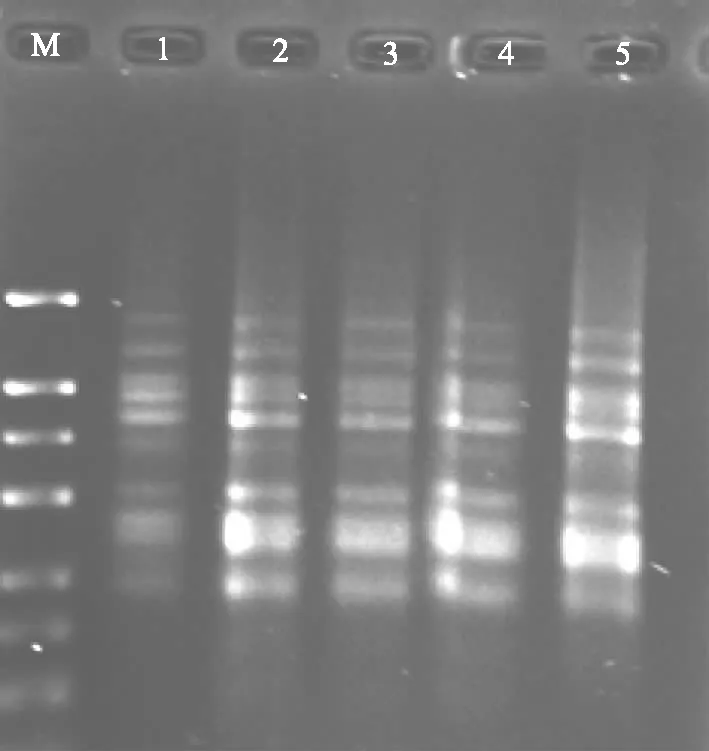
M:DNA marker 1~5 Taq DNA聚合酶浓度分别为0.5、1.0、1.5、2.0、2.5 U 图6 Taq DNA聚合酶对ISSR扩增的影响
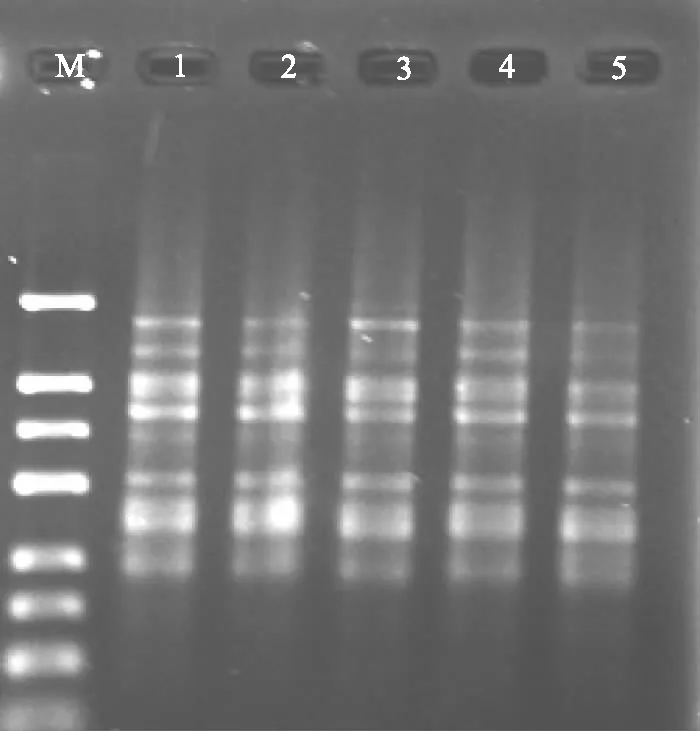
M:DNA marker 1~5 模板DNA的用量分别为30、35、40、45、50 ng 图7 模板DNA的用量对ISSR扩增的影响
4 结论与讨论
4.1本试验以党参基因组DNA为材料,建立了分辨率高、可靠性好的党参ISSR-PCR反应体系,即在25 μL反应体系中,含有10×PCR Buffer缓冲液2.5 μL,MgCl22.0 mmol·L-1,dNTPs 0.5 mmol·L-1,引物0.4μ mol·L-1,Taq DNA聚合酶1.0 U,模板DNA为30 ng;通过梯度退火得到引物845的最佳退火温度为51.7 ℃;扩增程序为:94 ℃预变性5 min,然后94 ℃变性30 s,51.7 ℃退火1 min,72 ℃延伸1.5 min,共计35个循环,循环结束后在72 ℃延伸7 min,4 ℃保存。得到了清晰,多态性高的ISSR谱带,为ISSR-PCR在党参的分类鉴定和育种学研究中的应用奠定了基础。
4.2ISSR分子标记技术基于PCR反应,它具有以下优点:不需要事先知道靶序列;由于较高的退火温度和更长的引物序列,可产生重复性好的扩增带;模板需要量少,多态性丰富,结果记录方便。目前已广泛应用于植物品种鉴定,遗传图谱和遗传多样性等方面的研究。但影响ISSR扩增结果的因素较多,各因素的变化会不同程度地影响到带谱的准确性与稳定性[8],因此,有必要对其影响因子进行筛选和优化,确立最适宜的ISSR反应体系。退火温度对扩增条带的清晰程度和条带数目有明显影响。引物的碱基构成不同,适宜的退火温度就可能不同,因此,只有针对不同的引物进行相应的退火温度设计、优化,才能获得清晰、稳定的扩增带。模板浓度在30~50 ng之间扩增结果相同,红松ISSR-PCR实验系统影响因素研究一文中发现模板浓度在10~200 ng之间扩增结果相同[9],说明ISSR-PCR对模板浓度的要求范围较宽,具有较好的可重复性和稳定性。
[1] 周秀佳,徐宏发,顺庆生.中药资源[M].上海:上海科学技术文献出版社,2007.
[2] 王峥涛,徐国钧.中药党参的药源调查[J].医学教育探索,1992,(3):144-147.
[3] 王延华,Pierre Dubus.PCR理论与技术[M].北京:科学出版社,2009.
[4] 李海生.ISSR分子标记技术及其在植物遗传多样性分析中的应用[J].生物学通报,2004,39(2):19-21.
[5] 邱英雄,傅承新,吴斐捷.明党参与川明参群体遗传结构及分子鉴定的ISSR分析[J].中国中药杂志,2003,28(7):598-603.
[6] 隋春,魏建和,陈士林,等.柴胡ISSR-PCR反应体系的建立与优化[J].时珍国医国药,2008,19(8):1837-1839.
[7] 郭丁丁,马逾英,唐琳,等.白芷ISSR-PCR反应体系的建立和优化[J].成都中医药大学学报,2008,31(2):45-48.
[8] 邓婧,陈新.黄花蒿ISSR-PCR反应体系的优化[J].成都中医药大学学报,2006,29(3):51-53.
[9] 冯富娟,王凤有,刘彤.红松ISSR-PCR实验系统影响因素[J].植物学通报,2004,21(3):326-331.
Establishment and Optimization of ISSR-PCR Reaction System for Codonopsis Pilosula(Franch.)Nannnf.
ZHANG Yanhong*,GAO Sufang
(DepartmentofPharmacy,GansuCollegeofTCM,Lanzhou730000,China)
Objective:The study focused on setting up ISSR-PCR reaction system ofCodonopsispilosula(Franch.)Nannnf.,which will provide a standard procedure for Codonopsis germplasm resources analysis.MethodsDNA ofC.pilosulawas extracted by kit method,and the influence of MgCl2,dNTPs,primer concentration,Taq DNA polymerase,DNA template amount and the annealing temperature on ISSR-PCR amplification were studied by single factor experiment.ResultsThe optimal reaction system for ISSR analysis contains 10×PCR Buffer 2.5 μL,2.0 mmol·L-1MgCl2,0.5 mmol·L-1dNTPs,0.4 μmol·L-1primer,1.0 U Taq DNA polymerase,30 ng template DNA,in 25 μL total reaction volume.Amplification procedure is:94 ℃ initial denaturation 5 min,and then 94 ℃ denaturation 30 s,51.7 ℃ annealing 1 min,72 ℃ extends 1.5 min,total of 35 cycles,after the cycles extension for 7 min at 72 ℃,storing at 4 ℃.ConclusionThe stable and reproducible optimal ISSR-PCR reaction system was established forC.pilosula,which laid a good foundation for germplasm resources identification,molecular marker assisted breeding and genetic diversity study.
Codonopsispilosula(Franch.)Nannnf.;ISSR-PCR;Reaction system;Optimization
“十二五”国家科技支撑计划课题(2011BAI05B02)
*
张延红,副教授,研究方向:药用植物育种和组织培养,Tel:(0931)8765393,E-mail:zhyh456789@163.com
10.13313/j.issn.1673-4890.2014.07.008
2014-02-08)
