基于微流控芯片技术研究水红花子复方抗肿瘤的作用△
2014-11-02王乙同马立东孟宪生包永睿王帅
王乙同,马立东,孟宪生,包永睿,王帅
(辽宁中医药大学 药学院,辽宁 大连 116600)
研究开发
“十二五”重大新药创制科技重大专项——中药复方多组分配伍筛选集成化微流控芯片的构建及新药筛选(2013ZX09507005)
△*
孟宪生,硕士生导师,教授,研究方向:中药组分配伍、代谢组学及药品质量分析;Tel:(0411)87406496,E-mail:mxsvvv@126.com
基于微流控芯片技术研究水红花子复方抗肿瘤的作用△
王乙同,马立东,孟宪生*,包永睿,王帅
(辽宁中医药大学 药学院,辽宁 大连 116600)
目的基于微流控芯片技术研究水红花子复方含药血清对肝肿瘤SMMC-7721细胞的凋亡坏死影响及血管内皮生长因子(VEGF)分泌的影响。方法设计与制作玻璃-PDMS复合浓度梯度芯片,并对芯片药物浓度梯度进行表征;将SMMC-7721细胞长期培养在芯片中,绘制细胞的生长曲线,AO/EB法检测细胞死活率;将预制备的含药血清通入微流控芯片,分别作用于SMMC-7721细胞24 h和48 h,凋亡坏死试剂盒检测凋亡坏死率;收集各通道的细胞上清液,ELISA法测定VEGF的蛋白含量。结果细胞在芯片中培养7 d,细胞增殖活性良好,培养72 h期间细胞存活率≥97%。芯片可产生稳定的浓度梯度,线性相关系数为0.996 4。芯片中含有药物血清的培养液分别作用SMMC-7721细胞24 h和48 h后,发生凋亡坏死细胞的数量随含药血清作用浓度升高而逐渐升高,细胞培养上清液中VEGF蛋白含量随含药血清作用浓度升高而逐渐减少,都呈现出一定的时间与浓度依赖性。结论基于微流控芯片技术,进一步证明水红花子复方含药血清对肝肿瘤SMMC-7721细胞具有促凋亡作用,且能抑制其分泌VEGF从而间接抑制肿瘤血管新生达到抗肿瘤作用。
微流控芯片;药物浓度梯度;中药复方;含药血清;药物筛选
癌症是导致现代人类死亡的疾病之一,当前中国肿瘤病发率和死亡率都呈加速发展态势,根据全国肿瘤登记中心发布的《2012中国肿瘤登记年报》,全国每年新发肿瘤病例约为312万例,死亡病例约为270万。这些数据宣告中国已进入与肿瘤鏖战的前沿阵地,也使得相关抗肿瘤新药的筛选与研发得到了我国高度的重视。我国中药资源丰富,从中草药中筛选抗肿瘤药物具有得天独厚的优势,但目前大部分实验室还停留在传统孔板筛选模式,实验人员往往要面对通量低、繁琐操作、试剂耗材消耗量大、成本高等问题,这对于从数以万计中草药单体(组分)中筛选出具有抗肿瘤活性药物提出了艰巨挑战。近年来随着现代科学技术的发展,体外药物筛选研究出现了一种新型的技术,即微流控芯片(Microfluidics)技术,以其小型化[1]、操作灵活、高通量(High Throughput Screening)、高内涵[2]、与生物体内相似的微环境[3]等优势已经逐渐受到关注,这为抗肿瘤药物的高效筛选带来希望。
水红花子复方为临床经验方,是由水红花子、花蕊石、薏苡仁和白茅根4味中药组成,具有健脾祛湿、活血化瘀、缓消癥块等功效[4],是经过临床验证优选出最佳配伍比例的复方,临床证实其对肝癌患者有很好的治疗效果。实验以该复方的含药血清作为研究对象,采用微流控浓度梯度芯片一站式生成8种浓度梯度对水红花子中药复方含药血清进行抗肿瘤的体外药效研究,同时ELISA法定量检测不同浓度药物干预后肿瘤细胞分泌血管内皮细胞生长因子(VEGF)水平的变化,初步研究中药水红花子复方不同含药血清浓度对肝肿瘤的影响。本文研究旨在通过应用微流控芯片技术,为我国抗肿瘤新药特别是抗肿瘤中药活性单体(组分)的快速筛选与研究提供一种新思路和新方法。
1 材料
1.1 动物
选用成年健康SD大鼠16只,雌雄各半,体重(200±20) g,由大连医科大学实验动物中心提供,许可证号SCXX(辽)2011-0002。
1.2 药物与试剂
水红花子复方:水红花子、花蕊石、白茅根有效物质组喷雾干燥处理后,与薏苡仁物质组按照配伍比例混合,委托秦皇岛市太极环纳米制品有限公司加工制成纳米颗粒胶囊。
胎牛血清(杭州四季青生物工程材料有限公司)。吖啶橙(AO)、溴化乙锭(EB)、荧光素、多聚L-赖氨酸(Poly-L-Lysine,PLL)均购自美国Sigma公司。SU8 2075光刻胶(美国 Micro-Chem 公司)。Sylgard 184 型聚二甲基硅氧烷(PDMS)、固化剂(美国Dow Corning 公司)。细胞凋亡与坏死检测试剂盒(Hoechst 33342和PI,碧云天生物技术研究所)。胰蛋白酶(美国GIBCO公司)。人肿瘤血管生长因子(VEGF)ELISA Kit (上海沪宇生物科技有限公司)。
1.3 细胞株
人肝癌细胞株SMMC-7721(上海复蒙生物有限公司)。SMMC-7721细胞使用含有10%胎牛血清的DMEM-高糖培养基(美国GIBCO公司),在饱和湿度、37 ℃、5% CO2通用培养条件下常规培养,当细胞生长汇合至80%~90%时,将细胞进行1∶3传代。
1.4 仪器
NUAIRETM US AUTOFLOW型CO2培养箱(德国NUAIRE公司);SORVALL fresco高速离心机(美国科峻仪器公司);HD2-BCN-1360B型生物洁净工作台(哈尔滨东联电子技术开发有限公司);AE31型倒置显微镜(厦门Motic公司);BX51荧光型显微镜(日本Olympus公司);图像处理软件Image-Pro Plus 6.0(IPP,美国Media Cybernetics公司);JKG-2A 型光刻机(上海学泽光学机械有限公司);HPDC-32G-2型等离子清洗机(美国Harrick Plasma公司);LSP04-1A精密注射泵(保定兰格公司)。
1.5 芯片设计与制作
实验设计的微流控芯片为PDMS-玻璃复合芯片,如图1所示。芯片采用软光刻技术以及模塑法制作,氧等离子体处理进行键合[5-6]。芯片通道高度为100 μm,上部由细胞培养液入口和含有药物的细胞培养液入口组成,药物由注射泵经入口处注入宽为100 μm浓度梯度发生区,产生8个浓度的药物梯度并经细胞缓冲区(细胞缓冲区具有8个外接出口,方便后期细胞引入)进入半径为800 μm圆形细胞培养区,每个浓度梯度下的细胞培养腔均有4个复孔,培养室下部另设有8个出口,可将细胞代谢物进行收集(不需要时可由专用堵头进行封口)。
2 方法
2.1 含药血清制备
16只成年健康SD大鼠随机分为2组,空白组8只,给药组8只。给药组将水红花子复方胶囊制剂的内容物取出溶于药用大豆油中,制成0.5 mL灌胃溶液,大鼠给药剂量参照公式:用药剂量=临床用量×动物等体表面积系数×培养基内血清稀释倍度[7],采用日剂量一次给药法算出大鼠最大给药量为125 mg·kg-1。空白组灌服相同量的空白药用大豆油。两实验组灌胃前禁食不禁水12 h。大鼠采用眼眶静脉取血,根据本实验室已掌握的该中药复方中活性组分的血中代谢规律,将取血时间分段为1,2,3,4 h,每次取血约0.8 mL,期间腹腔注射补充适当0.9%氯化钠溶液。全血室温静置2 h,3 000 r·min-1,离心15 min,吸取血清,同组血清混合,56 ℃水浴灭活30 min,DMEM不完全培养基稀释至血清含量10%,0.22 μm滤膜过滤除菌,-20 ℃保存备用。
2.2 芯片药物浓度梯度的表征
实验采用荧光素染料(M:376.27)进行浓度梯度的表征实验。荧光素染料(100 mg·L-1)和无菌水分别通过芯片上部两个入口以0.6 μL·min-1的流速注入芯片中,待液流稳定后用荧光显微镜拍摄8个细胞缓冲区通道的荧光图片,专业图像分析软件Image-Pro Plus 6.0 (IPP)分析每个通道的光密度平均值(Density mean)。

图1 芯片示意图
2.3 芯片细胞培养的预处理
采用0.1 mg·mL-1的多聚L-赖氨酸(PLL)对芯片下部细胞培养腔进行包被处理,促进细胞快速贴壁[8]。芯片在使用前通入75%乙醇10 min灭菌,后用无菌水冲洗数遍,烘干,注入细胞前紫外照射10 min。
2.4 细胞在芯片中的长期培养和细胞活力
将对数生长期的细胞用0.25%的胰酶进行消化,消化后进行离心富集,将细胞用培养液稀释至5×105个·cm-2的密度,通入芯片后放入细胞培养箱中,待细胞贴壁后,用精密注射泵以流速为0.6 μL·min-1将完全培养液注入芯片中,随机抽取芯片8组通道中任意4个细胞培养腔,每24 h拍照1次,通过IPP软件对细胞图像进行计数分析,4个培养腔中细胞数取平均值并计算标准偏差,绘制出SMMC-7721肝癌细胞在芯片中的生长曲线。
SMMC-7721细胞在微流控芯片上分别培养24,48,72 h后,在芯片出口处将100 mg·L-1AO/EB混合液通入芯片中,避光染色5 min,PBS清洗3次,使用倒置荧光显微镜进行拍照,检测细胞的存活率,每条通道中4个培养腔分别计数。其中正常活性细胞(VN):细胞呈圆形,核质体着绿色,大小形状较单一;坏死细胞(NVN):细胞呈椭圆形,核质体着桔红色,大小形状较单一;凋亡早期细胞(VA):核质体着绿色,细胞形状不规则,呈新月形;凋亡晚期细胞(NVA):核质体着桔红色,染色质浓缩,细胞核碎裂成点状。细胞存活率按公式计算:细胞存活率%=VN/VN+NVN+VA+NVA×100%。
2.5 水红花子复方含药血清对肝癌细胞凋亡坏死的影响
将水红花子复方含药血清实时注入芯片24 h和48 h后,将芯片细胞缓冲区玻璃塞打开,将细胞染色缓冲液、Hoechst 33342染液和碘化丙啶(PI)染液1∶1(V/V)依次通入芯片中,4 ℃孵育10 min,PBS清洗3遍后使用Olympus荧光显微镜CellSens成像软件进行拍照。由于正常细胞、凋亡细胞和坏死细胞的细胞膜完整性的差异,Hoechst 33342和PI可使不同状态的细胞核着染不同的颜色:正常细胞核呈弱蓝色荧光+弱红色荧光,凋亡细胞核呈强蓝色荧光+弱红色荧光,坏死细胞核呈强红色荧光+强蓝色荧光。
2.6 ELISA法检测细胞上清VEGF的含量
将芯片细胞培养腔下部的8个出口通过聚四氟乙烯管与离心管相连接,实时收集细胞上清液。注射泵流速为0.6 μL·min-1连续给药,分别收集给药24 h和48 h后各通道细胞上清液,将收集到的上清液冻存在-20 ℃冰箱中,临用4 ℃现化,3 000 r·min-1,离心25 min,仔细吸取上清液。ELISA操作方法严格按照说明书上进行操作,对照和样品均设3个复孔,450 nm波长测定各孔的OD值,以浓度为横坐标,OD为纵坐标绘制标准曲线,通过公式计算出每个通道的VEGF含量。
2.7 数据统计与处理

3 结果
3.1 芯片药物浓度梯度的表征测试
经前期考察细胞培养液流速设为0.6 μL·min-1时,细胞在此剪切力下无明显影响,芯片同时可形成较好的浓度梯度,如图2所示。通过光密度测试后得出线性回归方程为Y=-7.69X+62.71,r=0.998 2,说明浓度产生实际值与理论值[9]相近,即芯片两注入口浓度分别为0和最终浓度c,则芯片浓度梯度发生区8个通道浓度关系为0,0.14c,0.28c,0.43c,0.57c,0.71c,0.86c,c。

图2 荧光素浓度梯度图(n=5)
3.2 细胞在芯片中的生长曲线和活力
经过多聚赖氨酸处理的通道,SMMC-7721细胞能在3 h内贴壁完全,经过7 d的培养,细胞每天都在持续增殖,如图3所示。通过IPP软件对细胞图像进行计数分析,绘制单个培养腔中的细胞生长曲线,如图4所示。用荧光染料AO/EB对细胞进行前72 h的染色,计算出细胞在芯片中存活率都能达到97%以上,如图5、图6所示。
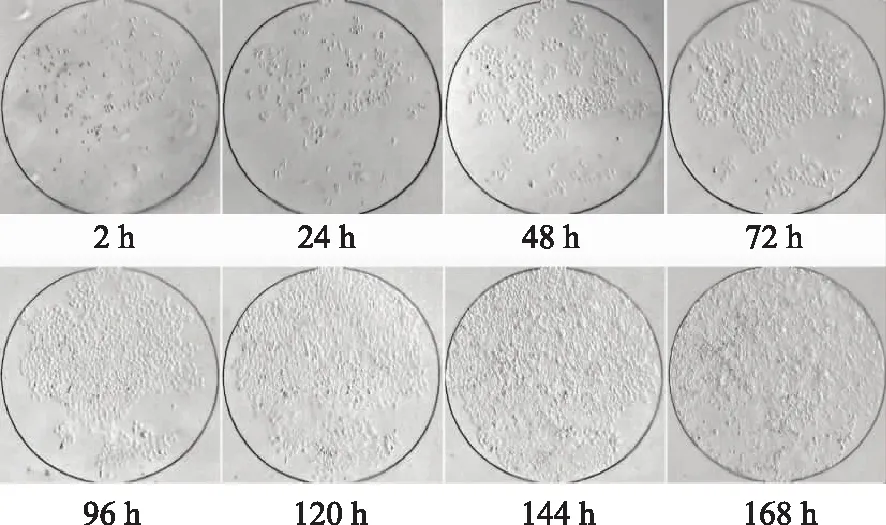
图3 细胞在芯片中的生长状态图(×40)
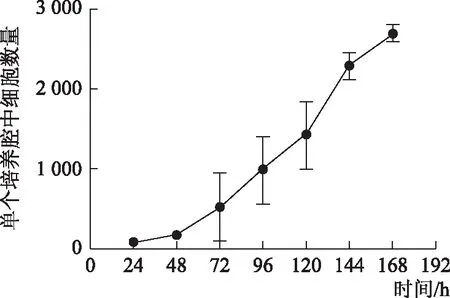
图4 细胞在芯片单个培养腔中生长曲线(n=4)

图5 芯片中AO/EB双染细胞荧光图(×40)

图6 芯片中细胞存活率统计(n=4)
3.3 芯片中含药血清对肝癌细胞的影响
实验采用Hoechst 33342和碘化丙啶(PI)双染法观察芯片中不同浓度梯度含药血清对肝癌细胞凋亡坏死的影响,从图7(A)、(C)可知细胞培养腔随浓度梯度的增加,细胞核呈现亮蓝色荧光的个数也越多,即发生凋亡的细胞数开始增多,且同浓度梯度下可明显观察到48 h较24 h发生凋亡的细胞数量多;从图7(B)、(D)可知细胞培养腔随浓度梯度的增加,细胞核呈现亮红色荧光的个数也随之增加,即发生坏死的细胞数开始增多,同时也可观察到同浓度梯度下48 h较24 h凋亡的细胞数量增多。由于正常细胞核着弱蓝色荧光和弱红色荧光,导致其在芯片缩放图中呈现不明显;所以从图中看到呈蓝色或红色荧光的细胞均为发生凋亡或坏死的细胞。

A.24 h的Hoechst 33342染色细胞荧光图 B.24 h的PI染色细胞荧光图 C.48 h的Hoechst 33342染色细胞荧光图 D.48 h的PI染色细胞荧光图图7 Hoechst 33342/PI双染荧光检测结果(×40)
3.4 水红花子复方对细胞分泌VEGF的影响
为客观衡量VEGF的分泌情况,实验对芯片中24 h与48 h的细胞总数进行了分析,发现细胞总数变化不显著,药物对肝肿瘤细胞呈现出一定的增殖抑制作用,所以在考察VEGF的分泌情况时排除了细胞数量对实验造成的干扰。从实验结果可知,与空白通道(通道1)比较,加药通道的VEGF含量明显降低,VEGF抑制率升高,差异具有统计学意义(P<0.05)。作用时间相同条件下,随着药物浓度的升高,VEGF的含量呈现降低趋势,VEGF抑制率呈现增大趋势。药物浓度相同条件下48 h的VEGF含量较24 h的低,48 h的VEGF抑制率较24 h的高,结果见表1与图8,VEGF含量测定标准曲线公式为Y=0.000 3X-0.032 5,r=0.994 9。

表1 水红花子复方对细胞分泌VEGF含量的影响 /pg·mL-1
注:24 h的与同组空白组(通道1)比较,#P<0.05,#P<0.01,n=3;48 h的与同组空白组(通道1)比较,**P<0.01,n=3

图8 水红花子复方含药血清对细胞VEGF抑制率的影响
4 讨论
实验通过利用一种浓度梯度芯片,研究水红花子复方含药血清对肝肿瘤SMMC-7721的影响,实验整体过程操作简单,水红花子复方含药血清一步自动生成8个线性良好的浓度梯度,并实时作用于肝肿瘤SMMC-7721细胞,通过荧光倒置显微镜实时在线观测药物诱导肝肿瘤细胞凋亡的全过程,同步测定了VEGF分泌量的动态变化。实验发现药物作用时间相同条件下,随着药物浓度的增大,细胞发生凋亡坏死数量呈现出明显增加,同步检测药物对SMMC-7721细胞分泌VEGF的抑制率也均呈增大趋势,总体表现出明显的剂量与效应关系,且在第8通道即药物作用浓度最大时,VEGF抑制率均达50%以上。在相同药物作用浓度下,随着给药时间的延长,细胞发生凋亡坏死数量及VEGF的分泌抑制率也呈现增长趋势,总体表现出了明显的时间与效应关系,且当药物作用48 h达到最佳状态。
从实验前期结果可知,为了验证芯片产生稳定的浓度梯度能力,对芯片做了相应的浓度梯度表征工作,在采用0.6 μL·min-1流速下芯片形成良好的浓度梯度,浓度梯度线性回归系数达到r=0.998 2,浓度产生的实际值与理论值非常相近,这为保证后期实验结果的准确性非常重要,也证明了本实验室设计的浓度梯度芯片的可行性。同时考虑到新加工的芯片因其结构的改变流体剪切力也会随之改变,从而对细胞生长环境产生未知的影响,所以本实验在0.6 μL·min-1流速下对肝肿瘤SMMC-7721细胞进行了长期培养研究,结果显示细胞在芯片中持续培养168 h其生长状态依然良好,仍有继续增长的趋势,且形态未出现细胞膨大、核浓缩等细胞坏死现象;同时实验对芯片中72 h内的细胞进行了活力检测,细胞存活率都达到97%以上,所有的工作从侧面佐证了在0.6 μL·min-1流速下芯片的实验性能是准确可靠的。值得一提的是该实验过程省去了传统长期细胞培养实验中不断更换培养液的过程,因其极低的试剂消耗量及培养液实时更新等特点,本实验一次换液就达到了肝肿瘤SMMC-7721细胞长期培养的目的,极大地节省时间、减少人力。
综上所述,水红花子复方含药血清对肝肿瘤SMMC-7721细胞具有促凋亡作用并能抑制其分泌VEGF,且这种作用具有明显的时间、剂量、效应关系,说明水红花子复方可以通过诱导肿瘤细胞凋亡并抑制VEGF分泌,间接抑制肿瘤血管新生等联合作用来达到治疗肿瘤的作用。最后应该指出的是微流控芯片作为一门新兴的技术,尤其在大规模抗肿瘤新药研发领域尚属早期,目前对芯片中药物干预后的细胞信息采集依然需要借助荧光显微镜后期拍照分析,其图片分析处理过程复杂繁琐,芯片通量受阻明显,细胞定量手段也欠佳。相信随着荧光实时在线定量分析技术的完善,微流控芯片技术将在不久实质性地缩短抗肿瘤新药研发周期,降低研发成本,催生出民族新药。
[1] Petra S.Dittrich & Andreas Manz.Lab-on-a-chip:microfluidics in drug discovery[J].Nature Reviews Drug Discovery,2006,5:210-218.
[2] Qun Fang,Guang-Ming Xu,Zhao-Lun Fang.A High-Throughput Continuous Sample Introduction Interface for Microfluidic Chip-based Capillary Electrophoresis Systems[J].Analytical Chemistry,2002,74 (6):1223-1231.
[3] Xuan Mu,Wenfu Zheng,Le Xiao.Engineering a 3D vascular network in hydrogel for mimicking a nephron[J].Lab on a Chip,2013,13:1612-1618.
[4] 单蕾,范雪梅,王义明,等.中药复方四味肝泰对荷瘤小鼠和HepG2肝癌细胞的影响[J].世界科学技术—中医药现代化,2012,14(2):1428-1432.
[5] Pilnam Kim,Keon Woo Kwon,Min Cheol Park,et al.Soft Lithography for Microfluidics:a Review[J].Biochi PJournal,2008,2(1):1-11.
[6] James Friend,Leslie Yeo.Fabrication of microfluidic devices using polydimethylsiloxane[J].Biomicrofluidics,2010,4(2):1-5.
[7] 陈赐慧,花宝金.关于中药血清药理学实验的几个问题和探讨[J].中华中医药学刊,2013,31(1):46-48.
[8] Dan Gao,Haifang Li,Niejun Wang,et al.Evaluation of the Absorption of Methotrexate on Cells and Its Cytotoxicity Assay by Using an Integrated Microfluidic Device Coupled to a Mass Spectrometer[J].Anal Chem,2012,84 (21):9230-9237.
[9] Jeon NL,Dertinger SKW,Chiu DT,et al.Generation of solution and surface gradients using microfluidic systems[J].Langmuir,2000,16(22):8311-8316.
Anti-tumorEffectofPolygoniorientalisFructusFormulaSeruminVitroBasedonMicrofluidicTechnology
WANGYitong,MALidong,MENGXiansheng*,BAOYongrui,WANGShuai
(CollegeofPharmacy,LiaoningUniversityofTraditionalChineseMedicine,Dalian116600,China)
Objective:To study the effect of Polygoni orientalis Fructus formula serum on hepatoma SMMC-7721 cells apoptosis,necrosis and the secretion of VEGF based on microfluidic technology.MethodsFabrication and design of the Glass-PDMS microfluidic device,validation of the concentration gradient generation integrated on the microfluidic device.SMMC-7721 were seeded into the microfluidic device,drawing cell growth curve and determination the cytotoxicity of cells to chip by AO/EB staining.Culture medium with medicinal serum was then injected into the microfluidic device by the syringe pump.Detection of the cells apoptosis and necrosis by Hoechst 33 342 and propidium iodide (PI) double staining after 24 h and 48 h,respectively.Supernatants collected from each cell culture channel.ResultsCells cultured for 7 days on the chip,cells viability ≥97% during 72 h.There was a good correlation (r=0.996 4) between the experimental and theoretical data,demonstrating the capability of the chip to generate concentration gradients.Culture medium with medicinal serum was incubated with SMMC-7721 cells for 24 and 48 h on chip,the number of cells with apoptosis and necrosis increased in response to the increasing concentration of medicinal serum,the secretion of VEGF decreased in response to the increasing concentration of medicinal serum,the morphological changes and the secretion of VEGF appeared to be dose-dependent and time-dependent.ConclusionOur job verified that Polygoni orientalis Fructus formula could promote the apoptosis of human hepatoma SMMC-7721 cells,and indirectly inhibited tumor angiogenesis through inhibiting VEGF secretion and thus achieved anti-tumor effect based on microfluidic technology.
Microfluidics;Drug gradient generator;Traditional Chinese Medicine formula;Medicinal serum;Drug screening
10.13313/j.issn.1673-4890.2014.02.003
2013-11-01)
