封闭负压引流技术对猪皮肤软组织海水浸泡爆炸伤创面愈合的病理学影响研究
2014-11-02梁献平马永奇
梁献平, 马永奇, 石 冰, 张 晨
实验研究
封闭负压引流技术对猪皮肤软组织海水浸泡爆炸伤创面愈合的病理学影响研究
梁献平, 马永奇, 石 冰, 张 晨
目的通过动态对比观察封闭负压引流(vacuum sealing drainage, VSD)技术对猪皮肤软组织海水浸泡爆炸伤创面愈合及病理学变化的影响,初步探索治疗的最适压力范围。方法用雷管在5头实验小型猪的双侧肩胛部、臀部制造4个损伤程度相当的海水浸泡爆炸创面,清创后随机分为对照组和实验组(VSD -120 mmHg负压组、VSD -180 mmHg负压组、VSD -240 mmHg负压组)。每组5个创面,对照组每天常规换药,实验组隔1天换1次VSD敷料,共治疗9 d,并动态观察至所有创面愈合(即治疗后58 d)。分别于治疗前和治疗后9、30、58 d,取各组创缘组织行HE染色,并对比观察。结果实验组与对照组相比,创周细胞增殖活跃,上皮爬行较快,肉芽增生迅速;以VSD -120 mmHg负压组最为明显,其次是VSD -180 mmHg负压组。结论在治疗海水浸泡爆炸创面时,VSD技术较常规换药法具有明显的优势,-120 mmHg是比较理想的压力。
封闭负压引流; 海水浸泡; 爆炸伤 ; 猪
封闭负压引流(vacuum sealing drainage, VSD)技术作为一种特殊的创面处理方式,治疗各类复杂创面疗效显著,并成功应用于爆炸伤创面[1-4]。本实验模拟海战中爆炸所致的皮肤软组织缺损合并海水浸泡,清创后分组,并进行VSD治疗和常规治疗,对比观察各组创缘组织病理变化,探索VSD在治疗海水浸泡皮肤软组织爆炸伤中比较理想的负压,为此类创面的早期救治提供新的实验依据。
1 材料与方法
1.1 实验动物 选取5头4~6个月龄实验用小型白猪(中国1号,由北京市琉璃河科兴实验动物养殖中心提供),雌雄不限,体质量23~25 kg,平均24 kg。
1.2 冬季渤海海水指标 渤海湾近海域海水(打水至浸泡创面时间<12 h),直接计数法细菌丰度平均值为9.02×108/L,生物变化量范围平均值为18.04 mg/m3,分离培养法计数细菌丰度平均为6.56×105cfu/L,水体中的细菌主要类群为:γ-变形菌(36.5%)、厚壁菌门(12.3%)、蓝菌门(12%)等;平均水温-1.0 ℃(实验时放置室温使水温升至10 ℃时浸泡创面);平均盐度31.0;表层海水平均密度26.0;平均pH 8.0[5]。
1.3 实验方法 实验前适应性驯养1周, 术前禁食水12 h,肌肉注射氯胺酮(0.05 mg/kg)和盐酸赛拉嗪注射液(0.2 ml/kg)复合麻醉。麻醉前15 min给予阿托品减少呼吸道分泌物,麻醉后用肥皂水洗净皮肤,于双侧肩胛部、臀部肌肉发达处充分备皮,用雷管(660929F48841-56)在每头猪的双侧肩胛部、臀部制造4个损伤程度相当的海水浸泡爆炸伤创面[6],清创后随机进行VSD -120 mmHg、VSD -180 mmHg、VSD -240 mmHg(实验组)和常规治疗(对照组)。对照组每日常规换药,表面覆盖8~10层的无菌纱布;实验组创面清创后,根据创面大小和形状修剪VSD敷料,应用半透性贴膜封闭创面,引流管链接负压吸引器,根据实验要求设置负压值,每天持续负压吸引,隔1 d换1次VSD敷料。所有创面均治疗9 d,并动态观察至所有创面愈合。分别于治疗前和治疗后9、30和58 d(所有创面愈合)时,取各组创缘皮肤组织进行HE染色,动态对比观察。每次取材均在常规消毒前,取材后各创面用碘伏常规消毒,尽量祛除创面中的坏死组织,直至创面有新鲜的渗血,再用碘伏、生理盐水冲洗创面。
1.4 创缘组织HE染色 各组于治疗前、治疗后9、30、58 d,分别在不同位置切去0.5 cm×0.5 cm×0.5 cm组织,置于4%多聚甲醛中固定,固定好之后取材,逐级脱水至二甲苯透明,石蜡包埋,切片后脱蜡至水,进行HE染色并对比观察。

2 结果
2.1 创面观察 治疗前,创面近似圆形,基底苍白,直径7.0~8.5 cm,按照透明膜质量法测定创面大小为7.5 cm×8.0 cm~7.6 cm×8.4 cm,创面深度累及全层皮肤至部分脂肪层,仅有散在点状损伤累及到肌肉表面,创周可见红晕,红晕内皮肤肿胀苍白,坏死范围界线不清,坚韧无弹性(图1a);治疗后9 d,实验组创缘开始收缩,创基肉芽增生活跃,以VSD-120 mmHg组创面最明显,而对照组创缘收缩不明显,创面表面覆盖厚厚的黑色结痂,大部分创面仍有继续扩大加深倾向(图1b~e);治疗后30 d,实验组创面明显缩小,创周上皮化明显,创基肉芽红润且增生填平创面,以VSD-120 mmHg组创缘缩小最明显,其次是VSD-180 mmHg组,再次是VSD-240 mmHg组,而对照组创面缩小不明显,部分创面表面仍可见黄色脓液(图1f~i);58 d实验组创面消失,伴大量毛发生长,以VSD-120 mmHg组创面愈合最快,其次是VSD-180 mmHg组,再次是VSD-240 mmHg组;而对照组创面表面覆盖一层厚厚的黑白相间结痂,结痂外皮肤上皮化良好,伴毛发生长(图1j~m)。
2.2 各组创面平均愈合时间 实验期间,所有动物均存活,9 d后各创面暴露,不予治疗,所有创面愈合时间为治疗后58 d。VSD-120 mmHg组、VSD-180 mmHg组、VSD-240 mmHg组和对照组的平均愈合时间分别为(38.80±2.56)、(42.00±1.60)、(44.60±2.08)和(50.20±3.76) d。 经秩和检验,实验组创面愈合时间较对照组短 (P=0.003),但相邻压力组间差异无统计学意义(P>0.05)。
2.3 创缘组织病理 正常猪皮肤组织的真皮乳头层较薄,位于基底层下方,由纤细的胶原纤维组成,HE染色呈淡粉色,含有丰富的毛细血管,毛细血管管壁为一层内皮细胞,内可见1、2个红细胞;网状层较厚,位于乳头层的下方,主要由粗大的胶原纤维组成,HE染色呈红色波纹状(图2a)。治疗前,真皮胶原纤维水肿,间隙增宽,排列紊乱,毛细血管扩张充血,少量红细胞外溢,血管周围可见炎细胞浸润(图2b)。治疗后9 d,实验组创缘组织表皮细胞棘层肥厚较明显,细胞核小,胞浆幼稚淡染,表皮突密集峰状,真皮内纤维排列及走向较规则;对照组创缘组织表皮细胞棘层增厚不明显,且表皮突少而圆钝,真皮胶原纤维水肿,排列及走向较杂乱,并可见散在纤维坏死(图2c,d)。治疗后30 d,实验组创缘组织表皮细胞角化良好,颗粒层、棘层略肥厚,胞浆、胞核趋向成熟,真皮胶原纤维排列及走向规则,以VSD-120 mmHg组创缘修复最好,其次是VSD-180 mmHg组;对照组角质层偏薄,角化不良,真皮内纤维排列比较规则,仍可见大量炎细胞浸润(图2e,f)。治疗后58 d,实验组创缘表皮各层细胞分化基本成熟,处于较稳定状态,表皮突分布少且短宽,真皮纤维排列整齐,而对照组表皮突细长,分布较密集,部分表皮突远端分叉,且真皮纤维间隙较正常组织偏宽,纤维排列相对比较紊乱,提示上皮组织仍处于修复活跃期(图2g,h)。
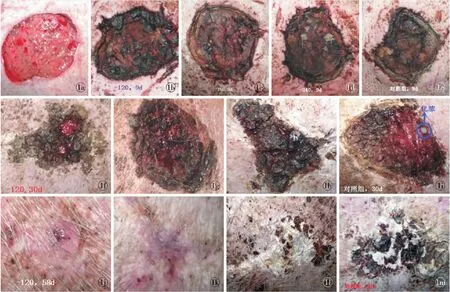
图1 各组治疗前后创面对比 a.治疗前 b.VSD -120 mmHg组治疗后9 d c.VSD -180 mmHg组治疗后9 d d.VSD -240 mmHg组治疗后9 d e.对照组治疗后9 d f.VSD -120 mmHg组治疗后30 d g.VSD -180 mmHg组治疗后30 d h.VSD -240 mmHg组治疗后30 d i.对照组治疗后30 d j.VSD -120 mmHg组治疗后58 d k.VSD -180 mmHg组治疗后58 d l.VSD -240 mmHg组治疗后58 d m.对照组治疗后58 d
Fig1 Comparison between preview and postview of wounds in each group. a. preview. b. postview at 9 days of VSD -120 mmHg group.c. postview at 9 days of VSD -180 mmHg group. d. postview at 9 days of VSD -240 mmHg group. e. postview at 9 days of control group. f. postview at 30 days of VSD -120 mmHg group. g. postview at 30 days of VSD -180 mmHg group. h. postview at 30 days of VSD -240 mmHg group. i. postview at 30 days of control group. j. postview at 58 days of VSD -120 mmHg group. k. postview at 58 days of VSD -180 mmHg group. l. postview at 58 days of VSD -240 mmHg group. m. postview at 58 days of control group.
3 讨论
3.1 海水的特殊环境对机体的影响 近海域海水的主要理化特点是:高渗、高钠、高碱、低温、含菌量大、污染重等,其作为一种复合致伤因素,不但可加重开放性创伤局部损伤,而且可对整个机体产生明显影响。目前海水致伤的确切机制尚不明确,其主要致伤机制可能包括以下4个方面:①理化因素。海水低温、高渗、高钠、高碱,尤其是低温对机体影响较大。王津等[7]报道,体温降至32 ℃时,心率加快,肌僵直出现;体温降至30 ℃时,心率减慢,心电图显示心肌缺血改变,伴心律失常,个别机体出现室颤;且随体温下降,机体血浆乳酸呈进行性升高,引发机体乳酸性酸中毒。另有学者王大鹏等[8]报道,海水浸泡可加重创面局部及周围组织的变性、坏死及炎症反应,海水浸泡后,血管通透性增加,导致局部出血、血管内微血栓形成,而组织的进一步坏死,有利于细菌入侵与增殖,可形成“组织坏死-细菌感染-组织再坏死”的恶性循环,进一步加重组织损伤;同时发现,碱性海水可使受损的组织形成皂化脂肪和可溶性碱性蛋白,加重组织损伤,低温、酸中毒、凝血病形成恶性循环,称为死亡三联征,对机体产生严重不良影响。②生物因素。随着海洋业的迅速发展,人类在海上的活动日趋频繁,使得海洋污染加重和有机化程度增加,尤其是近海海域污染较为明显,使海水微生物(如细菌、病毒、寄生虫、衣原体、立克次体等)在种类和含量上明显增多,增加了开放性创面的感染机会。海水中细菌的种类和分布与许多因素有关,如地理位置、季节变化、水量大小及污染状况等,有些细菌是天然寄居在水中的常居菌,有些细菌是随垃圾、人畜粪便以及工农业废弃物进入海水中。致病菌可通过污染水和水产品进入人体而引起感染。胡旭和范子锋等[9-10]报道,四肢开放性骨折经过海水浸泡后,创面感染时限提前,炎症反应较重,不利于骨痂形成。本次实验主要研究的是渤海湾近海域海水,海水中细菌种类繁多,大多数为革兰氏阴性杆菌,可产生大量的内毒素、外毒素、溶血毒素、肠毒素等,多为条件致病菌,可使肠道和创面感染。细菌感染能增加血管通透性,引起软组织水肿,产生蛋白水解酶、脂解酶、溶细胞素等,破坏机体正常细胞结构,最终导致败血症。败血症是感染严重的全身性炎症,病死率约为56%,若并发败血症性休克,病死率可高达92%[11]。除了全身性的反应,感染还可影响局部组织血管再生与重建,使组织坏死,阻止创伤组织的修复进程。③淹溺因素。机体在海水中耐受时间的长短,受海上风浪、机体自身水性、损伤轻重、获救时间等诸多因素的影响。机体损伤重、出血多者容易导致休克昏迷而增大淹溺机会,增加机体伤亡率。④再灌注损伤。胡晓红等[12]报道,海水经伤口进入体腔后,使机体处于高渗状脱水状态,致血液凝固性增多和多发微血栓形成,即使机体获救,在后期的治疗中,容易引发缺血再关注损伤,进而增加机体的伤残率和伤亡率。总之,海水作为一种复合致伤因素,不但可加重局部组织损伤,而且可使机体全身功能紊乱,代谢失衡。本课题以小型猪为实验对象,模拟海水浸泡爆炸伤,虽与实际海战伤存在一定差别,但总体趋势基本一致。实际海战伤可能会因有海浪、海风、水温、水流速度等因素存在,而使伤残率和伤亡率明显高于本实验的研究结果。
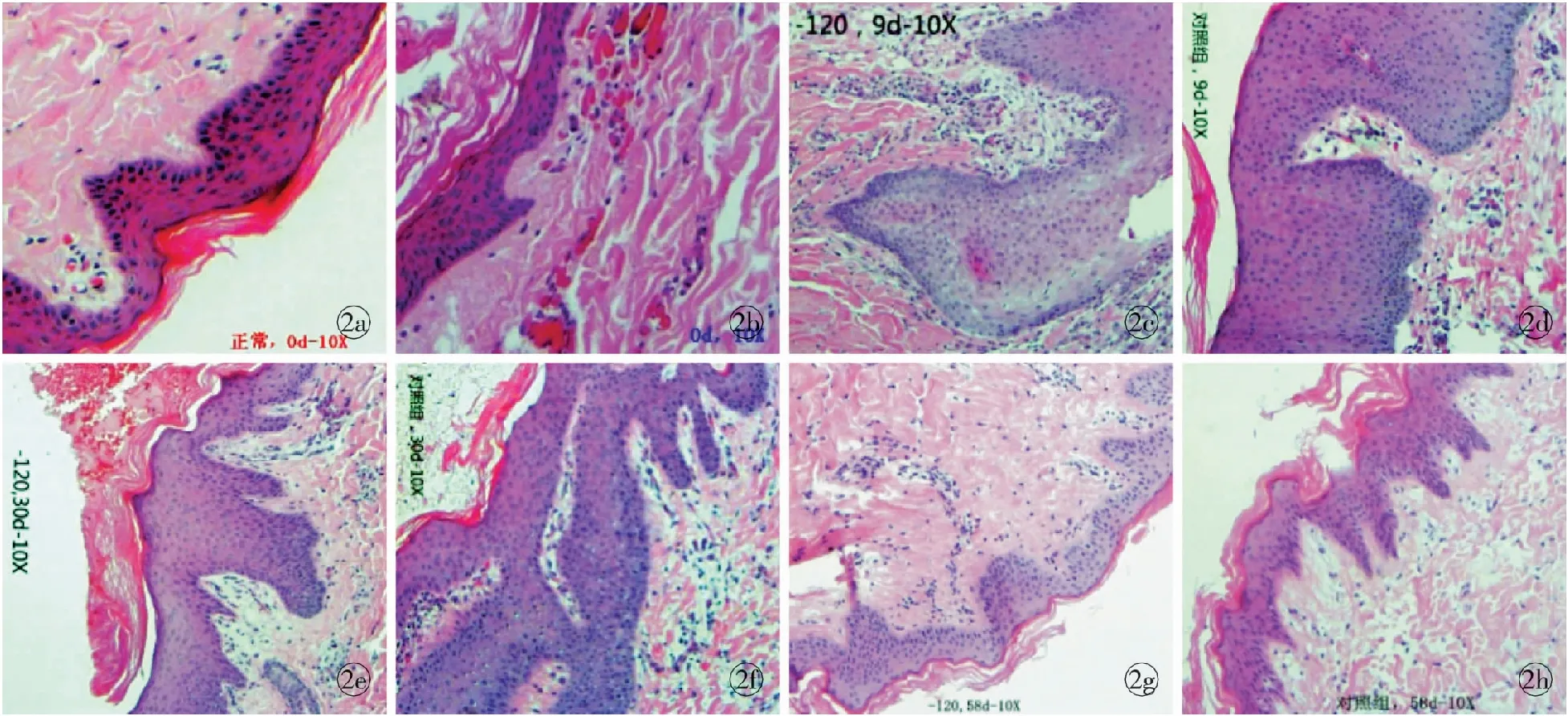
图2 各组治疗前后创缘组织病理(HE ×10) a.正常猪皮肤组织 b.治疗前创缘组织 c.VSD -120 mmHg组治疗后9 d d.对照组治疗后9 d e.VSD -120 mmHg组治疗后30 d f.对照组治疗后30 d g.VSD -120 mmHg组治疗后58 d h.对照组治疗后58 d
Fig2 Comparison between preview and postview of pathology of wound margin tissues in each group(HE ×10). a. normal skin tissue of pig. b. preview. c. postview at 9 days of VSD -120 mmHg group. d. postview at 9 days of control group. e. postview at 30 days of VSD -120 mmHg group. f. postview at 30 days of control group. g. postview at 58 days of VSD -120 mmHg group. h. postview at 58 days of control group.
3.2 VSD技术的优势 创面愈合涉及分子水平、细胞水平、组织水平等多个生物系统间相互作用,并构成一系列复杂的动态病理生理过程[13]。一般皮肤软组织无缺损或缺损不多,可以直接缝合或经皮下潜行剥离后缝合创面,其愈合过程一般经过3个阶段即:炎性渗出阶段、胶原形成阶段和成熟阶段。而开放性创腔、创面因皮肤软组织缺失较大,不能直接对合,其瘢痕愈合过程较复杂,不仅包括以上病理过程,还包括肉芽组织形成、创缘向心性收缩和上皮爬行等[14]。本实验于猪的肩胛部、臀部制造创面,忽略个体差异,主要观察局部干扰因素对创面愈合的影响。汪舒等[3]报道,VSD技术可有效减少爆炸创面继发性坏死,提前启动肉芽组织形成和胶原合成,加速创面愈合;还有学者报道,VSD技术可增加移植皮片的成活率,皮片移植成活率和速率是评价创周上皮爬行快慢的重要指标[15];VSD技术还可增加创面血流量,促进毛细血管生成,缩小创面面积,调节创面局部体液流动,诱导局部细胞增殖,减轻肿胀,提高细菌清除率[16]。从各组创面创缘组织HE染色结果分析: 正常表皮较薄,细胞层数较少,胞质HE染色嗜碱性,真皮乳头层较薄,HE染色呈淡粉色,网状层较厚,HE染色呈红色波纹状;建模后真皮内血管扩张充血,红细胞外溢,血管周围炎症细胞浸润。在创面修复早期,实验组表皮细胞层数逐渐增厚,主要表现为棘层肥厚、细胞核小、胞浆幼稚淡染、表皮突延长增宽、真皮胶原纤维淡染、排列逐渐趋向整齐。于第16天上皮增生达高峰,以后上皮增生逐渐缓慢,上皮细胞逐渐趋向成熟;于第58天上皮组织基本恢复正常。实验组中,以VSD-120 mmHg组创周上皮细胞增殖最活跃,上皮爬行最快,创面愈合最快,其次是VSD-180 mmHg组;而对照组在创面修复早期,创周上皮细胞增厚不明显,真皮纤维排列较紊乱,继发性坏死较明显,于治疗后第9天,可见棘层、颗粒层增厚,但真皮纤维排列仍较紊乱,并可见散在纤维灶性坏死,虽在第58天,表皮各层细胞分化近于成熟,但表皮突细长且分布较密集,部分表皮突远端分叉,提示上皮细胞仍处于活跃期。由此可见,VSD技术主要通过改变创面局部因素来促进细胞增殖,肉芽增生,加快上皮爬行。
综上所述,①VSD技术可诱导创周细胞增殖,促进创缘收缩,加快上皮爬行,进而促进创面愈合;②在创面修复早期,创周表皮细胞增殖主要表现为细胞层数增加,主要以棘层增厚为主,胞核小,胞浆幼稚淡染,在创伤修复晚期,创周上皮细胞逐渐趋向成熟,细胞层数趋向正常;③本研究发现,在创面愈合过程中,上皮化进程逐渐加强,上皮化的创面毛发生长基本正常,无瘢痕形成,待完全上皮化时,局部皮肤组织行HE染色与正常皮肤组织无明显异常,可能与本次实验所选动物均为乳猪,皮肤组织中Ⅲ型胶原含量较高有关;④本实验研究表明,在治疗海水浸泡皮肤软组织爆炸伤时,VSD治疗较常规治疗具有明显的优势,且-120 mmHg的压力是相对比较理想的负压,其次是-180 mmHg,但在负压选择上,并非是压力越高(绝对值)或越低效果越好,应综合创面局部因素及机体全身因素选择比较理想的负压。本实验未设置更多的压力作为对照,主要原因是:①实验动物为小型乳猪,体表皮肤有限,且创面损伤大,导致动物不能耐受更多创面;②结合国内外文献报道,VSD在治疗其他类型皮肤软组织损伤时,多设置-120 mmHg或-180 mmHg的压力,且疗效显著。
[1] 薛 云, 刘兴炎, 葛宝丰, 等. 封闭负压引流对软组织爆炸创面的影响[J]. 中国矫形外科杂志, 2011,19(6):495-498.
[2] Li J, Topaz M, Tan H, et al. Treatment of infected soft tissue blast injury in swine by regulated negative pressure wound therapy [J]. Ann Surg, 2013,257(2):335-344.
[3] 汪 舒, 刘兴炎, 葛宝丰, 等. 猪后肢软组织爆炸伤后封闭负压引流组织修复效果与常规法的比较[J]. 中国组织工程研究与临床康复, 2010,14(50):9337-9340.
[4] Lauten A, Gerhard-Garcia A, Suhr F, et al. Impact of ischemia-reperfusion on extracellular matrix processing and structure of the basement membrane of the heart[J]. PLoS One, 2014,9(3):e92833.
[5] 孙 松. 中国区域海洋学-生物海洋学[M]. 北京:海洋出版社, 2012:12-15.
[6] 梁献平, 石 冰, 马永奇, 等. 猪皮肤软组织海水浸泡爆炸伤创面动物模型的建立[J]. 中国美容整形外科杂志, 2014,25(8):510-512.
[7] 王 津, 朱晓发, 丁振元, 等. 海水浸泡性低温对机体代谢的影响[J]. 军医进修学院学报, 2007,28(6):420-441.
[8] 王大鹏, 宁浩勇, 孟宇宏, 等. 火器伤合并海水浸泡后对大鼠伤口愈合的影响[J]. 中国比较医学杂志, 2008,18(10):76-80.
[9] 胡 旭, 吴灼金, 杨永林. 四肢开放性骨折海水浸泡后的治疗[J]. 海军医学杂志, 2010,31(3):234-236.
[10] 范子锋, 尹秀珍, 王甲汉, 等. 海水浸泡对大鼠深Ⅱ度烫伤后创面愈合的影响[J]. 中华航海医学与高气压医学杂志, 2011,18(4):221-223.
[11] Lin JN, Lai CH, Chen YH, et al. Characteristics and outcomes of polymicrobial bloodstream infections in the emergency department: A matched case-control study[J]. Acad Emerg Med, 2010,17(10):1072-1079.
[12] 胡晓红, 李 毅, 薛志强, 等. 胸部开放伤海水浸泡致急性肺损伤早期血管内皮生长因子水平变化[J]. 中国呼吸与重症监护杂志, 2009,8(5):482-486.
[13] Zgheib C, Xu J, Liechty KW. Targeting inflammatory cytokines and extracellular matrix composition to promote wound regeneration [J]. Adv Wound Care (New Rochelle), 2014,3(4):344-355.
[14] Ponrasu T, Madhukumar KN, Ganeshkumar M, et al. Efficacy of Acorus calamus on collagen maturation on full thickness cutaneous wounds in rats[J]. Pharmacogn Mag, 2014,10(38):S299-S305.
[15] Stannard JP, Singanamala N, Volgas DA. Fix and flap in the era of vacuum suction devices: what do we know in terms of evidence based medicine [J]. Injury, 2010,41(8):780-786.
[16] Mouёs CM, Heule F, Hovius SE. A review of topical negative pressure therapy in wound healing: sufficient evidence[J]? Am J Surg, 2011,201(4):544-556.
Effectofvacuumsealingdrainageonthehealingofseawaterimmersedexplosionwoundsinswine
LIANGXian-ping,MAYong-qi,SHIBing,etal.
(DepartmentofPlasticSurgery,the309thHospitalofChinesePeople′sLiberationArmy,Beijing100091,China)
ObjectiveTo dynamically contrast observe the effect of vacuum sealing drainage (VSD) at different negative pressures on pathological changes and wound healing of seawater immersed blast injury, exploring the optimum pressure of VSD.MethodsThe models of seawater immersed explosion wound were established at bilateral shoulders and hips (4 wounds of each) of 5 experimental miniature swine. After debridement, 20 wounds were divided equably and randomly into the control group and the experimental groups (the VSD -120 mmHg group, the VSD -180 mmHg group and the VSD -240 mmHg group). All the wounds in the control group and the experimental group were treated with routine change dressings everyday and with VSD at different pressure for 5 times with 1 day interval, respectively. The wound healing were observed to the 58th day and the wound margin tissues were harvested and stained by HE staining at 9, 30 and 58 days and then the contrast observation were also performed.ResultsCompared with the control group, cell proliferation around the wound was active, epithelium creeping was faster and granulation hyperplasia was rapid. The best pressure was the VSD -120 mmHg and the better one was VSD -180 mmHg.ConclusionCompared with conventional treatment, VSD shows clear benefits on the treatment of seawater immersed explosion wounds, and -120 mmHg pressure may be the ideal pressure for treatment.
Vacuum sealing drainage; Seawater immersion; Explosion injury; Swine
10.3969/j.issn.1673-7040.2014.10.020
R364;R622
A
1673-7040(2014)10-0633-05
2014-08-20)
100091 北京,解放军第三〇九医院 整形外科(梁献平,石 冰);大连大学附属新华医院 整形外科(马永奇,张 晨)
梁献平(1981-),女,河北邯郸人,硕士研究生.
石 冰,100091,解放军第三〇九医院 整形外科,电子信箱:15010233889@163.com
