神经再生条件液对成纤维细胞和施旺细胞的生物学活性影响
2014-11-02李青峰李广帅于冬梅郝立君
丁 爽, 李青峰, 李广帅, 郑 岩, 于冬梅, 罗 赛, 郝立君
实验研究
神经再生条件液对成纤维细胞和施旺细胞的生物学活性影响
丁 爽, 李青峰, 李广帅, 郑 岩, 于冬梅, 罗 赛, 郝立君
目的探索神经再生条件液对体外培养的大鼠成纤维细胞和施旺细胞的生物学活性影响。方法用含有不同浓度的NRCF的培养基连续培养成纤维细胞和施旺细胞24 h,用CCK-8法检测细胞增殖;用流式细胞仪检测细胞周期,免疫荧光法检测施旺细胞去分化。结果随着神经再生条件液浓度的提高及神经再生条件液对细胞作用时间的增加,成纤维细胞和施旺细胞的增殖呈上升趋势; 神经再生条件液对成纤维细胞和施旺细胞的细胞周期改变发生在S期;神经再生条件液能够促进施旺细胞去分化。结论神经再生条件液能够促进成纤维细胞的增殖并促进施旺细胞的增殖和去分化。
外周神经损伤; 神经再生条件液; 成纤维细胞; 施旺细胞; 细胞增殖; 去分化
周围神经损伤时,在损伤的神经远、近两断端间桥接一个硅胶管,形成一个密闭间隔,这个密闭的间隔被称之为神经再生室。神经再生室模型所提供的封闭环境是研究周围神经再生的重要模型。神经再生室内所形成的再生微环境及其中的主要成分被称为神经再生条件液(nerve regeneration conditioned fluid, NRCF )[1]。研究显示,NRCF非常适合对源于创伤神经干断端的活性因子的研究[1]。成纤维细胞和施旺细胞被证实大量存在于周围神经当中[2],自2012年3月,我们的实验着重研究NRCF对这两种细胞的生物学活性的影响。
1 材料与方法
1.1 材料 Lewis雄性大鼠(华东师范大学SPF动物中心提供);新生Lewis大鼠1~3 d(上海交通大学附属第九人民医院SPF动物房提供);DMEM培养基(美国THERMO公司);PBS、胶原酶(Collagenase NB4,德国SERVA公司);中性蛋白酶(dispaseⅡ,美国SIGMA公司); Anti-p75 NGF Receptor antibody(英国ABCAM公司)。
1.2 神经再生室模型的建立及NRCF的提取 采用雄性Lewis大鼠50只,体质量约150 g。将大鼠麻醉后,显露坐骨神经,于坐骨切迹下10.0 mm处剪断神经并去除2.0 mm,用消毒后内径1.5 mm、长14.0 mm硅胶管桥接两断端,形成神经再生室模型。术后按标准饲养动物,1周后,用微量注射器抽取再生室中的NRCF,每侧神经再生室获取NRCF 3~5 μl,共获取NRCF约200 μl。-80 ℃低温冻存备用。
1.3 细胞培养 原代成纤维细胞和施旺细胞的提取及培养原代成纤维细胞和施旺细胞的提取。新生1~3 d的Lewis大鼠20只,取出坐骨神经,加入0.2%Collagenase NB4与0.2%dispase 1∶1混合液待充分消化后,放置5%CO2、37 ℃ 饱和湿度条件下恒温培养箱中培养。48 h后,用酶纯化法纯化施旺细胞。将纯化后剩余的成纤维细胞和纯化后的施旺细胞分别接种培养瓶中,用含10%小牛血清的DMEM培养基培养细胞。
1.4 组织块细胞培养法 采用雄性Lewis大鼠20只,体质量120 g左右。将大鼠麻醉后,截取出坐骨神经。在显微镜下修剪成长2.0~3.0 mm的小段,分别用DMEM培养基(对照组,A组)及含有NRCF浓度为1×104ng/ml的DMEM培养基(实验组,B组)在5%CO2、37 ℃饱和湿度条件下恒温培养箱培养3 d。到达时间点后,提取培养的神经置入含4%多聚甲醛的溶液中,4 ℃固定,备用。
1.5 CCK-8法 ①NRCF对成纤维细胞和施旺细胞的浓度梯度检测。细胞倍增时间取培养的细胞进行消化、离心、重悬、计数。按每孔1500 个细胞接种到96孔细胞培养板中,分7组:1组作为对照组(DMEM培养基培养设为组1);其余6组作为实验组(含有不同NRCF浓度的DMEM培养基培养)分别设定NRCF浓度为:10、100、1×103、1×104、1×105、1×106ng/ml(依次设定为组2~7),每组设6个复孔。置于37 ℃、5%CO2饱和湿度条件下恒温培养箱培养。接种后培养24 h用酶标仪检测吸光值。②NRCF对成纤维细胞和施旺细胞的时间梯度检测。细胞倍增时间取培养的细胞进行消化、离心、重悬、计数。按每孔1500个细胞接种到96孔细胞培养板中,分两组:1组作为实验组(含有NRCF浓度为1×104ng/ml的DMEM培养基培养,设为组1);2组作为对照组(DMEM培养基培养,设为组2),每组设6个复孔。置于37 ℃、5%CO2饱和湿度条件下恒温培养箱培养,分别以培养6、12、18、24 设为时间点。到达时间点后,用酶标仪检测吸光值。
1.6 流式细胞仪检测细胞周期 细胞倍增时间取培养的细胞进行消化、离心、重悬、计数,接种于培养板中,分两组:1组作为实验组(含有NRCF浓度为1×104ng/ml的DMEM培养基培养,设为组A);2组为对照组(DMEM培养基培养,分别设为组B、C、D、E),每组设3个复孔。接种后分别培养6、12、18、24 h,收集细胞,用流式细胞仪检测细胞周期。
1.7 免疫荧光 在显微镜下,将固定好的体外培养的神经平铺于载玻片上,标本固定后,进行免疫荧光染色。封片剂封片后,荧光显微镜下进行观察。
1.8 统计学处理 采用SPSS 16.0 for Windows统计软件进行处理,多组间的均数比较采用单因素方差分析,两组间比较采用t检验,方差不齐时则采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 CCK-8法检测增殖作用 ①成纤维细胞的增殖。通过CCK-8法检测到成纤维细胞在含有不同浓度的NRCF培养基作用24 h后, 成纤维细胞的增殖随着NRCF浓度的增加成上升趋势,差异有统计学意义(P<0.05)。当NRCF浓度设定为1×104ng/ml时,24 h内随着NRCF作用时间的延长,成纤维细胞的增殖呈递增趋势(图1),差异有统计学意义(P<0.05)。②施旺细胞的增殖。通过CCK-8法检测到施旺细胞在含有不同浓度的NRCF的培养基作用24 h后,当其浓度达1×104ng/ml以上时,差异有统计学意义(P<0.05);当其浓度为1×104ng/ml时,24 h内随着NRCF作用时间的延长,施旺细胞的增殖呈递增趋势,差异有统计学意义(P<0.05),见图2。2.2 流式细胞仪检测细胞周期 ①成纤维细胞的细胞周期变化。用含有1×104ng/ml浓度的NRCF培养基培养成纤维细胞,持续观察24 h。通过流式细胞仪检测的数据分析,成纤维细胞的细胞周期变化主要表现在S期(P<0.05),S期的变化随着培养时间的增加成上升趋势,18 h到达高峰(图3);②施旺细胞的细胞周期变化。用含有1×104ng/ml浓度的NRCF培养基培养施旺细胞,持续观察24 h时。通过流式细胞仪检测的数据分析,施旺细胞的细胞周期变化主要表现在S期(P<0.05)。S期的变化随着培养时间的增加呈上升趋势(图4)。
2.3 免疫荧光法验证去分化 用含有1×104ng/ml浓度的NRCF培养基体外培养大鼠坐骨神经,连续培养3 d,用施旺细胞特征性去分化抗体P75进行免疫荧光染色(红色)。可以观察到实验组与对照组有差异(图5),说明NRCF能够促进施旺细胞去分化。
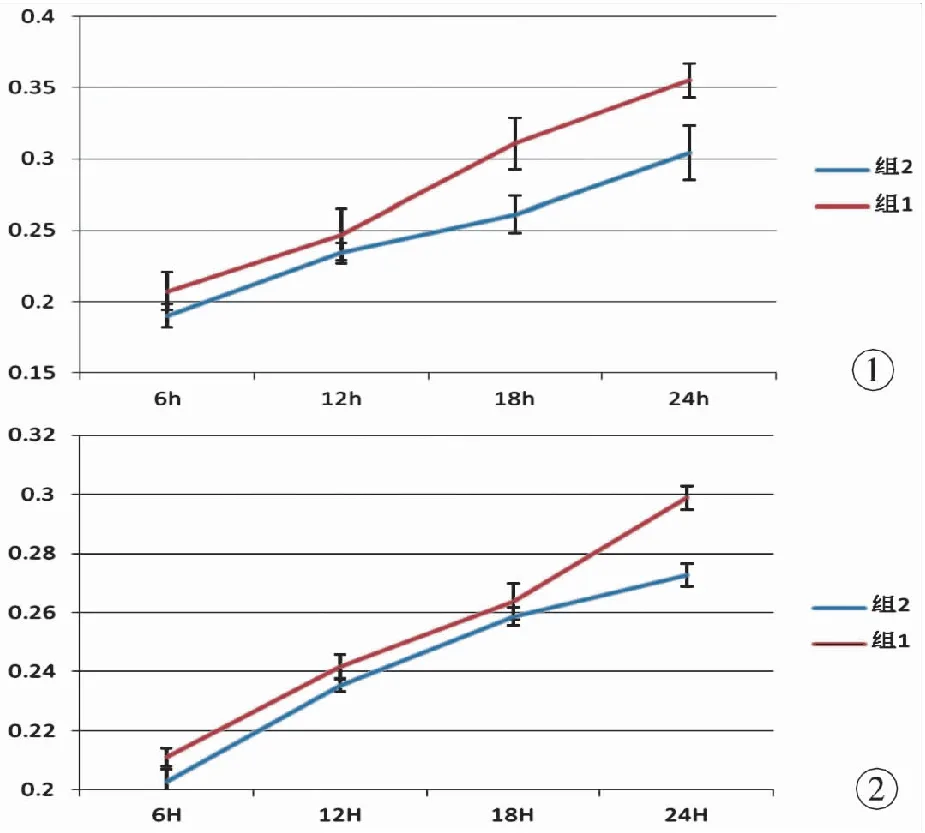
图1 成纤维细胞的时间增殖曲线图2 施旺细胞的时间增殖曲线(组1:实验组NRCF浓度为1×104ng/ml的DMEM培养基;组2:对照组DMEM培养基)
Fig1 Time-dependency proliferation curve of fibroblasts.Fig2 Time-dependency proliferation curve of Schwan cells(Group 1: the experimental group with DMEM including 1×104ng/ml NRCF. Group 2: the control group with DMEM).
3 讨论
神经再生具有自我完善和自我调控的能力(MA Bisby,1983年)。周围神经损伤后,能否实现成功再生,与神经趋化性,损伤的局部对轴突的接触引导作用,以及再生微环境等因素密切相关。近年来,随着人们对分子生物学的深入研究,发现再生微环境是外周神经损伤后能否实现成功再生的关键因素(朱家恺,1991年)。NRCF作为神经再生室中的功能性成分,体现了周围神经再生微环境的特征[3]。NRCF能够对再生神经提供营养、支持和导向的作用,是神经再生自我完善及自我调控机制充分发挥的重要条件[1]。较早的研究中,推测NRCF中可能主要存在三类物质:神经营养因子(neurotrophic factors, NTFs)、细胞外基质(extracellular matrix, ECM )和促突起生长因子(neuritepromoting factors, NPFs)[4]。李青峰等[5]通过Native PAGE分离NRCF中的蛋白成分进行分析,发现相对分子质量为(232~440)×103的蛋白能促使后根神经节突起的生长,说明NRCF具有明显的神经营养性和再生趋化性。
通过BCA法检测,我们粗略地计算出提取出来的NRCF的蛋白浓度约为50 mg/ml。在本实验中可以观察到,当NRCF的浓度为1×103ng/ml时,就可以明显地促进成纤维细胞的增殖作用,说明NRCF中的蛋白成分对成纤维细胞具有重要的作用。本实验中观察到,随着NRCF浓度的提高,成纤维细胞的增殖呈上升趋势;随着NRCF对成纤维细胞作用时间的增加,增殖也呈上升趋势。在CCK-8法和流式细胞仪检测结果中均发现,成纤维细胞的增殖高峰,发生在NRCF对其作用18 h后,说明18 h是NRCF对成纤维细胞作用的关键时间点。Sorrell 和Caplan[6]验证了外周神经损伤早期,大量的成纤维会聚集在损伤部位并发挥作用。本实验通过NRCF对成纤维细胞的促增殖作用,验证了大量成纤维细胞出现的原因。说明NRCF能够通过促进成纤维细胞的增殖作用促进外周神经的修复。
沃勒变性(wallerian degeneration, WD )是外周神经系统最初级的反应。它发生当外伤性、中毒性、缺血性或代谢性事件发生时所引起的神经纤维连续性的中断[7]。WD包括轴索变性并伴随脱髓鞘的发生。脱髓鞘的早期是由施旺细胞的去分化所引起,所以轴突的离断,导致了施旺细胞之间缺少了联系,与施旺细胞去分化的开始有关[8]。本实验中发现,当NRCF的浓度为1×104ng/ml时,可以促进施旺细胞的增殖,同时也可以促进施旺细胞去分化。轴突受损伤以后,施旺细胞会发生一系列变化,包括通过增殖和去分化来促进轴突的再生[9-10]。本实验中也验证了这一点, NRCF能够促进施旺细胞的增殖和去分化,说明NRCF能通过促进施旺细胞的增殖和去分化来促进轴突的再生。
轴突的损伤可引起一系列的事件,例如,血-神经屏障破坏、施旺细胞的增殖、巨噬细胞的聚集[11-12]、神经内膜的空间重组、细胞外基质成分的改变以及神经营养蛋白的提高和细胞因子的产生。NRCF是损伤局部发生的早期微环境,是神经再生自我完善及自我调控机制充分发挥的重要条件[1]。本实验选取NRCF浓度为1×104ng/ml时,已经有效地证明了NRCF能够促进成纤维细胞和施旺细胞的增殖作用,以及促进施旺细胞去分化的作用,进而促进外周神经的修复和再生,体现其生物学特性。NRCF当中存在大量的蛋白成分,但是对NRCF的提取、分离及对其中蛋白成分的检测,也十分困难。因为模型中NRCF获取的量有限,接下来我们还需要选取更多浓度进行检验,以明确NRCF对成纤维细胞和施旺细胞的最佳作用浓度和时间。另外,NRCF对成纤维细胞和施旺细胞的作用是通过其中的哪一种或者哪一些蛋白起到的作用,还需要我们进一步地检验,同时这种或这些蛋白通过什么途径发挥的作用也需要我们做深入地研究,从而使NRCF在外周神经损伤修复的临床工作中发挥最大的生物学作用。
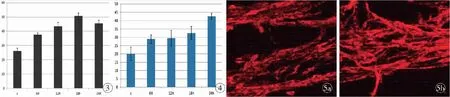
图3 NRCF对成纤维细胞的细胞周期中S期的影响图4 NRCF对施旺细胞的细胞周期中S期的影响图5 NRCF对施旺细胞的去分化作用 a. 对照组DMEM培养基 b. 实验组NRCF浓度为1×104ng/ml的培养基
Fig3 Effect of NRCF on Phase S of the cell cycle of fibroblasts.Fig4 Effect of NRCF on Phase S of the cell cycle of Schwann cells.Fig5 Effect of NRCF on dedifferentiation of Schwann cells. a. the control group with DMEM. b. the experimental group with DMEM including 1×104ng/ml NRCF.
[1] Bates DJ, Ranford JA, Mangelsdorf DC. Blot and culture analysis of neuronotrophic factors in nerve regeneration chamber flui-ds [J]. Neurochem Res, 1991,16(6):621-628.
[2] 杨新文, 王 勇. 黄芪诱导大鼠骨髓间充质干细胞分化为神经样细胞[J].中国组织工程研究与临床康复, 2008,12(25):4996-5000.
[3] 李玉萍, 姜 浩, 李青峰, 等. 周围神经再生条件液中蛋白条带质谱分析[J]. 中国修复重建外科杂志, 2007,21(6):596-599.
[4] Lundborg G, Dahlin L, Danielsen N, et al. Trophism, tropism, and specificity in nerve regeneration[J]. J Recontr Microsurg, 1994,10(5):345.
[5] 李青峰, 徐鲁平, 景乃禾, 等. 神经再生条件液中活性蛋白的分离和检测[J]. 中国修复重建外科杂志, 1999,13(4):199-201.
[6] Sorrell JM, Caplan AI. Fibroblasts----a diverse population at the center of it all[J]. Cell, 2009,276:161-214.
[7] Allodi I, Udina E, Navarro X. Specificity of peripheral nerve regeneration: Interactions at the axon level[J]. Prog Neurobiol, 2012,98(1):16-37.
[8] Jessen KR, Mirsky R. Negative regulation of myelination: relevance for development, injury, and demyelinating disease[J]. Glia, 2008,56(14):1552-1565.
[9] Fawcett JW, Keynes RJ. Peripheral nerve regeneration[J]. Annu Rev Neurosci, 1990,13:43-60.
[10] Nadim W, Anderson PN, Turmaine M. The role of Schwann-cells and basal lamina tubes in the regeneration of axons through long lengths of freeze-killed nerve grafts[J]. Neuropathol Appl Neurobiol, 1990,16(5):411-421.
[11] Perry VH, Brown MC. Role of macrophages in peripheral-nerve degeneration and repair [J]. Bioessays, 1992,14(6):401-406.
[12] Taskinen HS, Röoyttä M. The dynamics of macrophage recruitment after nerve transaction [J]. Acta Neuropathol, 1997,93(3):252.
EffectofnerveregenerationconditionedfluidonbiologicactivityoffibroblastsandSchwanncells
DINGShuang,LIQing-feng,LIGuang-shuai,etal.
(PlasticandCosmeticCenter,TheFirstAffiliatedHospitalofHarbinMedicalUniversity,Harbin150001,China)
ObjectiveTo explore the effect of nerve regeneration conditioned fluid on biologic activity of rat fibroblasts and schwann cells in vitro.MethodsThe rat fibroblasts and Schwann cells were cultured continuously in NRCF at the different concentrations for 24 hours. The cell proliferation, cell cycle and dedifferentiation of the Schwann cells were detected by Cell Counting Kit-8 (CCK-8), flow cytometry (FCM) and immunofluorescence, respectively.ResultsThe proliferation intensity of cultured cells increased with the increasing concentration of NRCF. The proliferation intensity of the fibroblasts and Schwann cells cultured with the same concentration of NRCF for 24 hours increased with the increasing hours. The changes of the cell cycle of fibroblasts and Schwann cells caused by NRCF occurred mainly at Phase S. NRCF had positive effect on promoting the dedifferentiation of Schwann cells.ConclusionNRCF can promote the proliferation of fibroblasts. NRCF can promote the proliferation and dedifferentiation of Schwann cells.
Peripheral nerve injury; Nerve regeneration conditioned fluids; Fibroblast ; Schwann cell; Proliferation; Dedifferentiation
10.3969/j.issn.1673-7040.2014.04.019
R332
A
1673-7040(2014)04-0245-04
2014-01-09)
150001 黑龙江 哈尔滨,哈尔滨医科大学附属第一医院 整形美容中心(丁 爽,于冬梅,罗 赛,郝立君);上海交通大学附属第九人民医院 整复外科(李青峰,郑 岩);郑州大学第一附属医院 整形外科(李广帅)
丁 爽(1985),女,黑龙江哈尔滨人,硕士研究生.
郝立君,150001,哈尔滨医科大学医学院附属第一医院 整形美容中心,电子信箱:lijun337@yahoo.com.cn
