微生物适冷酶及其应用研究新进展
2014-10-25刘静雯
于 鹏,刘静雯
(集美大学生物工程学院,福建 厦门 361021)
根据Bruun(1959)的深海生态区划,海洋冷水圈的年平均温度在10℃到5℃之间。这种环境是一个潜在的微生物多样性的宝库,有革兰阴性菌(如假交替单胞菌属、莫拉克斯氏菌属、嗜冷菌属、嗜冷弯曲菌属、极地杆菌属和假单胞菌属等),革兰阳性菌(如节细菌属、芽胞杆菌属和微球菌属等),古生菌(如产甲烷菌属、球菌属和盐红菌属等),酵母菌(假丝酵母属和隐球菌属),真菌(青霉菌属和枝孢属)。根据生长温度的不同,海洋冷水圈微生物又被分为两大类:嗜冷微生物(最适生长温度低于15℃)和适冷微生物(最适生长温度在20~25℃左右)。近年来,人们在极地微生物代谢产物中发现了许多具有重要应用价值的适冷酶,主要有 α-淀粉酶、纤维素酶、蛋白酶、脂肪酶、果胶酶、β-半乳糖苷酶和植酸酶等。由于适冷酶在食品行业(果胶酶、β-半乳糖甘酶)[1-2]、饲料行业(植酸酶)[3]、纺织品的生物抛光和石洗以及洗涤行业(脂肪酶、α-淀粉酶和纤维素酶)[4-6]具有潜在的应用价值,世界各国已经加大了对工业适冷酶研究的支持力度。此外,有些适冷酶在生物修复(比如氧化酶)和生物转化(甲基化酶和转氨酶)方面的应用也已经取得了成功。
1 适冷酶的结构特征
酶在低温环境中活化能较低,而适冷酶能够通过柔韧性的结构弥补活化能的不足。与同类嗜温酶和嗜热酶相比,适冷酶表现为较低的活化焓(△H#)和活化熵(△S#),当温度降低时,适冷酶的反应速率往往会下降得更慢,这种热力学活化参数能够转化为酶在低温下相对较高的催化活性(Kcat)和结构柔韧性。
通常热不稳定性适冷酶与稳定性较高的同类嗜温酶和嗜热酶的结构相差较大,这些结构特征赋予了适冷酶高度的柔韧性。例如,适冷酶往往具有以下特征:核心疏水性降低,表面亲水性增加,精氨酸与赖氨酸比例降低,域间和亚基间的相互作用减弱,环状结构多而长,二级结构数量减少,甘氨酸残基数量增加,环状结构中脯氨酸残基数量减少,α-螺旋中脯氨酸残基数量增加,金属离子结合位点数量减少,二硫桥数量减少,静电相互作用减弱(氢键、盐桥、芳香族-芳香族相互作用)等[7]。来自北极海冰细菌的锌金属蛋白酶,其氢键大量减少使得酶的结构柔韧性得到提高[8],表明适冷酶能够通过特殊的方式使其具有结构柔韧性。
2 酶筛选的新发现
目前主要通过平板筛选和宏基因组文库技术获得新的适冷酶。
通过选择性培养基筛选的方法从环境样品中分离产酶微生物,从而发现了许多新的适冷酶,如果胶酶[1]、植酸酶[3]和 α-淀粉酶[5]等。最近作者利用植酸酶筛选培养基(PSM)从南极海底沉积物样品中分离到10株低温植酸酶产生菌。其中一株酵母菌在PSM平板上于4℃条件下培养3周便出现明显水解圈(图1A)。另一株酵母菌经鉴定为红酵母属(Rhodotorula sp.),在15℃培养1周出现明显水解圈,而在4℃下需要较长时间(图1B)。通过发酵条件优化,其37℃酶活大约提高了 3 倍,达到 207.935 U/mL。
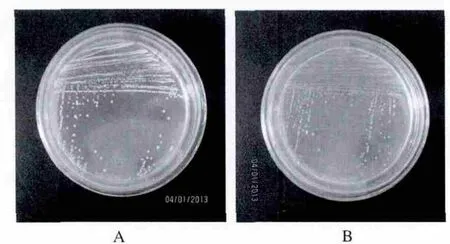
图1 酵母菌株JMUY17和JMUY14菌落及其透明圈Fig.1 The colonies of strain JMUY17 and JMUY14 on solid agar
A:JMUY17的菌落及其透明圈(15℃)B:JMUY14的菌落及其透明圈(4℃)
通过基于功能的酶筛选,如琼脂试验和微滴定板试验,可以从宏基因组文库中鉴定出一些具有潜在生物技术应用的酶的基因。目前已从潮间带沉积物[9]、北极海底沉积物[10]等生境中发现了新的适冷脂肪酶和酯酶。在潮间带沉积物样品中筛选出一种新的适冷碱性脂肪酶,其最适温度为30℃,除了保守区域外,它与已知的脂肪酶基本上不存在氨基酸序列相似性,说明其属于脂解酶的一个新家族[9]。从南极土壤筛选到的一种新的纤维素酶缺少部分纤维素结合结构域,并且具有较高的底物特异性,只能将羧甲基纤维素分解为纤维二糖和纤维三糖[11]。以 O-硝基苯基-β-D-半乳糖苷为底物,从油田土壤构建的宏基因组文库筛选到3个β-半乳糖苷酶基因,其中一种为适冷酶并且在毕赤酵母中显示了较高的表达水平,在烘焙行业具有巨大的应用潜力[12]。
此外,还可通过其他方法获得新的适冷酶基因。利用根据基因的保守序列设计的简并引物,从南极海湾的沉积物中获得一个烷烃单氧酶基因[13],其基因序列与已知的基因序列同源性相比较低(<75%)。使用鸟枪测序法可以从环境样品中获得大量基因序列,对其进行分析能够快速筛选出大量潜在的目的基因。如通过对北极永久冻土宏基因组文库进行分析得到了海藻糖酶、几丁质酶、β-葡糖苷酶和 β-半乳糖苷酶的基因[14]。
3 适冷酶的改造与低温表达系统
适冷酶在低温下催化效率较高,因此在生物技术领域的应用前景非常广阔。为了获得较高的催化效率,适冷酶的构象柔性明显增强,然而这会导致其稳定性的下降,在某种程度上阻碍了其在工业中的应用。如能不影响适冷酶低温下的催化效率使其稳定性增强,它们将会发挥更大的应用潜力。
目前主要通过基因工程的方法提高低温酶的活性和热稳定性。采用定点突变的方法能够增强适冷弧菌丝氨酸蛋白酶(VPR)的热稳定性,突变体的T(50%)和T(m)都提高了大约3℃,而且酶的活性也得到了提高。进一步研究表明,去掉VPR中同类嗜热酶不具有的C-末端扩展序列的15个残基,酶的热稳定性进一步得到改善。这阐明了如何通过比较适冷菌和嗜温菌/嗜热菌的蛋白酶的结构来改善蛋白酶的品质[15]。采用同样的技术,对吉氏芽胞杆菌碱性蛋白酶(BgAP)进行3轮定点突变,将替换的氨基酸进行重新组合得到突变体MF1。然后结合优化的微量滴定板表达系统和传统的蛋白水解检测方法进行高通量筛选,在文库中筛选出58℃孵育后蛋白水解活性增强的突变体。与野生型相比,其活性(15℃)提高了1.5倍,在60℃的半衰期延长了超过100倍[16]。来自适冷铜绿假单胞菌的LipC能够承受高浓度的离子和重金属,并且在较高温度下底物特异性会发生改变,但是较低的温度耐受性限制了其在工业流程中的应用。通过合理设计,使用饱和诱变的方法使LipC的热稳定性提高了7倍[17]。这些研究表明改善酶的一种特性(活性/稳定性)而不影响酶的其他特性是可行的。在工业生产中,为了获得较好的经济效益,可以通过培养基成分和发酵条件的优化提高酶的产量。通过响应面试验设计,菌株Kurthia CZC0806的低温植酸酶活性达到了 103.11 U/mL[18]。此外,还可以通过酶基因的克隆表达来获得大量适冷酶。低温表达系统具有巨大的应用价值,其优势在于:①能够维持热不稳定性适冷酶的稳定性,从而有利于适冷酶的纯化;②低温表达能够减少包涵体,从而有利于可溶性蛋白的生产;③低温表达系统的构建将会进一步推动嗜冷菌宿主基因操作方面的研究。现已将嗜冷微生物自身的质粒应用于低温表达系统。如使用南极油螺旋菌属细菌的groEL构建的大肠埃希菌低温表达系统,能够使大肠埃希菌在低温下较好地生长和过量表达蛋白[19]。
4 适冷酶在生物技术领域中的应用
适冷酶在低温下具有较高的Km和Kcat,当温度升高时又极易变性失活并且能够在有机溶剂中发挥作用,这些特性使其在生物工艺中得到广泛应用。在低温下,适冷酶比同类嗜温酶和嗜热酶催化效率更高,因此能够节约能源,带来更高的经济效益。在低温环境的蚯蚓体内发现一种适冷纤维素酶复合体既具有内源-β-1,4-D-葡聚糖酶活性,又具有β-1,4-葡糖苷酶活性,因此能够将纤维素直接转化为葡萄糖。纤维素转化为乙醇一般需要相对较高的温度(50~60℃),从而大大增加能耗和生产成本,而使用酵母菌发酵得到的适冷纤维素酶复合体能够在低温下直接利用纤维素大量生产乙醇[20]。这是在低温下使用纤维素废弃物进行生物燃料高效生产的重大进步。植酸酶可以在不同的膳食环境中有效提高植酸盐-磷在单胃动物体内的利用率,改善无机物的生物有效性,不仅可以添加到动物饲料中,在人类营养中也具有潜在的应用价值。Huang等[21]将欧文菌植酸酶的基因进行了克隆表达,与同类嗜温植酸酶相比,不但在低温下具有较高的活性,而且具有较低的Km和较高的Kcat,在动物饲料添加剂中具有潜在的应用价值。在10~60℃范围内,使用纯化的适冷蛋白酶去除丝绸上的茶渍(包含蛋白),结果显示,在低温下洗涤效果非常好,说明这种酶能够用于一些对高温敏感的精美纤维织物的洗涤[22]。此外,在工业生产中应用来自乳酸克鲁维酵母的适冷β-D-半乳糖苷酶能够降低常温菌污染的风险,同时可以在乳糖水解工业中节约能源,提高经济效益[23]。适冷酶潜在的生物技术领域的应用见表1。
目前适冷酶主要应用于洗涤行业。从洗涤剂生产厂家了解到,当洗涤温度从40℃降到30℃时,能耗降低30%,相当于每洗涤1次能够减少100 g CO2的排放。建筑物、地毯和长椅等物品表面往往需要使用喷雾剂或湿巾来清洗,其中在建筑物清洁剂中添加脂肪酶和葡萄糖水解酶能够明显提高石头上霉菌的去除效率,还可以减轻使用常规清洁剂所造成的损坏,为适冷酶的使用提供了很好的途径[28]。在食品加工行业的设备清洗过程中,清洗后残余的酶可能会导致食品变质,使得酶的应用受到很大限制。而适冷酶具有相对较高的热不稳定性,可以通过热水漂洗使其活性降到最低,而且使用适冷酶能够减少低温(生产)与中高温 (清洗)之间的重复次数,从而节约能源,缩短停机时间。因此适冷酶可以作为洗涤添加剂应用于食品加工行业。此外,洗涤剂中通常包含有机溶剂,如超过四分之一的乳制品、食品和工业洗涤剂中含有乙醇,则适冷酶的溶剂耐受性即能在洗涤过程中发挥重要作用。在许多行业,酶在改善洗涤剂的洗涤效果和提高环境可持续性方面发挥了巨大作用。目前适冷酶已经成功应用于一些行业 (如食品行业)的洗涤剂中,并且在其他领域 (如膜过滤工业和石油工业)也具有广阔的应用前景。随着宏基因组文库筛选技术和酶工程技术的发展,适冷酶的新特性(在低温下高活性、能够热失活的热不稳定性和溶剂耐受性)也将在洗涤行业中得到广泛应用。

表1 适冷酶潜在的生物技术领域的应用Table 1 Selected potential biotechnological applications of cold-adapted enzymes
5 展望
由于低温酶生产成本高、产量低,且热稳定性较差,因此低温酶的工业应用仍存在局限性。为能将低温酶大量应用于工业生产,当前低温酶的研究主要集中在基础研究及酶的改良等方面。第一,在低温环境中发现和鉴定可培养或不可培养的新菌株,低温酶是其适应这种极端环境的主要特征,将这些酶分离纯化、克隆来进一步了解其低温适应性,评估其潜在的生物技术应用;第二,培养基的组成成分和发酵条件对低温微生物产酶影响很大,目前主要通过单因素试验、正交试验和响应面试验设计等方法进行条件优化以提高适冷酶的产量,同时研究人员正在努力寻找成本效益更好的培养基,固态发酵的方法也已经用于某些适冷酶的生产;第三,适冷酶的一个主要缺陷在于热稳定性较差,可以通过在环境中筛选适于工业应用的产酶微生物或通过传统诱变以及重组DNA技术改善菌株的方法解决。定点突变技术能够用于检测适冷酶在低温适应性中是否发生了氨基酸的置换,还可用于改善酶的性能(如活性和稳定性),有时为了寻找酶的热稳定性和比活力之间的平衡还要用到协同突变技术。此外,可以通过基因组序列探索低温微生物在低温适应性方面存在共同特征,或是每种微生物都有自己独特的方式,而为了研究调节蛋白的表达与环境温度之间的关系,还有赖于蛋白质组学技术的发展和进步。
[1]Sahay S,Hamid B,Singh P,et al.Evaluation of pectinolytic activities for oenological uses from psychrotrophic yeasts[J].Letters in Applied Microbiology,2013,57(2):115-121.
[2]Ram K,Melinda DC,Priya DS,et al.Cloning,overexpression,purification,and characterization of a polyextremophilic β-galactosidase from the Antarctic haloarchaeon Halorubrum lacusprofundi[J].BioMed Central Biotechnology,2013,13:3.
[3]Park I,Cho J.The phytase from antarctic bacterial isolate,Pseudomonas sp.JPK1 as a potential tool for animal agriculture to reduce manure phosphorus excretion[J].African Journal of Agricultural Research,2011,6(6):1398-1406.
[4]Florczak T,Daroch M,Wilkinson MC,et al.Purification,characterization and expression in Saccharomyces cerevisiae of LipG7 an enantioselective,cold-adapted lipase from the Antarctic filamentous fungus Geomyces sp.P7 with unusual thermostability characteristics[J].Enzyme and Microbial Technology,2013,53(1):18-24.
[5]Roohi M,Kuddus S.Cold-active detergent-stable extracellular α-amylase from Bacillus cereus GA6:Biochemical characteristics and its perspectives in laundry detergent formulation[J].Journal of Biochemistry Technology,2013,4(4):636-644.
[6]Kim HJ,Lee YJ,Gao W,et al.Statistical Optimization of Fermentation Conditions and Comparison of Their Influences on Production of Cellulases by a Psychrophilic Marine Bacterium,Psychrobacter aquimaris LBH-10 Using Orthogonal Array Method[J].Biotechnology and Bioprocess Engineering,2011,16(3):542-548.
[7]Cavicchioli R,Charlton T,Ertan H,et al.Biotechnological uses of enzymes from psychrophiles[J].Microbial Biotechnology,2011,4(4):449-460.
[8]Xie,BB,Bian F,Chen XL,et al.Cold adaptation of zinc metalloproteases in the thermolysin family from deep sea and arctic sea ice bacteria revealed by catalytic and structural properties and molecular dynamics:new insights into relationship between conformational flexibility and hydrogen bonding[J].Journal of Biological Chemistry,2009,284(14):9257-9269.
[9]Kim EY,Oh KH,Lee MH,et al.Novel cold-adapted alkaline lipase from an intertidal flat metagenome and proposal for a new family of bacterial lipases[J].Applied & Environmental Microbiology,2009,75(1):257-260.
[10]Jeon J,Kim JT,Kang S,et al.Characterization and its potential application of two esterases derived from the Arctic sediment metagenome[J].Marine Biotechnology,2009,11(3):307-316.
[11]Berlemont R,Delsaute M,Pipers D,et al.Insights into bacterial cellulose biosynthesis by functional metagenomics on Antarctic soil samples[J].Journal of International Society for Microbial Ecology,2009,3(9):1070-1081.
[12]Wang K,Li G,Yu S,et al.A novel metagenome-derived βgalactosidase:gene cloning,overexpression,purification and characterization[J].Applied Microbiology and Biotechnology,2010,88(1):155-165.
[13]Kuhn E,Bellicanta GS,Pellizari VH.New alk genes detected in Antarctic marine sediments[J].Environmental Microbiology,2009,11(3):669-673.
[14]Yergeau E,Hogues H,Whyte LG,et al.The functional potential of high Arctic permafrost revealed by metagenomic sequencing qPCR and microarray analyses[J].Journal of International Society for Microbial Ecology,2010,4(9):1206-1214.
[15]Siguroardottir AG,Arnórsdóttir J,Thorbjarnardóttir SH,et al.Characteristics of mutants designed to incorporate a new ion pair into the structure of a cold adapted subtilisin-like serine proteinase[J].Acta Biochimica et Biophysica Sinica,2009,1794(3):512-518.
[16]Ronny M,Felix J,Ran T,et al.Increasing activity and thermal resistance of Bacillus gibsonii alkaline protease(BgAP)by directed evolution[J].Biotechnology and Bioengineering,2013,110:711-720.
[17]Cesarini S,Bofill C,Javier Pastor FI,et al.A thermostable variant of P.aeruginosa cold-adapted LipC obtained by rational design and saturation mutagenesis[J].Process Biochemistry,2012,47(12):2064-2071.
[18]Yu S,Zhang QF.Optimization of Medium Components for Low-Temperature-Active Phytase Production by Kurthia CZC0806 using Response Surface Methodology[J].IT in Medicine and Education(ITME),2011,2:658-661.
[19]Margesin R,Feller G.Biotechnological applications of psychrophiles[J].Environmental Technology,2010,31(8-9):835-844.
[20]Ueda M,Goto T,Nakazawa M,et al.A novel cold-adapted cellulose complex from Eisenia foetida:Characterization of a multienzyme complex with carboxymethylcellulase,betaglucosidase,beta-1,3 glucanase,and beta-xylosidase[J].Comparative biochemistry and physiology.Part B,Biochemistry& molecular biology,2010,157(1):26-32.
[21]Huang H,Luo H,Wang Y,et al.Novel low-temperature-active phytase from Erwinia carotovora var.carotovota ACCC 10276[J].Journal of Microbiology and Biotechnology,2009,19(10):1085-1091.
[22]Iram SPH,Qazi SA,Rather RA,et al.Purification and characterization of a cold active alkaline protease from Stenotrophomonas sp.,isolated from Kashmir,India[J].World Journal of Microbiology and Biotechnology,2012,28(3):1071-1079.
[23]Anna WW,Hubert C,Marta W,et al.A novel cold-active β-D-galactosidase from the Paracoccus sp.32d-gene cloning,purification and characterization[J].Microbial Cell Factories,2011,10:108.
[24]Tutino ML,Di PG,Marino G,et al.Cold-adapted esterases and lipases:from fundamentals to application[J].Protein Peptid Letters,2009,16(10):1172-1180.
[25]Wang F,Hao J,Yang C,et al.Cloning,expression,and identification of a novel extracellular cold adapted alkaline protease gene of the marine bacterium strain YS-80-122[J].Applied Biochemistry and Biotechnology,2010,162(5):1497-1505.
[26]Biatkowska A,Cie'sli'nski H,Nowakowska K,et al.A new β-galactosidase with a low temperature optimum isolated from the Antarctic Arthrobacter sp.20B:gene cloning,purification and characterization[J].Archives of Microbiology,2009,191(11):825-835.
[27]Wang QF,Hou YH,Yan PH,et al.Optimization of cold-adapted lysozyme production from the psychrophilic yeast debaryomyces hansenii using statistical experimental methods[J].Journal of Food Science,2012,77(6):337-342.
[28]Valentini F,Diamantia A,Palleschi G.New bio-cleaning strategies on porous building materials affected by biodeterioration event[J].Applied Surface Science,2010,256(22):6550-6563.
