噬菌体gp17基因2种重组产物的抗菌效应比较
2014-10-25王太武柴雅明黄国荣熊鸿燕
王太武,柴雅明,林 辉,黄国荣,向 颖,吴 龙,邬 娜,熊鸿燕
(第三军医大学军队流行病学教研室,重庆 400038)
噬菌体酶作为噬菌体裂解细菌的关键酶,越来越受到研究者的重视[1-3]。蛋白重组技术正是获得纯化噬菌体酶的方法之一,其能够获得纯化的噬菌体酶蛋白作为新的灭菌药物进行下一步研究;噬菌体展示技术也可以将目的蛋白DNA序列插入到噬菌体外壳蛋白结构基因的适当位置,使外源基因随外壳蛋白的表达而表达,用以探索基因功能等方面的研究。在前期工作中,获得了1株烈性噬菌体LSB-1并对其部分基因组测序,通过生物信息学对序列进行分析,找到与噬菌体溶解细菌密切相关酶基因gp17[4]。基于前期的探索结果,本实验拟对噬菌体LSB-1内溶素基因进行克隆、表达以获得纯化目的蛋白,同时采用噬菌体展示技术获得重组噬菌体T7-LSB-gp17,观察两者对细菌的生物活性,并比较活性差异。
1 材料与方法
1.1 材料
LSB-1噬菌体、EIEC8401为第三军医大学军队流行病学教研室储备,于 -70℃保存,pET300质粒购自生工公司,黏液肠埃希菌BLT5403和T7噬菌体为T7 Select Cloning Kit试剂盒自带;BCA蛋白含量测定试剂盒、高速台式冷冻离心机(Sigma)、蛋白质纯化分离系统、9700PCR System(Applied Bio-systems公司)、恒温培养箱(湘仪)、电泳仪(Bio-Rad公司)、凝胶成像系统(Bio-Rad公司)。
1.2 方法
1.2.1 噬菌体目的基因的扩增 根据基因组测序获得LSB-1噬菌体内切唾液酸酶的gp17基因序列和引物设计的基本原则,用Primer Premier 5.0引物设计软件进行引物设计,送上海Invitrogen生物技术有限公司合成,序列如下:GP17E-1:5'-TATG TCCACGATTACACAATTCCCTTC-3',其中CCG为保护碱基,为EcoR I酶切序列;GP17H-2:5'TTC GCTGTAAACAAATCCGATTC-3',其中为保护碱基为Hind III酶切序列,上游引物上添加酶切位点EcoR I,下游引物上加酶切位点Hind III。培养LSB-1噬菌体,提取噬菌体DNA[5]为模板,构建PCR反应体系,扩增gp17基因。反应结束后,电泳检测并回收。
1.2.2 目的基因的克隆、转化及鉴定 PCR扩增产物和质粒pET300经过琼脂糖凝胶电泳后,分别回收目的片段并纯化。取纯化后的PCR产物和pET300质粒分别经过EcoR I、Hind III酶切后,进行连接反应取纯化后的PCR产物和pET300质粒进行连接反应。连接完成后,取6 μL连接产物转化感受态细胞BL21,用含有氨苄的琼脂平板筛选,37℃孵育18 h,挑取平板上的菌落增菌后提取质粒,酶切后送上海生工生物工程公司进行测序鉴定目的序列。
1.2.3 噬菌体目的基因gp17的纯化表达 ①重组细菌的诱导表达和纯化:将测序正确的重组工程菌接种于含有氨苄青霉素的LB培养基中,37℃振摇培养至A600nm值约为0.6时加入IPTG使终浓度为0.5 mmol/L诱导表达10 h,离心,收集诱导表达的重组细菌沉淀与裂解液按1 g∶20 mL的比例混合,在冰浴中超声破菌。离心分别收集上清和沉淀,进行SDS-PAGE电泳鉴定目的蛋白表达形式。随后对目的蛋白依次采用Ni柱、SuperdexG200、SUMO 酶去除 pET300、Ni柱、G25 脱盐、DEAE、G75精制最终得到6xhis-gp17目的蛋白,并在纯化过程中各步留样作SDS-PAGE电泳分析。将纯化后的目的蛋白浓缩冻干,取冻干产物,用0.01 mol/L的PBS溶解。用BCA法测定蛋白浓度后,分装并置于-20℃保存备用;②重组蛋白活性抑菌谱观察:采用扩散试验法[6],取培养好的待测细菌1 mL,平铺在倒好琼脂的平板上,吸去多余菌液,待干燥后在平板放上高压灭菌试纸片,分别滴加5 μL的目标蛋白,阴性对照加入PBS缓冲液,置于37℃孵箱培养观察效果。
1.2.4 重组噬菌体 T7-LSB-gp17的构建 ①目的基因与载体的连接及噬菌体的组装:从测序正确的重组细菌中提取载体质粒,酶切提取gp17基因纯化片段,将载体纯化片段、LSB-1噬菌体gp17基因纯化片段和T4连接酶进行构建连接反应体系,16℃过夜连接。然后取5 μL连接产物加入到25 μL T7 packaging extracts中,室温连接 2 h,加入270 μL LB培养基终止反应。重组后的噬菌体基因经壳蛋白提取物包装后感染黏液肠埃希BLT5403,挑取单个噬菌斑,用液体培养法大量扩增;②重组噬菌体的纯化:将培养好的重组噬菌体0.1 mL与BLT5403菌用双层琼脂法铺板,4 h后从双层琼脂培养板上挑取透明、直径大的单个噬菌斑,放入20 mL BLT5403菌液中,37℃恒温振荡培养过夜。重复此步骤3次或以上,最后使观察到的噬菌斑的大小和形态均匀一致,即得到了纯化的重组噬菌体。将重组噬菌体原液与甘油(分析纯)以4∶1比例混合后注入1.5 mL灭菌EP管中,放于-70℃冰箱长期保存;③重组噬菌体的鉴定:提取重组噬菌体DNA,并用试剂盒自带引物进行扩增,连接到质粒、转化、质粒抽提后进行测序及序列验证。同时对宿主细菌、T7噬菌体以及T7-LSB-gp17重组噬菌体进行SDS-PAGE电泳,观察重组噬菌体目的蛋白表达情况;④重组噬菌体活性观察:a.双层琼脂法:取适当稀释的重组噬菌体0.1 mL分别与细菌悬液0.2 mL混合,采用双层琼脂培养法铺板,37℃恒温培养箱内培养4~8 h,观察噬菌斑生长状况,确定重组噬菌体的噬菌谱;b.单层琼脂点滴法:取培养好的待测细菌增菌液1 mL在单层琼脂板上铺板,小心吸去多余菌液,待菌液干燥后用枪头滴5 μL重组噬菌体新鲜培养液,于37℃培养,观察作用效果。
2 结果与分析
2.1 目的基因的提取、克隆与载体的构建
LSB-1噬菌体基因组全长约23 kb(图1A),目的基因gp17长度约2000 bp(图1B),经测序后具体长度确定为2139 bp。与前期试验测序的结果一致。将目的片段经PCR扩增后,与质粒连接并导入感受态细菌,培养、提取质粒并对目的基因进行测序,结果见图1C显示序列正确。
2.2 噬菌体目的基因gp17的纯化表达
2.2.1 重组细菌的表达 对重组细菌加IPTG诱导培养,离心收集菌体,加入裂解液超声裂解,离心,分别用没加IPTG的对照、上清、沉淀和全菌裂解液进行SDS-PAGE电泳分析。由图2可见,重组细菌在100 ku(因含有pET300)处有高表达,结果与理论相符,说明重组细菌成功表达了目的蛋白。没有加入IPTG诱导培养的产量很低,而加入IPTG诱导培养的重组细菌无论是全菌液还是上清液都有很高的表达,同时加入IPTG诱导培养的细菌破菌液沉淀物的目标蛋白含量很低,说明IPTG成功诱导目标蛋白表达且是可溶性蛋白。
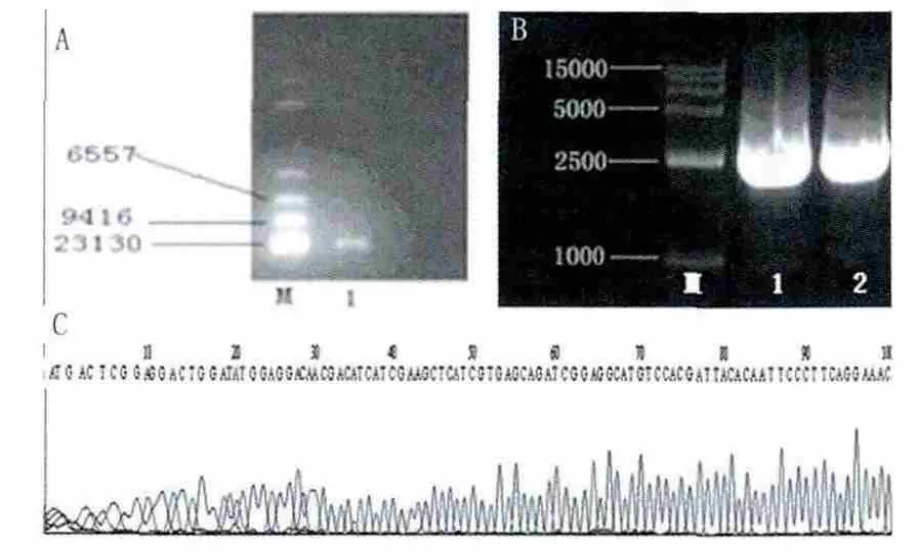
图1 目的基因gp17的克隆和表达载体的构建Fig.1 gp17 gene cloning and expression rector construction

图2 重组菌蛋白电泳Fig.2 SDS-PAGE electrophoresis of recombinant protein
2.2.2 目的蛋白的亲和层析纯化 由于目的蛋白主要以可溶形式存在,故收集超声破菌液的上清进行下一步的提纯分析。首先用Ni柱纯化以及G200进一步纯化,将上述收集的洗脱液进行SUMO蛋白酶酶切后进行SDS-PAGE蛋白电泳,得到单独的GP17条带(含6×his标签)(图3),然后再经过Ni柱纯化、G25脱盐、DEAE、G75精制得到最终的蛋白样品。将得到的最终蛋白样品溶解在 PBS缓冲液中(经 BCA法测定浓度为2.38 mg/mL),-20℃保存。
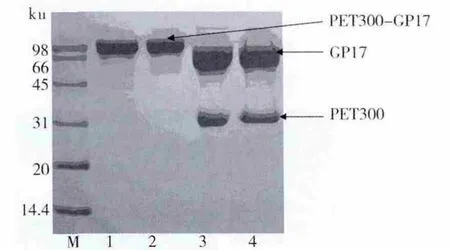
图3 SUMO蛋白酶酶切pET300-gp17电泳图Fig.3 SDS-PAGE electrophoresis of PET300-gp17 after digested by SUMO
2.2.3 GP17的抑菌谱测定 将分离得到的纯化目的蛋白分别对不同的细菌采用纸片法进行抑菌谱测定。结果显示,在所测的细菌中,目的蛋白仅对EIEC8401,即原噬菌体的宿主菌有很好的抑菌效力,对其他细菌无效(图4)。
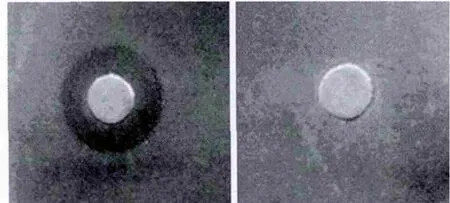
图4 gp17目标蛋白对EIEC8401的作用效果Fig.4 Result of target protein to EIEC8401
2.3 重组噬菌体T7-LSB-gp17的构建与效应比较
2.3.1 重组噬菌体 T7-LSB-gp17的构建 重组后的噬菌体在约78 ku处有1条明显比重组前的T7噬菌体表达增加的条带 (图5),分析原因为实验插入的2139 bp的核酸序列翻译成713个氨基酸,其分子量约为78 ku,增强了此处的蛋白表达,进一步证实T7-LSB-gp17重组噬菌体构建成功。
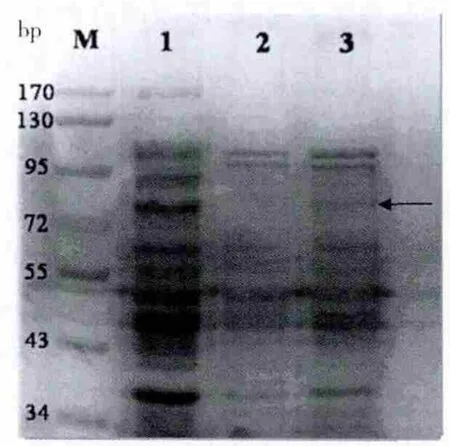
图5 噬菌体重组前后电泳图Fig.5 Protein expression of phage T7-LSB-1 and phage T7
2.3.2 两组重组产物抗菌效应的比较 采用双层琼脂法对重组噬菌体对EIEC8401等细菌的噬菌效果进行鉴定,发现重组噬菌体T7-LSB-gp17只能在BLT5403细菌形成噬菌斑 (图6(+)、图7(-)),说明重组后的噬菌体只能在BLT5403体内进行增殖。采用单层琼脂法检测T7-LSB-gp17重组噬菌体对 BLT5403、E.coli 8401、类炭疽芽胞杆菌繁殖体 (结果见图8)、金黄色葡萄球菌 (结果见图9)等细菌的作用效果,结果发现重组噬菌体T7-LSB-gp17对测试细菌均有良好的溶菌效应 (表1)。

图6 双层琼脂法观察重组噬菌体T7-LSB-gp17对BLT5403的噬菌作用Fig.6 Phagocytosis of T7-LSB-gp17 to BLT5403 by double layer agar method

表1 T7噬菌体、LSB-1噬菌体、T7-LSB-gp17重组噬菌体和重组蛋白对几种细菌的效应对比Table 1 Comparison of the bacteriolysis of phage T7,LSB-1,T7-LSB-gp17 and recombinant protein to different bacteria

图7 双层琼脂法观察重组噬菌体T7-LSB-gp17对EIEC8401噬菌作用Fig.7 Phagocytosis of T7-LSB-gp17 to EIEC8401 by double layer agar method

图8 噬菌体重组前后对类炭疽芽胞杆菌繁殖体溶菌作用对比Fig.8 Comparison of the Bacteriolysis with phage T7-LSB-gp17 and phage T7 to Bacillus cereus propagules
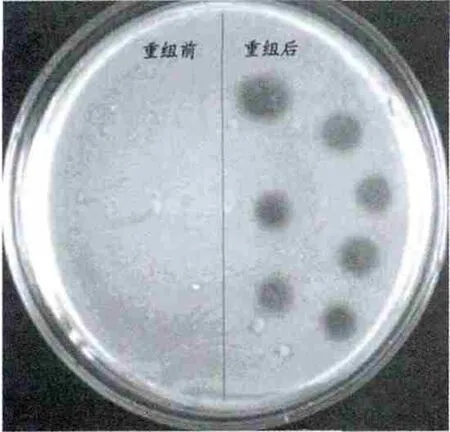
图9 噬菌体重组前后对金黄色葡萄球菌溶菌作用对比Fig.9 Comparison of the Bacteriolysis with phage T7-LSB-gp17 and phage T7 to Staphylococcus aureus
3 讨论
为了获得特定功能的目标蛋白,采用的方式有原核表达和真核表达2种,原核表达因能够在较短时间内获得基因表达产物,而且所需的成本相对比较低廉常被采用。原核表达通过基因重组技术,将外源目的基因通过构建表达载体并导入表达菌株,使其在特定原核生物表达。本研究就通过重组技术,得到纯化的可溶性的LSB-1内溶素酶,抑菌谱试验发现对宿主菌EIEC8401有良好的专一抑菌效果,与其他一些研究结果相似[7]。
噬菌体展示技术[8]是近年建立和发展起来的利用噬菌体表达外源基因的一项分子生物学研究领域的新技术,是将目的基因片段克隆入噬菌体外壳蛋白结构基因的适当位置,在阅读框正确且不影响其他外壳蛋白正常功能的情况下,使外源蛋白与外壳蛋白融合表达,融合蛋白随子代噬菌体的重新组装而展示在噬菌体表面,能高效地将外源基因编码的肽段以融合蛋白的形式展示在其外壳上。研究中采用该方法将噬菌体LSB-1内溶素基因gp17重组在T7噬菌体获得T7-LSB-gp17重组噬菌体,并将其作用于细菌,发现具有良好的溶菌活性,有效细菌种类范围较LSB-1噬菌体和纯化蛋白明显增加。
通过试验对比,发现将gp17基因采用不同方法的重组表达和噬菌体展示,得到产物的有效细菌的种类却有明显的差别。通过分析,可能有如下原因:①本实验中表达的噬菌体内溶素gp17基因蛋白,作用底物为多聚唾液酸,因其显示内切活性,故又称为内切唾液酸酶,能够降解以α-2,8连接的多聚唾液酸产物。EIEC8401含有以 α-2,8连接多聚唾液酸构成的多糖荚膜而被重组蛋白所抑制,而其他细菌没有或者连接方法不同因而不能有效作用。因此,酶作用位点的特异性就导致了酶的高度专一性。此外,内溶素是在噬菌体复制末期裂解细菌以释放子代噬菌体时合成,从细菌内部作用于细胞壁,而重组纯化得到的噬菌体内溶素则是由外向内作用而导致不能作用于适当的位置;②重组噬菌体上gp17蛋白因为噬菌体载体的缘故使得gp17蛋白较纯化的重组蛋白空间构象发生改变而使活性增强;③由于外源蛋白的插入,使T7噬菌体溶菌相关蛋白发生空间构象改变,T7噬菌体溶菌酶活性增强使得重组噬菌体的溶菌种类增加;也可能是上述两者相互作用的共同结果。
近年来,随着耐药菌的广泛出现,寻找新的抗生素的研究已经迫在眉睫,而噬菌体裂解细菌的酶类作为一个新的研究方向已引起了许多学者的关注,目前已有众多研究者[9-10]利用该方法获得纯化的噬菌体酶作为抗菌药物做了大量相关研究。本研究中采用了2种不同的方法对噬菌体LSB-1内溶素基因gp17的功能进行了分析,通过实验一方面得到了纯化的内溶素蛋白和重组噬菌体T7-LSB-gp17,另一方面验证了噬菌体LSB-1基因的功能,其以后可作为抗菌药物研究的一个方向。但是,2种不同的表达方法得到产物作用于细菌的差异结果的原因还需要进一步探索。
[1]Shen Y,T Koller,B Kreikemeyer,et al.Rapid degradation of Streptococcus pyogenes biofilms by PlyC,a bacteriophage-encoded endolysin[J].J Antimicrob Chemother,2013,68(8):1818-1824.
[2]Roach D R,P A Khatibi,K M Bischoff,et al.Bacteriophageencoded lytic enzymes control growth of contaminating Lactobacillus found in fuel ethanol fermentations[J].Biotechnol Biofuels,2013,6(1):20.
[3]Mishra A K,M Rawat,K N Viswas,et al.Expression and lytic efficacy assessment of the Staphylococcus aureus phage SA4 lysin gene[J].J Vet Sci,2013,14(1):37-43.
[4]Chai Y,H Xiong,X Ma,et al.Molecular characterization,structural analysis and determination of host range of a novel bacteriophage LSB-1 [J].Virol J,2010,(7):255.
[5]O'Flaherty S,A Coffey,R Edwards,et al.Genome of staphylococcal phage K:a new lineage of Myoviridae infecting grampositive bacteria with a low G+C content[J].J Bacteriol,2004,186(9):2862-2871.
[6]Bauer A W,W M Kirby,J C Sherris,et al.Antibiotic susceptibility testing by a standardized single disk method[J].Tech Bull Regist Med Technol,1966,36(3):49-52.
[7]贾鸣,胡晓梅,孙卫忠,等.铜绿假单胞菌噬菌体PaP3多糖解聚酶基因的克隆表达及生物学活性[J].第四军医大学学报,2008,29(2):123-126.
[8]刘倩,赵玉军.噬菌体展示技术研究进展[J].微生物学杂志,2007,27(6):96-99.
[9]Uchiyama J,I Takemura,I Hayashi,et al.Characterization of lytic enzyme open reading frame 9(ORF9)derived from Enterococcus faecalis bacteriophage phiEF24C[J].Appl Environ Microbiol,2011,77(2):580-585.
[10]Zhang H,H Bao,C Billington,et al.Isolation and lytic activity of the Listeria bacteriophage endolysin LysZ5 against Listeria monocytogenes in soya milk[J].Food Microbiol,2012,31(1):133-136.
