夏氏疟原虫感染过程中调节性B细胞的表达变化
2014-10-25祁赞梅张娅琳赵国明曹雅明
祁赞梅,杨 冀,韩 雪,张娅琳,赵国明,曹雅明
(中国医科大学基础医学院免疫学教研室,辽宁 沈阳 110001)
疟疾是严重威胁人类健康的寄生原虫感染性疾病[1]。在疟原虫诱导的免疫应答中,前炎症反应与抗炎因素的平衡是清除寄生虫感染并避免产生病理反应的重要基础[2-3]。白细胞介素-10(interleukin-10,IL-10)是建立这种平衡过程中具有重要免疫调节作用的关键细胞因子[3]。大量临床研究显示,疟疾所导致的严重贫血与患者血浆中较低的IL-10水平有关,而高原虫血症及部分脑疟患者具有较高的血浆IL-10水平[4-8]。因此,IL-10水平异常与疟疾临床表现密切相关,了解疟疾免疫应答过程中IL-10的产生及调节机制对于研究疟疾免疫应答调控以及预防和治疗临床并发症具有重要意义。2002年Bhan及其同事[9]首次证实产生IL-10的B细胞能够抑制炎症反应,并将其称为调节性 B细胞(regulatory T cells,Bregs)。Bregs的关键特性是产生IL-10,尚未发现Bregs独有的表面分子或标志性转录因子,其分化来源和机制也未阐明[10]。Bregs的主要生物学作用包括,通过与T细胞的同源相互作用和释放IL-10抑制Th1和Th17介导的炎症反应[10-11];参与维持Tregs的数量和功能[11];分化为产生抗体的浆细胞[12]。Bregs的上述生物学作用使其在自身免疫性疾病、移植、肿瘤和部分感染性疾病中的作用逐渐受到重视,但目前对Bregs在疟疾免疫应答中的作用尚缺少了解。本研究利用P.c AS感染的小鼠模型,观察了疟疾免疫应答过程中Bregs数量变化和表型特点,以期探讨Bregs在疟疾免疫调节中的作用地位。
1 材料与方法
1.1 材料
1.1.1 实验动物及疟原虫感染模型 6~8周龄、雌性BALB/c小鼠(购自北京华阜康生物科技股份有限公司)经腹腔感染1×106P.c As寄生的红细胞(Parasitized Red Blood Cell,pRBC),感染不同时间的小鼠经尾静脉采血,制备薄血膜,Giemsa染色,镜检计数红细胞感染率。
1.1.2 主要仪器及试剂 流式细胞仪(FACS Calibur,BI);CD16/32 封闭抗体(93 克隆)、抗CDld-FITC单抗(1B1克隆)、抗 IL-10-PE单抗(JES5-16E3克隆)、抗CD19-PE/cy5单抗(6D5克隆)、抗 CD5-APC 单抗(53-7.3克隆)、抗 CD4-APC单抗(GK1.5克隆)及其相关荧光标记同种型对照购于Biolegend公司;固定透膜液(Fixation and Permeabilization Solution)购于BD公司。
1.2 方法
1.2.1 实时定量 RT-PCR 在感染后第0、3、5、8天处死小鼠,取少量脾组织,使用Trizol试剂提取总RNA,按PrimeScript RT Reagent Kit说明书进行逆转录。取100 ng RNA的逆转录产物,按SYBR Premix Ex Ta试剂盒说明书配制20 μL PCR体系,于Corbett Rotor-Gene 6000(Corbett Life Science,Australia)实时定量PCR仪中进行扩增。热循环过程:95℃预变性30 s;95℃ 5 s,60℃ 30 s,45个循环。使用核糖体 S17蛋白(RPS17)作为内参,利用两倍系列稀释样品制作标准曲线。使用的特异性引物序列如下:RPS17 F:5'-TGTCGGGATCCACCTCAATG-3';RPS17R:5'-CGCCATTATCCCCAGCAAG-3';IFN-γ F:5'-AAAGACAATCAGGCCATCAG-3';IFN-γ R:5'-TGGGTTGTTGACCTCAAACT-3';IL-10F:5'-CAGTACAGCCGGGAAGACA-3';IL-10 R:5'-GCATTAAGGAGTCGGTTAGCA-3'。
1.2.2 流式细胞仪检测 感染后第0、3、5、8天取小鼠脾脏,常规方法制备脾细胞悬液,用0.17 mol/L NH4Cl裂解红细胞。脾细胞在添加PMA(50 ng/mL)、LPS(10 μg/mL)、Ionomycin(1 μg/mL)及 Monensin(20 μmol/L)的含 10%胎牛血清 (FCS)的RPMII 1640刺激培养5 h。取1×106脾细胞,用含2%BSA的PBS洗涤后,加入FcR III/II封闭20 min,然后加入特异性荧光抗体或相应同种型对照抗体进行多重表面染色。在表面染色后,固定透膜,加入抗IL-10单抗进行细胞内细胞因子染色。用固定透膜液充分洗涤后,重悬于0.5 mL 1%多聚甲醛中。流式细胞仪进行检测,使用WINMID2.9软件进行数据分析。
1.2.3 统计学分析 应用SPSS 11.5统计学分析软件,t检验比较分析组内和组间均值的显著性差异。P﹤0.05为差异显著。
2 结果与分析
2.1 P.c AS感染后小鼠红细胞感染率和脾细胞因子 IL-10、IFN-γmRNA 水平变化
P.c AS感染小鼠于感染后第5天在外周血中出现疟原虫感染的红细胞,随后,原虫血症水平持续升高,于感染后第9天达到30%左右,并出现大量死亡,在感染后第10天全部死亡;脾组织细胞因子IL-10 mRNA水平在感染后第3天明显升高,在感染后第5天达到高峰,此后缓慢下降,感染后第8天仍为未感染小鼠的10倍左右。IFN-γ mRNA水平在感染后3~5 d有小幅上升,约为未感染小鼠的5倍左右,感染后第8天恢复到正常水平。

图1 BALB/c小鼠感染P.c AS后的原虫血症水平(A)和脾细胞因子IL-10、IFN-γ mRNA水平(B)变化Fig.1 The changes of parasitaemia(A)and the splenic mRNA levels of IL-10、IFN-γ(B)of BALB/c mice infected with P.c AS
2.2 P.c AS 感染后脾细胞中 CD19+IL-10+、CD4+IL-10+细胞百分比和绝对数量比较
P.c AS感染后第3天,脾中CD19+细胞和CD4+细胞中IL-10+细胞百分比均出现有意义的升高。CD4+细胞中IL-10+细胞百分比在感染后第5天达到高峰,约占CD4+细胞的15%,感染后第8天回落至正常水平附近;CD19+细胞中IL-10+细胞百分比在感染后持续上升,至感染后第8天达到5%左右,未见回落趋势。CD19+IL-10+、CD4+IL-10+细胞绝对数量变化趋势与百分比变化趋势相似,感染后第5天内CD4+IL-10+细胞绝对数量高于CD19+IL-10+细胞数量,但感染后第8天,CD19+IL-10+细胞数量达到CD4+IL-10+细胞数的5倍左右。
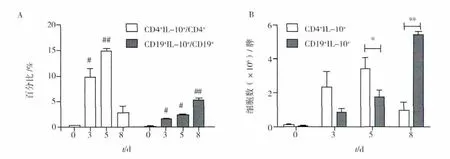
图2 BALB/c小鼠感染P.c AS后脾内CD4+和CD19+细胞中IL-10+细胞百分比变化(A)和绝对数量比较(B)Fig.2 The changes of the persentage of IL-10+cells in the splenic CD4+and CD19+cells and(A)the comparasion of their absolute numbers(B)in P.c AS-infected BALB/c mice
2.3 CD19+IL-10+Bregs表型分析
P.c AS感染后第8天,脾细胞中IL-10+细胞约占脾细胞总数的2%,其中80%以上为CD4-CD19loBregs细胞。对CD19loIL-10+Breg表面CD5和CD1d的分析显示,约90%的CD19loIL-10+Bregs为CD5-细胞,其中一半以上为CD1d+细胞。

图3 P.c AS感染后第8天BALB/c小鼠脾内IL-10+细胞表面分子的表达分析Fig.3 The expression of surface molecules on IL-10+cells in the spleen from BALB/c mice at day 8 post P.c AS infection
3 讨论
由于IL-10来源复杂,作用多样,目前对IL-10在疟疾免疫应答中的活化及其调节机制知之甚少。能够产生IL-10的CD4+CD25+调节性T细胞(regulatory T cells,Tregs)曾被认为在疟疾免疫调节中扮演关键角色,但研究显示,Tregs只能部分地抑制保护性Th1应答,并且在抑制免疫病理损伤方面的作用有限[13-14]。另有研究显示,约氏疟原虫感染的小鼠模型中,IL-10在Tregs的免疫调节功能中并不起主要作用[15]。
本研究显示,P.c AS感染后脾组织 IL-10 mRNA水平随原虫血症的升高而不断上升,在感染初期的0~5 d内,T细胞是IL-10的主要来源,但其后,CD19+B细胞取代T细胞成为主要的IL-10产生细胞。在约氏疟原虫感染的小鼠中也观察到类似的结果。由此可知,Bregs在鼠疟模型中大量活化,是感染中后期IL-10的主要来源,但是此前Bregs的作用一直没有得到足够认识。Bao等[16]在反复药物治愈的对脑疟有抵抗作用的小鼠中发现,感染后第7天,血浆IL-10水平显著高于对照组,显著增高的IL-10+淋巴细胞亚群是CD19+细胞,被动转移脾CD19+B细胞可保护小鼠不发生脑疟。Liu等[17]的研究也显示过继转移Bregs而非Tregs对脑疟的发生有抑制作用。这些结果都显示,Bregs在疟疾免疫应答过程中可能发挥重要免疫调节作用。
目前研究较多的小鼠脾中Bregs为B10细胞,其较为公认的表型为 CD19+CD5+CD1dhi[9]。虽然有研究显示伯氏疟原虫感染过程中有B10细胞的扩增[17],但 Bao 等[16]的研究显示反复药物治愈的伯氏疟原虫感染小鼠中,高水平血浆IL-10的主要来源是CD5-CD19+细胞。本研究也显示,夏氏疟原虫感染后第8天脾中分泌IL-10细胞主要为CD5-Bregs。这些结果提示,疟疾模型中Bregs的表型和功能具有特殊性,有必要进行更深入研究。
[1]World Health Organiztion.World Malaria Report 2012.http://www.who.int/malaria/publications/world_malaria_report_2012/en/index.html
[2]Taylor-Robinson AW,Phillips RS,Severn A,et al.The role of TH1 and TH2 cells in a rodent malaria infection[J].Science,1993,260(5116):1931-1934.
[3]Freitas do Rosario AP,Langhorne J.T cell-derived IL-10 and its impact on the regulation of host responses during malaria[J].Int J Parasitol,2012,42(6):549-555.
[4]Rovira-Vallbona E,Moncunill G,Bassat Q,et al.Low antibodies against Plasmodium falciparum and imbalanced pro-inflammatory cytokines are associated with severe malaria in Mozambican children:a case-control study[J].Malar J,2012,11:181.
[5]Boeuf PS,Loizon S,Awandare GA,et al.Insights into deregulated TNF and IL-10 production in malaria:implications for understanding severe malarial anaemia[J].Malar J,2012,11(1):253.
[6]Noone C,Parkinson M,Dowling DJ,et al.Plasma cytokines,chemokines and cellular immune responses in pre-school Nigerian children infected with Plasmodium falciparum[J].Malar J,2013,12(1):5.
[7]Zhang G,Manaca MN,McNamara-Smith M,et al.Interleukin-10(IL-10)polymorphisms are associated with IL-10 production and clinical malaria in young children[J].Infect Immun,2012,80(7):2316-2322.
[8]Thuma PE,van Dijk J,Bucala R,et al.Distinct clinical and immunologic profiles in severe malarial anemia and cerebral malaria in Zambia[J].J Infect Dis,2011,203(2):211-219.
[9]Mizoguchi A,Mizoguchi E,Takedatsu H,et al.Chronic intestinal inflammatory condition generates IL-10-producing regulatory B cell subset characterized by CD1d upregulation[J].Immunity,2002,16(2):219-230.
[10]Mauri C,Bosma A.Immune regulatory function of B cells[J].Annu Rev Immunol,2012,30:221-241.
[11]Yoshizaki A,Miyagaki T,DiLillo DJ,et al.Regulatory B cells control T-cell autoimmunity through IL-21-dependent cognate interactions[J].Nature,2012,491(7423):264-268.
[12]Maseda D,Smith SH,DiLillo DJ,et al.Regulatory B10 cells differentiate into antibody-secreting cells after transient IL-10 production in vivo[J].Immunol,2012,188(3):1036-1048.
[13]Hansen DS,Schofield L.Natural regulatory T cells in malaria:host or parasite allies[J].PLoS Pathog,2010,6(4):e1000771.
[14]Steeg C,Adler G,Sparwasser T,et al.Limited role of CD4+Foxp3+regulatory T cells in the control of experimental cerebral malaria[J].Immunol,2009,183(11):7014-7022 .
[15]Abel S,Lückheide N,Westendorf AM,et al.Strong impact of CD4+Foxp3+regulatory T cells and limited effect of T cell-derived IL-10 on pathogen clearance during Plasmodium yoelii infection[J].Immunol,2012,188(11):5467-5477.
[16]Bao LQ,Huy NT,Kikuchi M,et al.CD19(+)B cells confer protection against experimental cerebral malaria in semi-immune rodent model[J].PLoS One,2013,8(5):e64836.
[17]Liu Y,Chen Y,Li Z,et al.Role of IL-10-producing regulatory B cells in control of cerebral malaria in Plasmodium berghei infected mice[J].Eur J Immunol,2013,43(11):2907-2918.
