二氢杨梅素注射剂的处方筛选及抑菌活性研究
2014-10-23王楠楠郁建平
王楠楠,郁建平
(贵州大学 药学院,贵州 贵阳550025)
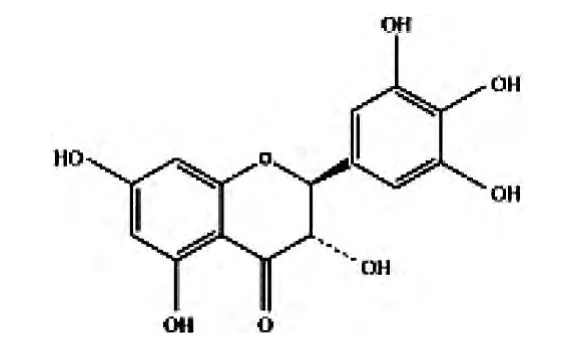
二氢杨梅素[(2R,3R)-3,5,7-三羟基 -2-(3,4,5-三羟基苯基)苯并二氢吡喃-4-酮,Dihydromyricetin,DMY]是多酚羟基双氢黄酮醇,属黄酮类化合物,是食品新资源—藤茶中的主要活性成分[1],二氢杨梅素的结构式如下:
随着现代农业产业化的扩大,农畜的抗生素类和激素类添加剂的用量不断加大。这些药物在增强农畜自身生产性能和抵抗力的同时也带来了严重的负面效应:长期使用抗生素会导致其自身免疫力下降,病菌产生抗药性。因此,寻找新型的天然药物成为近年来研究的热点。二氢杨梅素具有天然性,低副作用且无抗药性[2-3],其独特的作用是代替抗生素和激素类药物的理想选择。药理研究表明,DMY能对抗去肾上腺素和高K+所致的兔胸主动脉条的收缩反应及显著扩血管和钙阻滞作用[4],具有消炎、抑菌[5-8]、止咳、镇痛、消脂及抗脂质过氧化等功效[9-10],因此,DMY具有广泛的应用前景。
二氢杨梅素水溶液极不稳定[11],极易被多种氧化剂氧化及发生自身的氧化而转化为无活性的物质。此外,溶液的pH对产品稳定性也至关重要。为更快速、有效的发挥DMY的药理作用,试验以吐温-80为助溶剂,加入适量的抗氧化剂并调节适宜的pH来保证产品的稳定性,成功地筛选出了二氢杨梅素注射剂处方,以便加快二氢杨梅素在畜牧业中的推广应用。
1 材料与方法
1.1 材料
1.1.1 供试材料 二氢杨梅素为实验室自制,经HPLC分析纯度为90%;二氢杨梅素标准品(上海源叶生物科技有限公司)。
1.1.2 仪器与试剂 高效液相色谱分析仪(美国VARIAN公司),303—5电子秤(上海精科实业有限公司),pH计(上海天达仪器有限公司),恒温水浴锅(上海亚荣生化仪器厂),TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限公司),抗坏血酸(国药集团化学试剂有限公司,),亚硫酸氢钠(天津恒兴化学试剂制造有限公司),焦亚硫酸钠(天津恒兴化学试剂制造有限公司),吐温-80(天津科密欧化学试剂有限公司)为分析纯,甲醇(北京北化化学品有限责任公司)、磷酸(深圳市恒迪源润达实业有限公司)为色谱纯。
1.2 方法
1.2.1 标准曲线的绘制 准确称取二氢杨梅素标准品3.8 mg,置50 mL容量瓶中,加甲醇溶解并定容至刻度,摇匀。分别吸取0 mL,2 mL,4 mL,6 mL,8 mL,10 mL标准品溶液,置于六个10 mL容量瓶中,分别加甲醇至10mL,摇匀,用0.45μm滤器过滤即配得浓度分别为0μg/mL、15.2μg/mL、30.4 μg/mL、45.6μg/mL、60.8μg/mL、76μg/mL的标准品溶液。将配置好的各浓度梯度的标准样品溶液分别进样.测定峰面积,以峰面积(y)为纵坐标,以对应的二氢杨梅素的质量(x)为横坐标,绘制标准曲线,建立回归方程。结果见图1。
1.2.2 助溶剂用量的选择 分别秤取0.18 g二氢杨梅素于5个100 mL容量瓶中,用蒸馏水定容至刻度,于60℃温水中加热10 min,分别加入0 mL、0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL吐温 -80,继续加热20 min,密封,于4℃暗处放置24 h。将溶解有DMY的6支容量瓶置于遮光板边缘处,分别在黑色和白色背景下,手持供试品颈部轻轻旋转和翻转容器使药液中可能存在的可见异物悬浮(但应避免产生气泡),轻轻翻摇后即用目检视,重复3次检查澄明度。分别从各个容量瓶中量取溶液0.15 mL置于10 mL容量瓶中,用甲醇定容至刻度,在290 nm的波长处测定紫外吸光度,测定结果见表3。
1.2.3 pH的选择 分别取0.18 g二氢杨梅素于5个100 mL容量瓶中,加入0.4 mL吐温-80使其溶解,分别调节pH为1.5、2.5、3.5、4.5、5.5,密封,于暗处放置7天,用高效液相色谱分别测其含量。所得结果见表4。
1.2.4 抗氧剂的选择 拟选择抗坏血酸、亚硫酸氢钠、焦亚硫酸钠为抗氧剂,如表5所示,设计四个处方,分别配置成100 mL澄清溶液,密封,于4℃暗处放置10天,高效液相测其DMY含量。
1.2.5 体外抑菌试验[12]
(1)药敏试验:分别取二氢杨梅素(90%)1.4 g、1.6 g、1.8 g,用100 mL 75%乙醇溶解,配成三种浓度的药液。将肠产毒型大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和沙门氏菌接种于普通琼脂培养基上,37℃培养24 h,挑取典型菌落接种于新鲜肉汤培养基中,37℃培养18 h,备用。分别取待测的各种细菌于普通肉汤培养基,用无菌棒均匀涂布于营养琼脂平板上,待干燥后用镊子夹住药敏纸片于琼脂表面,一个平皿贴3片含样品药液的滤纸片,呈正三角形。平皿中间贴一个用76%乙醇浸泡同样长时间的滤纸片,作为对照。每个平板做3个重复,于37℃培养24 h后用直尺测量抑菌圈直径。实验结果见表6。
(2)最低抑菌浓度(MIC)试验:取6支试管,于每一支试管内加入培养液2 mL(灭菌121℃,30 min)。吸取2 mL药液(二氢杨梅素浓度为8,0 g/L)到第1管内,充分混匀后吸出2 mL到第2管中,依次稀释到第6管。第6管充分混匀后吸出2 mL混合液丢弃。再向每一管内分别加菌悬液0.05 mL(菌液浓度106~107 cfu/mL)摇匀后细菌置37℃培养24 h取出观察。以能抑制细菌生长繁殖的药液最高稀释度为该药的最低抑菌浓度。实验结果见表7。
(3)最低杀菌浓度(MBC)试验:将上述稀释度在MIC以前(包括MIC)的各菌药混合管取0.1 mL脂平板上,用无菌玻璃刮铲涂抹均匀后,细菌于37℃培养24 h,取出观察结果,以仍没菌生长的最高药物稀释度为该药的最低杀菌浓度。实验结果见表8。
2 结果与分析
2.1 回归方程的建立
利用高效液相色谱仪(HPLC)对制备的注射剂进行含量测定[13]。色谱柱为ODSC18柱(150 mm×4.6 mm,5μm);柱温为室温;流动相为甲醇 -0.2%磷酸溶液25∶75;每次进样10μL,体积流量为1.0 mL/min;检测波长为290 nm[14-15]。保留时间t=14.942,在本实验色谱条件下,二氢杨梅素色谱峰峰形对称,无干扰。结果如图1所示。回归方程为:y=30.783x+7.057 1,R2=0.999 8,线性范围为0.015~0.08 mg。
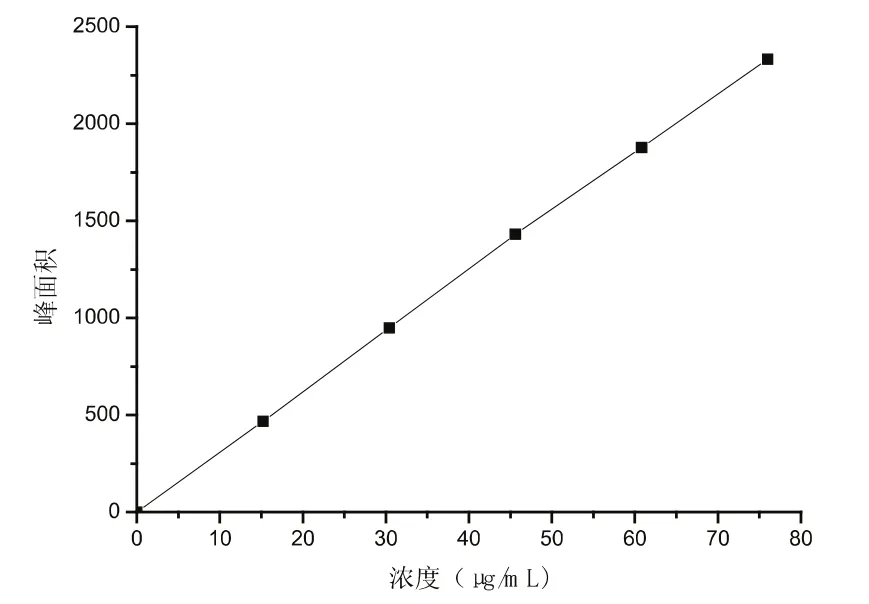
图1 二氢杨梅素标准曲线Fig.1 The standard curve of dihydromyricetin
2.2 精密度试验
配制60μg/mL浓度的标准品溶液重复进样6次,记录峰面积,结果见表1。
从实验结果得RSD=0.68%,说明方法精密度良好。

表1 精密度试验Tab.1 The precision experiment
2.3 稳定性试验
配制60μg/mL浓度的标准品溶液,每隔1 h时测1次,测5次,记录峰面积,结果见表2。
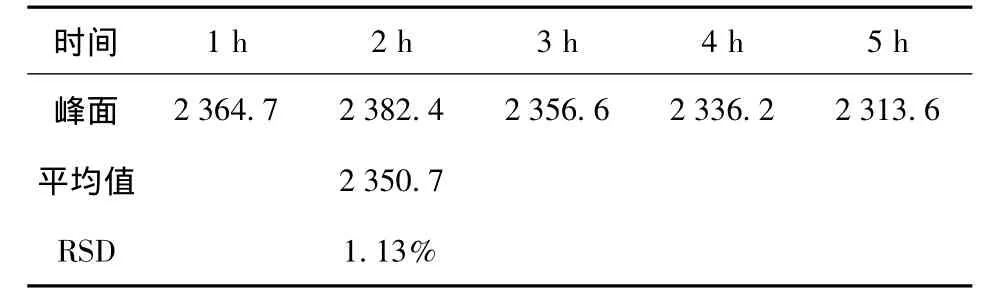
表2 稳定性试验Tab.2 The stability test
从实验结果得RSD=1.13%,该法稳定性良好。
2.4 助溶剂的用量选择
二氢杨梅素在不同浓度的吐温-80中的溶解情况如表3所示。
从表3可以看出,吐温-80用量在0.4 mL时的溶液澄清度最好且吸光度最大,说明溶解的DMY的量最多。因此对于DMY,吐温-80的浓度为4μL/mL时具有较好的助溶效果。
2.5 pH对制剂稳定性的影响
将放置7天后的不同pH的溶液经0.45μm滤器过滤后分别进样,分别测其峰面积,结果如表4所示。

表3 DMY在不同量的助溶剂中的溶解情况Tab.3 The dissolution of DMY in different amounts of cosolvent

表4 pH对DMY稳定性的影响Tab.4 The influence of p H on stability of DMY
由表4可知,溶液的pH为3.5时,峰面积最大,即DMY的含量最多,因此选择pH3.5作为最适pH。经回归方程计算得,pH=3.5时二氢杨梅素的含量为131.3 mg/100 mL,样品中二氢杨梅素含量约为90%,即有近20%的DMY在放置过程中氧化分解。
2.6 抗氧剂对制剂稳定性的影响
分别将放置10天的四个处方药液经0.45μm滤器过滤后进样,测其峰面积,实验结果如表5所示:
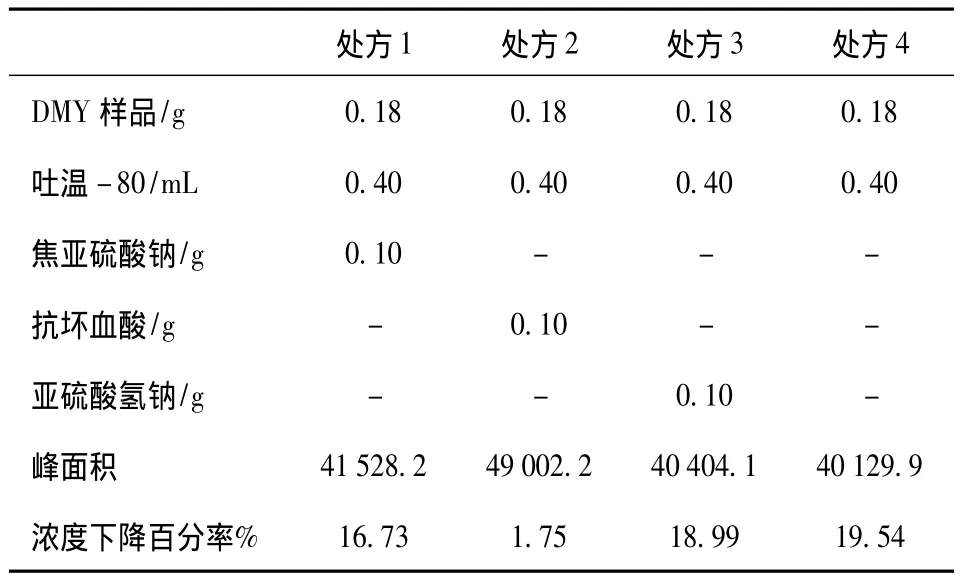
表5 抗氧剂对DMY稳定性的影响Tab.5 The influence of antioxidant on stability of DMY
由实验结果可知,处方2的峰面积最大,经回归方程计算得,二氢杨梅素含量为159.2 mg/100 mL,即在放置过程中仅有1.75%的二氢杨梅素发生氧化分解,抗坏血酸在该处方中的抗氧化活性十分显著。
2.7 DMY药敏试验
由表6可知,二氢杨梅素对上述细菌均有很好的抑制作用,体外抑菌效果明显,其中对大肠杆菌的抑菌效果最明显。
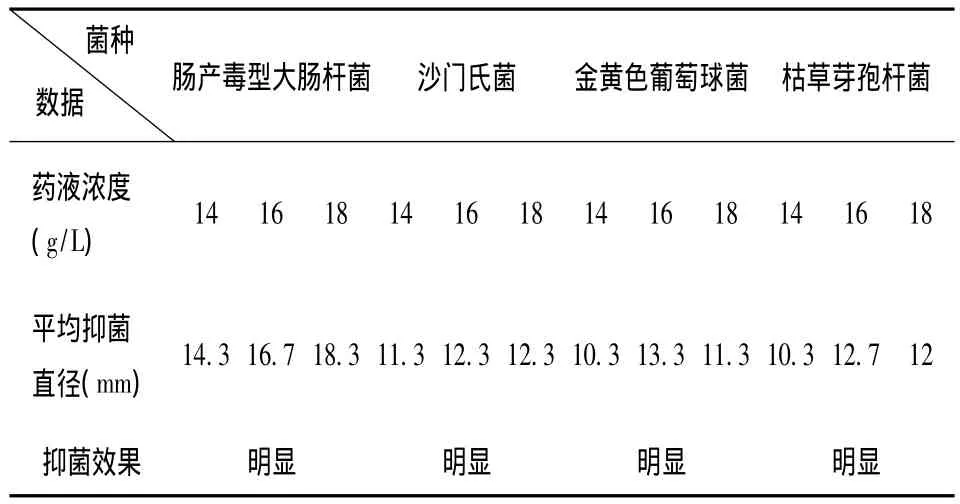
表6 DMY对供试菌种的抑制效果Tab.6 The inhibition effect of DMY on selecte d strains
2.8 DMY最低抑菌浓度
由表7可知,肠产毒性大肠杆菌的MIC值为:2.018 g/L,沙门氏菌和金葡菌的MIC值为1.01 g/L,枯草芽孢杆菌的MIC值为0.5044 g/L。

表7 DMY最低抑菌浓度Tab.7 The minimal inhibitory concentration of DMY
2.9 最低杀菌浓度
由实验数据可得:肠产毒性大肠杆菌和肠出血性大肠杆菌的最低杀菌浓度为4.034 g/L,沙门氏菌和金葡菌的为1.01 g/L,枯草芽孢杆菌的大于4.035 g/L。由表7和表8知,二氢杨梅素具有广谱抑菌、杀菌的效果,其最低抑菌浓度和最低杀菌浓度较低,这些指标显示了其作为注射剂的较好的应用前景。

表8 DMY最低杀菌浓度Tab.8 The minimal bactericidal concentration of DMY
2.10 最佳处方验证
精密称取二氢杨梅素1.8g,置1 000 mL容量瓶中,加800 mL蒸馏水,60℃水浴加热10 min后加入4 mL吐温-80和1 g抗坏血酸,继续热20 min使其溶解,加入0.5 g活性炭振摇30 min,用0.45 um微孔滤膜过滤,继续加蒸馏水至刻度,调节pH为3.5,于4摄氏度冰箱中保存30天,发现溶液色泽、澄清度等基本没有变化。注射剂中二氢杨梅素的含量为0.162 mg/mL。
3 讨论
二氢杨梅素作为藤茶中最主要的黄酮类物质,在诸多领域有着广泛的应用,但其作为抗菌注射剂的应用所见不多。本实验重在筛选二氢杨梅素注射剂的制备处方,考虑到二氢杨梅素的稳定性差又难溶于水,所以用乳化剂吐温-80作为助溶剂,以抗坏血酸作为抗氧化剂。实验结果证明两者合用效果很好,大大减少了DMY在放置过程中的损耗。该处方可作为家畜(如猪、牛等)和家禽(如鸡等)的抗菌注射剂,尤其对猪肠道致病菌有很好的抑制和杀灭作用。
[1]杨志坚,袁弟顺,陈凌华,等.藤茶中二氢杨梅素的研究概况[J].中国茶叶加工,2010,1:20-22.
[2]徐运杰,范志勇,方热军.二氢杨梅素在畜牧业应用中的研究[J].中国畜牧兽医,2007,34(17):22-24.
[3]李武昌,周俊萍,程 璇,等.二氢杨梅素在牧业中的研究进展与应用前景[J].中国畜禽种业,2009,9:143-145.
[4]周雪仙,周天达.二氢杨梅树皮素对兔胸主动脉条平滑肌收缩反应的影响[J].现代应用药学,1997,14(2):8-11.
[5]陈 帅,郁建平.藤茶总黄酮抗炎及抑菌作用的实验研究[J].贵阳中医学院学报,2013,15(1):40-42.
[6]薛 慧.恩施来凤藤茶微量元素的分析及其保健功能探讨[J].广东微量元素学,2004,11(8):56-58.
[7]张友胜,杨伟丽,熊皓平.显齿蛇葡萄基本成分研究[J].天然产物研究与开发,2001,13(5):46-48.
[8]熊皓平,何国庆,杨伟丽,等.显齿蛇葡萄生化成分分析[J].中国食品学报,2004,3:68-71.
[9]钟正贤,覃洁萍,周桂芬,等.广西瑶族藤茶中双氢杨梅树皮素的药理研究[J].中国民族医药杂志,1998,4(3):42-44.
[10]何桂霞,杨伟丽,裴 刚,等.二氢杨梅素抗脂质过氧化作用的研究[J].中国中药杂志,2003,28(12):1 188-1 190.
[11]王丹,郁建平,刘 灏.藤茶二氢杨梅素抗氧化活性研究[J].山地农业生物学报,2013,32(3):243-246.
[12]严赞开,徐晓龄,梁明春.几种二氢杨梅素酯的抑菌试验[J].江苏农业科学,2010,4:313-314.
[13]杨明意,王立兴.高效液相色谱法测定健目胶囊中二氢杨梅素的含量[J]海峡药学,2009,21(8):35-37.
[14]朱 哲,杨悟新,强烈应,等.二氢杨梅素研究进展[J].武警医学院学报,2011,20(7):600-604.
[15]潘人琦,郁建平.二氢杨梅素解酒作用的研究[J].山地农业生物学报,2012,31(3):30.
