杜仲糖基转移酶基因EuCGT1克隆及序列分析
2014-10-23李永捷赵德刚
李永捷,董 旋,赵德刚,3*
(1.贵州大学生命科学学院山地植物资源保护与种质创新省部共建教育部重点实验室,贵州贵阳550025;2.贵州大学农业生物工程研究院贵州省农业生物工程重点实验室,贵州 贵阳550025;3.贵州大学绿色农药与农业生物工程国家重点实验室培养基地,贵州 贵阳550025)
杜仲(Eucommia ulmoides),是我国特有的一种名贵中药材。杜仲入药,在《神农本草经》和《本草纲目》中早有记载,主要用于治疗肾虚腰痛,筋骨乏力,胎动不安和高血压症。现代药物化学和药理学研究将杜仲的药用活性成分分为:木脂素类、环烯醚萜类、甾萜类、酚酸类、脂肪酸类、黄酮类和多种维生素及内酯类[1],其中研究最多、结构最清楚、成分最明确的当属杜仲木脂素类化合物。目前杜仲中分离、鉴定的木脂素有26个、倍半木脂素有2个,共计28个,其中16个为糖苷结构,如具有抗肿瘤作用的丁香脂素双糖苷、具有双向血压调节作用的松脂醇双糖苷等[2-3]。相关药理研究发现杜仲木脂素类化合物的糖苷结构尤为重要,如松脂醇双糖苷的母核松脂醇没有糖苷结构时不具备血压调节能力[4],而多种木脂素类化合物对cAMP磷酸二酯酶抑制活性的研究结果显示活性最高的是木脂素双糖苷,其次是单糖苷,部分木脂素苷元甚至不表现抑制活性[5]。
木脂素(Lignans)由两分子苯丙素类单体经氧化酶催化聚合而成,构成杜仲木脂素的苯丙素类单体主要是肉桂酸(Cinnamic acid)衍生物单体木质醇(Monolignols):松柏醇、芥子醇和对香豆醇。植物合成的苯丙氨酸经苯丙素生物合成途径(Phenylpropanoid biosynthesis)生成多种苯丙素类单体,木质醇除参与木脂素的合成之外更主要参与植物木质化矩阵构建合成木质素(Lignins),是组成植物次生细胞壁的主要成分[6],且研究发现细胞质内合成的单体木质醇更多是以其糖苷形式储存于液泡中[7]。
植物的糖基转移酶(Glucosyltransferase,GT,EC 2.4.x.y)是植物中一大类催化糖苷取代反应的酶,该类酶以UDP-Sugar为糖基供体,特异性识别糖基受体,催化特定位点的糖基化反应合成糖苷,是植物次生代谢重要的结构修饰酶之一[8]。糖苷化是天然药物的重要修饰反应,能够显著增强小分子药物的水溶性。目前,从药用植物中分离天然药物的糖基转移酶基因已成为新药合成与老药糖基化改造的重要研究方向之一[9]。本研究从杜仲转录组数据库筛选出一个糖基转移酶基因的片段,其注释信息为松柏醇糖基转移酶基因(Coniferin alcohol Glucosyl Transferase,CGT),使用SMART RACE技术从杜仲中克隆了该基因的cDNA序列,(Eucommia ulmoides Coniferin alcohol Glucosyl Transferase,EuCGT1)。将克隆获得的EuCGT1基因构建植物表达载体pSH-35S-EuCGT1,采用农杆菌介导法遗传转化普通烟草(Nicotiana tabacum L.)品种长脖黄,为研究该基因功能以及杜仲木质醇苷、木脂素糖苷的生物合成调控机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料
杜仲新生幼枝的树皮取自种植于本实验室植物试验示范基地的7月份杜仲雌株,置于液氮中备用。普通烟草(Nicotiana tabacum L.)种子由本实验室保存。
1.1.2 质粒及菌株
基因克隆初始载体pGEM-T Easy Vector Systems购自Promega公司,克隆菌株为大肠杆菌菌株DH5α由本实验室保存;植物表达初始载体pSH737和植物表达菌株根癌农杆菌菌株LBA 4404由本实验室保存。
1.2 方法
1.2.1 转录组序列筛选及引物合成
检索本实验室前期构建的杜仲转录组数据库,依据KEGG比对整合结果,筛选出注释信息为松柏醇糖基转移酶(CGT)编码基因的序列片段6条,使用SerialCloner Ver.2.6.1进行BLAST分析,最终选取长度为600bp的CL13624.Contig_4_All为模板设计RACE特异性引物(gene-specific primers,GSPs),RACE扩增后测序并拼接,依照拼接结果设计全长正向引物(CGT Forward,CGTF),配合嵌套式通用引物(Nested Universal Primer,NUP)对CGT全长进行扩增(所有引物见表1)。
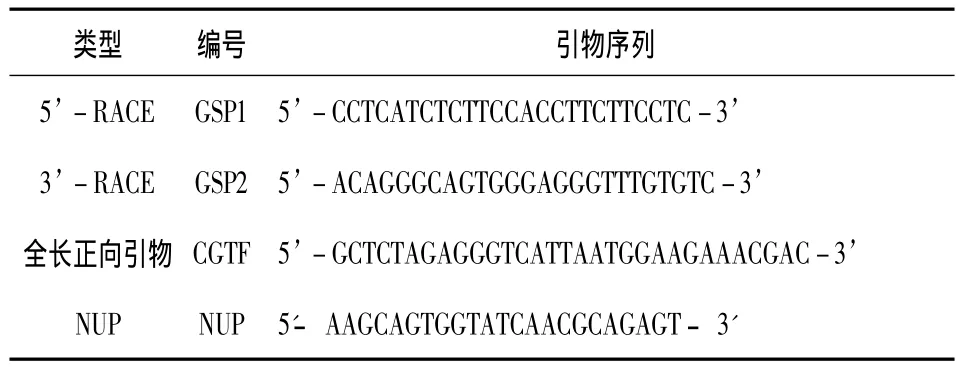
表1 PCR所用引物Tab.1 Primers used for full-length cloning of EuCGT1
1.2.2 杜仲皮RNA的提取
取10 cm杜仲雌株新生棕色皮枝条(树皮约150 mg),液氮冷冻后刮去外皮层,沿内皮层将韧皮部与木质部分离,研磨至粉状。按照Omega公司困难样本方案进行,增加两次无水乙醇洗涤,降低盐残留对RACE PCR反应的干扰。提取的杜仲皮总RNA保存于-80℃备用。RNA 4μL,加入甲醛5μL、10×Loading Buffer 1μL,65℃水浴15 min变性,使用1.2%变性琼脂糖凝胶(含0.98%甲醛)电泳检测RNA提取质量。
1.2.3 cDNA第一条链合成
参照Clontech SMARTerTMRACE cDNA Amplification Kit User Manual,反转录酶使用Super-ScriptTMIII Reverse Transcriptase,进行cDNA第一条链合成。合成的5′-RACE-Ready cDNA和3′-RACE-Ready cDNA用Tricine-EDTA Buffer 20 μL溶解,-20℃保存。
1.2.4 5’-RACE和3’-RACE扩增
参照Clontech SMARTerTMRACE cDNA Amplification Kit User Manual,使用KOD-Plus-Neo DNA聚合酶进行扩增。使用GSP1与通用引物(Universal Primer A Mix,UPM)对5’-RACE cDNA进行扩增;使用GSP2与UPM对3’-RACE cDNA进行扩增。PCR管中顺序加入下列成分,建立50μL反应体系:PCR-Grade Water 28μL,10×PCR Buffer for KOD-Plus-Neo 5μL,dNTPs(10 mM)5μL,MgSO4(25 mM)3μL,UPM(10×)5 μL,GSP1 or GSP2(10μM)1μL,5’-RACE or 3’-RACE cDNA 2μL,KOD-Plus-Neo(1U/μL)1μL,混匀后瞬时离心,全过程冰浴中进行。使用热启动Touchdown PCR反应程序:90℃,30 sec,放入反应管;94℃,2 min;98℃20 sec,72℃,80 sec,5 cycles;98℃20 sec,70℃80 sec,5 cycles;98℃20 sec,68℃80 sec,35 cycles;68℃7 min;4℃终止反应。取5μL PCR产物,1.6%琼脂糖凝胶电泳检测;使用Omega公司的E.Z.N.A.TMGel Extraction Kits回收纯化扩增条带。
1.2.5 扩增片段克隆及序列分析
纯化产物Taq DNA聚合酶末端加A尾,70℃孵育45min。加A尾产物连接至pGEM©-T Easy Vector载体上,参照Promega technical manual体系:2×Rapid Ligation Buffer 5μL,pGEM©-T Easy Vector(50ng)1μL,PCR product 3μL,T4 DNA Ligase(3 Weiss units/μL)1μL混匀4℃孵化过夜,室温连接30 min。连接产物转化感受态大肠杆菌(DH5α),以Amp和蓝白斑筛选阳性菌落克隆,E.Z.N.A.TMPlasmid Mini Kits提取阳性大肠杆菌质粒,送北京诺赛基因组研究中心有限公司测序。
1.2.6 构建植物表达载体
以初始载体pSH737(图1b)为基础,设计并构建pSH-35S-EuCGT1植物表达载体(图1c)。根据测序结果选择上游酶切位点为XbaI,下游酶切位点为KpnI,设计含有酶切位点的EuCGT1扩增引物(表2),扩增的EuCGT1与pSH737均进行双酶切并纯化,使用DNA连接酶连接粘性末端(图1),重组质粒转化感受态大肠杆菌(DH5α),使用Kan 100 mg/L筛选阳性克隆,提取重组质粒使用XbaI和KpnI进行双酶切验证。
酶切验证结果呈阳性的重组质粒转化农杆菌菌株LBA4404感受态细胞,以Kan 100 mg/L、Rif 20 mg/L筛选农杆菌阳性菌株,使用表2引物对阳性菌株进行菌落PCR检测,PCR结果呈阳性的农杆菌菌株扩大培养-80℃保种。

表2 EuCGT1植物表达载体扩增引物Tab.2 Primers used for EuCGT1 detection in plant expression vector
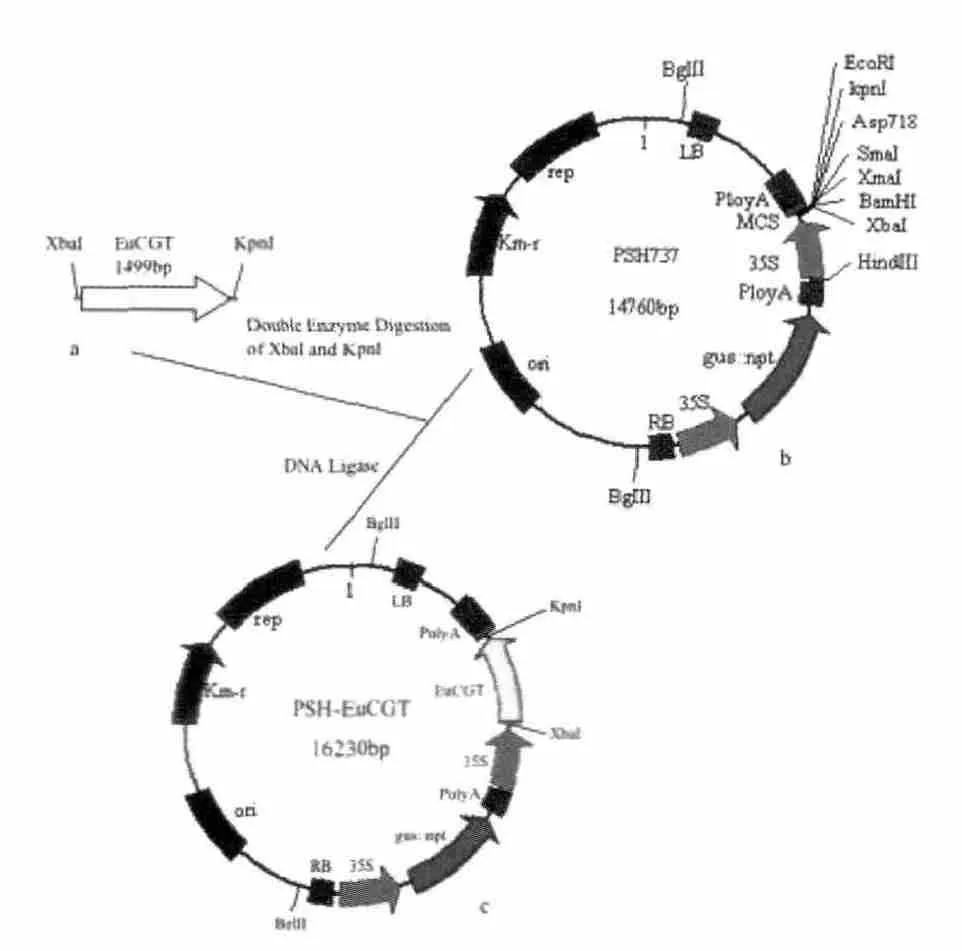
图1 植物表达载体pSH-35S-EuCGT1构建过程Fig.1 Construction of pSH-35S-EuCGT1 plant expression vector
1.2.7 农杆菌介导法遗传转化烟草
使用10ml含Kan 100 mg/L、Rif 20 mg/L的液体YEP,28℃200 rpm,活化培养pSH-35S-Eu-CGT1植物表达载体农杆菌菌株LBA4404至OD600为0.7,取活化后的菌按1%接种量于YEP液体培养基(Kan 100 mg/L、Rif 20 mg/L)扩大培养,至菌液OD600约为0.5~0.7,取菌液50 mL室温6 000 rpm离心10 min,菌体用重悬液重悬,至OD600为0.6。转pSH737初始载体的农杆菌菌株LBA4404采用相同方法制备重悬菌液,作为烟草遗传转化的空白对照组。
普通烟草种子使用无菌水萌发后移栽花盆内,置于植物生长室生长3个月用于实验取材。剪取完全伸展且没有损伤的幼嫩烟草叶片为外植体,流水冲洗30 min后转入超净工作台操作。使用75%酒精浸泡消毒30 s后用无菌水清洗3次;使用0.1%HgCl2溶液浸泡消毒8 min后用无菌水清洗5次以上,直至无菌水洗液不再出现泡沫;漂洗干净的叶片用无菌滤纸吸去表面水分将经过消毒处理的烟草叶片切去叶柄及边缘,叶片切成1 cm见方的小片,用配制好的重悬菌液浸泡烟草叶片,其间不断摇动。侵染5 min后取出叶片,用无菌滤纸吸去表面多余菌液。叶片密布接种于共培培养基上,28℃恒温培养箱中暗培养3 d。
共培养3天后的烟草叶片间隔1.5 cm接种于含kan的筛选培养基上进行筛选培养,每两周更换一次筛选培养基进行继代培养。约20天后有抗性愈伤形成,不断继代的抗性愈伤逐渐分化出抗性芽,待抗性芽长至约1cm左右时,切下抗性芽置于含kan的生根培养基上进行生根培养,至抗性芽长大成苗根系生长较发达后,对抗性苗炼苗处理3天,将植株从培养罐中取出洗净根系附着的培养基并栽至花盆中生长。
1.2.8 转基因烟草的鉴定
植物表达载体pSH-35S-EuCGT1中含有GUS报告基因,可使用GUS组织化学染色法可以快速鉴定转基因植株。剪取抗性烟草植株新生幼叶浸泡于GUS染色液中,37℃恒温培养箱中放置过夜,移至乙醇溶液中浸泡直至绿色完全脱去,在体视镜下观察。
为进一步确认所获得的烟草抗性植株是转入目的基因的转基因植株,取GUS组织化学染色呈阳性的生长良好的转基因抗性烟草植株,参照TIANGEN公司的基因组DNA提取试剂盒提取抗性烟草的基因组DNA用于检测。
提取的抗性烟草基因组DNA使用表2引物进行PCR扩增取5μL扩增产物在1%琼脂糖凝胶中进行电泳,在凝胶成像系统下检测。
2 结果与分析
2.1 杜仲总RNA的提取
所有凝胶成像结果使用Bio-Rad公司Image Lab(Ver.5.0)软件进行条带分析。提取的杜仲皮总RNA 1.2%琼脂糖变性胶电泳结果(图1)。图中28S和18S条带清晰,且28S条带的宽度与亮度约为18S条带的两倍,说明RNA较为完整。OD值测定结果:OD260/280=1.93、OD260/OD230=1.83,说明RNA样品纯度较高,盐离子去除程度较高,符合RACE扩增要求。
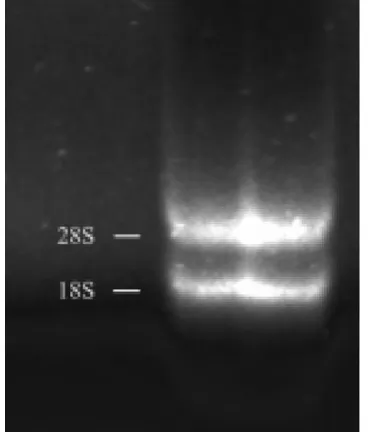
图2 杜仲总RNAFig.2 Total RNA isolated from Eucommia ulmoides
2.2 杜仲EuCGT1基因克隆
分别使用引物GSP1和GSP2与UPM组合进行TouchDown PCR扩增,扩增产物1.6%琼脂糖凝胶电泳检测,显示GSP1扩增条带测序结果为1 432 bp(图3a),GSP2扩增条带测序结果为535 bp(图3b)。两组扩增中有287 bp重复区域,与设计相符。
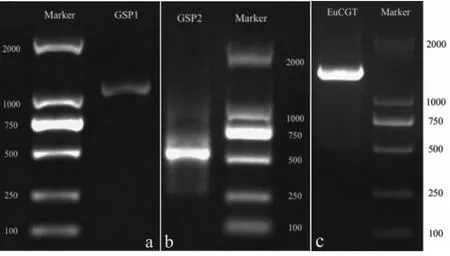
图3 cDNA扩增:a.5’-RACE;b.3’-RACE;c.EuCGT1全长扩增Fig.3 The cDNA fragment amplification:a.5’-RACE;b.3’-RACE;c.EuCGT1 full-length
根据测序结果设计的全长扩增引物CGTF与NUP组合,以3’-RACE cDNA第一条链为模板扩增杜仲松柏醇糖基转移酶CGT的全长序列。产物经1%琼脂糖凝胶电泳检测,所得条带在1 500 bp以上(图3c)。实际扩增大小为1 616 bp,与RACE拼接结果一致。将该基因命名为EuCGT1。
2.3 EuCGT1序列分析
EuCGT1实际克隆长度为1 583 bp,起始密码子ATG位于10 bp处,终止密码子TGA位于1 473 bp处,polyA尾长28 bp,加尾信号AATAAA位于1 534~1 539 bp,推测开放阅读框长1 464 bp,编码487个氨基酸及一个终止密码子,全长序列及推测氨基酸顺序见图4。NCBI进行EuCGT1核酸序列blastn比对,结果显示同源性最高的是草莓(67%,Fragaria x ananassa,ID:82880417)和甜橙(72%,Citrus sinensis,ID:102628347)的UDP-葡萄糖糖基转移酶-6(UDP-glucose glucosyltransferase-6,GT6);NCBI进行EuCGT1氨基酸序列blastp比对,结果显示同源性最高的是葡萄(58%,Vitis vinifera,XP_002263661.1)和甜橙(58%,Citrus sinensis,XP_006481379.1)的UDP-葡萄糖类黄酮3-O-糖基转移酶-6(UDP-glucose flavonoid 3-O-glucosyltransferase-6)。序列分析结果推测EuCGT1为糖基转移酶家族基因。

图4 EuCGT1全长序列及推测的氨基酸Fig.4 EuCGT1 sequences of nucleotide and its deduced amino acid
2.4 蛋白EuCGT1结构分析
使用DNAssist Ver.2.2对EuCGT1蛋白质理化性质进行预测,相对分子量为54kD,等电点pI为5.2。使用Center of Biological Sequence Analysis整合的多款在线分析工具对EuCGT1氨基酸序列进行结构分析与预测。SignalP 4.1 Server信号肽分析结果显示EuCGT1中不含真核信号肽;TMHMM Server v.2.0跨膜结构分析结果显示Eu-CGT1全部氨基酸均在膜外,没有膜内或穿膜结构。根据上述两项结果初步推测EuCGT1的表达位置在细胞质。NetSurfPver.1.1和PSIPRED v.2.5在线联合分析对氨基酸序列表面亲和性及二级结构进行预测,亲和性预测结果显示EuCGT1中有46%的氨基酸(224个)位于蛋白表面(Exposed),有54%(263个)位于蛋白内部(Buried);二级结构预测结果显示EuCGT1中50.3%的氨基酸(245个)参与构成α-螺旋(α-Helix),37.17%(181个)构成无规则卷曲(Random Coil),β-片层(β-Strand)结构最少,占12.53%(61个)。联合分析结果显示暴露在外的氨基酸多为α-螺旋和无规则卷曲结构,而β-片层几乎全部都被包裹在Eu-CGT1蛋白结构内部。联合分析结果见图5。
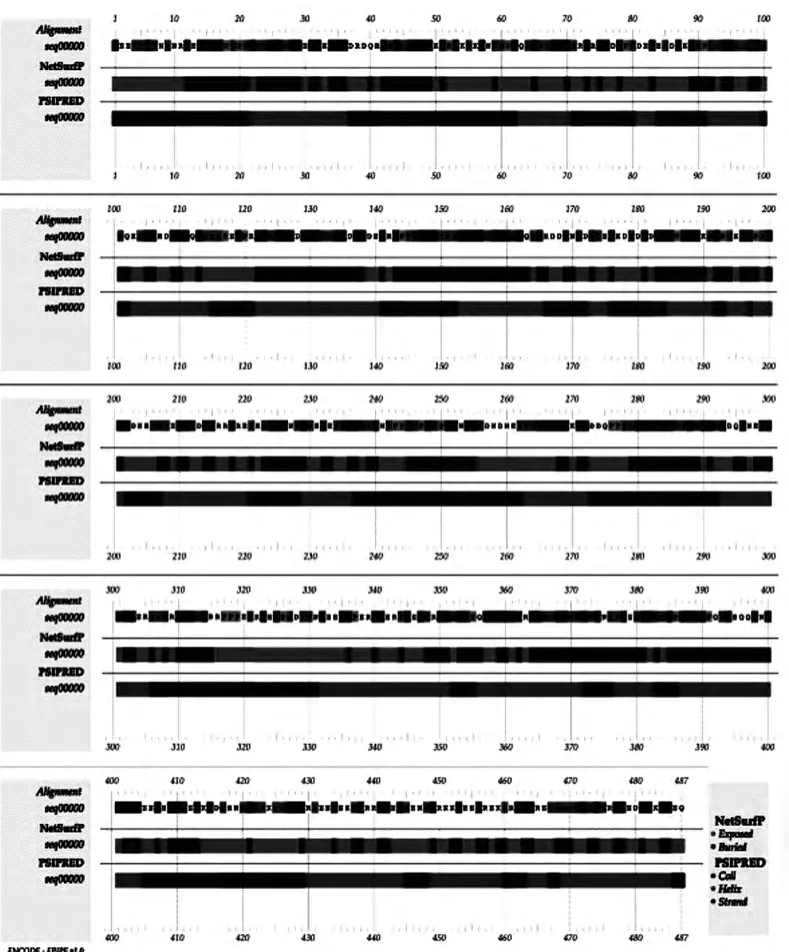
图5 NetSurfP和PSIPRED分析EuCGT1氨基酸序列Fig.5 NetSurfP-PSIPRED analysis of the amino acid sequence of EuCGT1.
使用Conserved Domains Database比对EuCGT1氨基酸序列,结果显示EuCGT1与GT1糖基转移酶(GT1_Gtf_like,PSSM:CD03784,以 下 简 称CD03784)同源性较高。CD03784以TDP-葡萄糖为糖基供体,对万古胺(vancosamine)进行糖基化修饰。EuCGT1与CD03784经同源比对筛选出相似的保守结构域(见图6),涉及的核心氨基酸有14个,6个位于糖基供体结合位点,5个位于万古胺结合位点,3个位于催化位点。保守结构域的14个氨基酸中EuCGT1与CD03784在糖基供体结合位点有1个氨基酸差异,在万古胺结合位点有3个氨基酸差异,催化活性中心的保守结构域相同。

图6 EuCGT1保守结构域比对结果Fig.6 Alignment of the conserved domains of EuCGT1
CDD的比对结果显示,以2ACV蛋白三级结构为模体对EuCGT1和CD03784进行3D同源建模,比较EuCGT1与cl10013的三级结构和活性中心(图7)。从图中核心氨基酸差异位点可以看出,EuCGT1与CD03784在特异性底物(万古胺)结合位点上差异明显,说明EuCGT1不能结合万古胺,而松柏醇的特异性结合位点目前尚未见报道,故不排除EuCGT1催化松柏醇糖基化的可能性;而糖基供体结合位点仅有1个氨基酸差异(C图蓝色箭头所示),说明EuCGT1能够结合糖基供体;整体三级结构可以看出,EuCGT1的氨基酸骨架符合NDP-糖基转移酶的特征,能够折叠形成相应的活性催化中心和底物结合位点。
使用EuCGT1蛋白质序列构建系统发育树:植物中已知的松柏醇糖基转移酶氨基酸序列主要存在两组Motif:Glycosyl transferase family 1和Glycosyltransferase family 28 C-terminal domain,这与花青素/原花青素糖基转移酶家族的核心Motif相同。从NCBI中检索植物中报道的CGT氨基酸序列,使用ClustalX2 for Mac将检索获得的具有代表性的氨基酸序列与EuCGT1氨基酸序列进行比对,使用MEGA5.2.2构建NJ进化树,结果显示(图8):Eu-CGT1与其他植物CGT无法聚类,而是与(Genlisea aurea)的Lignan UGT(partial)聚为一类,说明杜仲EuCGT1在进化历程上与这些植物的CGT亲缘性较远,螺旋狸藻属植物归于菊亚纲(Asteridae),推测杜仲的EuCGT1蛋白在进化过程中与菊亚纲植物CGT亲缘性较近。

图7 EuCGT1 3D模型及催化核心氨基酸残基比较Fig.7 Alignment of amino acid residues of active sites in 3D structure of EuCGT1
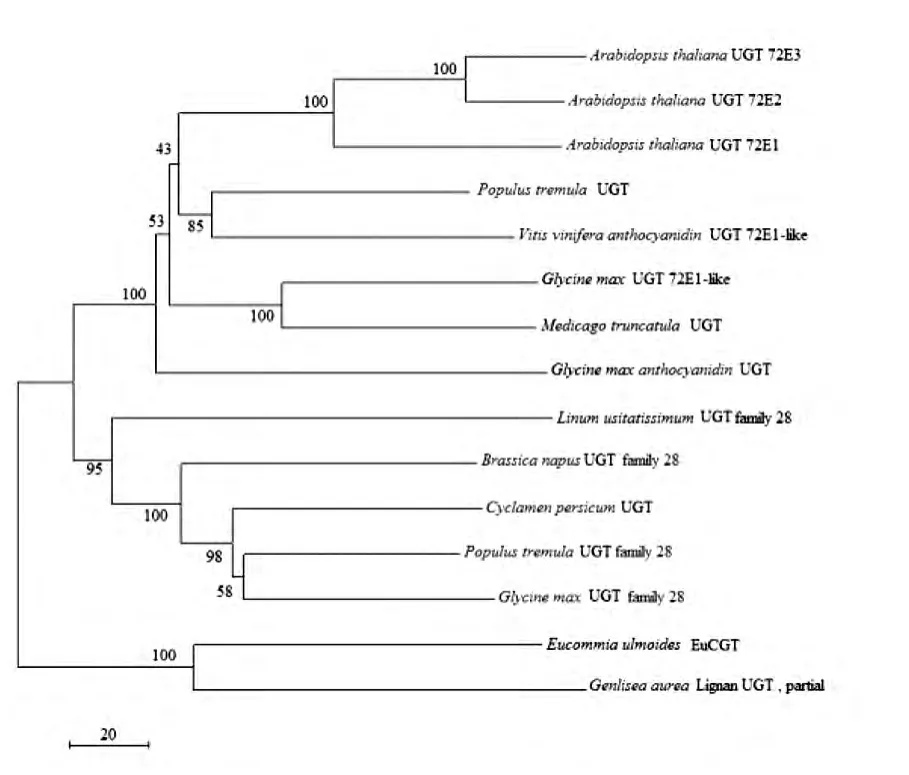
图8 EuCGT1蛋白全长氨基酸序列NJ树构建Fig.8 Neighbor joining tree of full length amino acid sequence of EuCGT1
2.5 植物表达载体鉴定
大肠杆菌中提取的重组质粒使用XbaI和KpnI进行双酶切鉴定,结果见图9a。酶切结果显示阳性菌落中提取的质粒经双酶切能获得一条大小在1 500 bp左右的条带,是说明EuCGT1正确连入pSH737的多克隆位点。重组质粒转化农杆菌感受态细胞,农杆菌阳性菌株的菌落PCR结果见图9b,结果显示3、4号菌株均扩增获得了1 500 bp左右的条带,说明pSH-35S-EuCGT1植物表达载体构建完成并已转入农杆菌中。

图9 植物表达载体鉴定:a.重组质粒双酶切鉴定;b.农杆菌LBA4404菌落PCRFig.9 Detection of dicot expression vector
2.6 转基因烟草鉴定
经农杆菌遗传转化获得的14株烟草抗性幼苗移栽后培养一个月,取幼嫩叶片进行GUS组织化学染色结果显示:14株烟草抗性植株中有9株GUS组织化学染色结果呈阳性(图10a),GUS染色结果呈阳性的烟草提取基因组DNA进行PCR验证,设非转基因烟草为野生型(WT),设转pSH737初始载体的烟草为空白对照组(CK),结果显示,有8株遗传转化的烟草扩增出了1 500 bp左右的特异性条带(图10b),确定为转EuCGT1基因烟草。
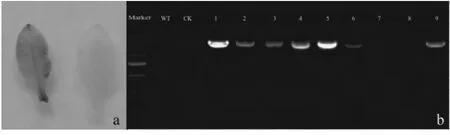
图10 转基因烟草鉴定Fig.10 Detection of transgenic tobacco
幼苗移栽花盆培养一个月之后,经鉴定确定为EuCGT1转基因烟草植株与野生型烟草植株在表型上无明显差异(图11)。

图11 转EuCGT1烟草与野生型烟草表性对比Fig.11 Phenotype comparison among the transgenic lines and the wild type
3 讨论
木脂素(Lignan)是一类由两分子苯丙素衍生物聚合而成的天然化合物,构成木脂素的单体有桂皮酸、桂皮醇、丙烯苯、烯丙苯等。木脂素类单体物质是通过桂皮酸合成途径合成,再由单体聚合形成木脂素。木脂素是植物植保素的一大类,能增加植物的拒食性,帮助植物抵御虫害[10]。
松脂醇双糖苷是杜仲中最具代表性的木脂素糖苷类化合物,目前的研究显示松脂醇双糖苷仅在杜仲被发现。该化合物具有双向血压调节作用,是目前公认的最为安全的天然降压药物[11],这与其两端的芳环羟基糖苷化结构密不可分[4]。松柏醇双糖苷的母核是由两个松柏醇通过支链烯醇聚合形成的具有手性结构的双环氧木脂素。松柏醇是苯丙素类生物合成途径在植物细胞质中合成的终产物之一,与对-羟基香豆醇、芥子醇一起统称为单体木质醇(monolignols),单体木质醇更主要参与植物木质化矩阵构建合成木质素(Lignins)[12][13],是组成植物次生细胞壁的主要成分[6]。
木质素的调控按其功能可分为三类:(1)苯丙酸途径的调控,有PAL、C4H和4CL。该类酶是直接控制木质素合成途径流量的开关;(2)木质素单体特异合成相关酶,主要有COMT、CCoAOMT和FSH。该类酶承接上游反应,将代谢途径分配到三中不同木质素之路,调控该类酶能控制三种木质素单体的煮成比例;(3)木质素单体特异合成途径下游酶类,包括CAD[14]和CCR,该类酶直接催化流入分支的化合物直接合成木质素单体。
细胞质中合成的单体木质醇包括松柏醇在内都对植物细胞本身都具有细胞毒性且结构不稳定[15],其芳环的对位羟基氢活跃,易发生随机聚合。研究发现该位置羟基经糖基化修饰后能降低其细胞毒性,是木质素前体的主要储存形式[16]。
Minako等人[17]以[3H]Phe为前体进行放射性标记研究,发现木质素类衍生物虽然与高尔基体、粗面内质网相关,而更多的则出现在液泡中。大部分单体木质醇会在胞质UDP-糖基化转移酶的作用下催化合成单体木质醇苷,通过ABC转运载体运载至液泡中储存[7,18]。松柏醇糖基转移酶催化松柏醇糖基化反应合成松柏苷,目前的研究仅在细胞质中发现有糖基化转移酶能催化木质醇的糖苷化反应,普遍认为细胞壁中不存在糖基化转移酶,推测木脂素糖苷类化合物糖苷结构的引入可能也是由细胞质中的单体木质醇糖苷转移酶催化合成的。克隆杜仲的松柏醇糖基转移酶基因(EuCGT1)能为揭示杜仲特有的松脂醇双糖苷的合成调控机制奠定基础。
本研究克隆的EuCGT1序列经blastn、blastp比对,结果均支持该基因及其推测编码的氨基酸序列确实属于UDP-葡萄糖基转移酶(UDP-GT),且序列完整包含转录组中的CGT片段,将该基因命名为杜仲松柏醇糖基转移酶基因。三级结构建模进一步证明了EuCGT1骨架符合糖基转移酶的特征。
EuCGT1与CD03784三级结构模型在糖基供体结合位点上有1个保守氨基酸差异,推测该氨基酸可能与碱基识别有关,提示EuCGT1结合的葡萄糖类型应该是UDP-葡萄糖,而非CD03784所识别的TDP-葡萄糖,这一点也在Multi-domains UDPGT的比对中得到验证(idents>81%);同时值得注意的是,CD03784下属的超家族糖基转移酶(多来源于细菌)几乎都能形成催化中心相背的二聚体,主要由6个氨基酸在空间上形成位置邻近的二聚体保守结构域,而EuCGT1完全不具备该保守结构域,推测EuCGT1不会形成二聚体,使之区别于细菌的糖基转移酶,但EuCGT1三级结构建模会与细菌的糖基转移酶具备同源性,推测可能与杜仲在进化上的独特地位有关。
新基因功能研究的常规策略主要有:生物信息学分析、基因的mRNA和蛋白水平表达分析、基因功能获得研究、基因功能丢失研究、以及编码蛋白互作研究[19],其中转基因技术作为基因功能获得研究中最常用的技术,被广泛应用于新基因功能研究。本研究将克隆获得的EuCGT1基因构建了pSH-35S-EuCGT1植物表达载体并使用农杆菌遗传转化烟草,经验证为转EuCGT1基因的烟株在表型上与野生型烟株无明显差异,推测是因为Eu-CGT1基因作为次生代谢途径的产物修饰基因,无法直接影响次生代谢通路的流量。后续可通过测定该基因催化反应底物与产物含量变化验证基因的功能。
[1]辛晓明,冯 蕾,王 浩,等.杜仲的化学成分及药理活性研究进展[J].医学综述,2007,139(9):1 507-1 509.
[2]赵玉英,耿 权,程铁民.杜仲化学成分研究概况[J].天然产物研究与开发,1995,7(3):46-52.
[3]DEYAMA T,NISHIBE S,NAKAZAWA Y.Constituents and pharmacological effects of Eucommia and Siberian ginseng[J].Acta Pharmacol.Sin.2001,22(12):1 057-1 070.
[4]CHARLESJ S,RAVIKUMAR P.R.,HUANGF C,et al.Isolation and Synthesis of Pinoresinol Diglucoside,a Major Antihypertensive Principle of Tu-Chung(Eucommia ulmoides,Oliver)[J].Journal of the American Chemical Society,1976,18,98:17.
[5]DEYAMA T,NISHIBES,KITAGAWA Y,et al.Inhibitors of cyclic AMPphosphodieterase in medicinal plants.XIV.Inhibition of adenosine 3′,5′-cyclic monophosphate phosphodiesterase by lignan glucosides of Eucommia bark[J].Chem.Pharm.Bull,1988,36:435.
[6]LAURENCE B D,NORMAN G L.Lignin primary structures and dirigent sites[J].Current Opinion in Biotechnology.2005,16:407–415.
[7]LIU C J,MIAOY C,ZHANGK W.Sequestration and Transport of Lignin Monomeric Precursors[J].Molecules,2011,16:710-727.
[8]VOGT T,JONES P.Glycosyltransferases in plant natural product synthesis:characterization of a supergene family[J].Trends in plant science,2000,9(5):380-386.
[9]LI J,LI Z B,LI CF,et al.Molecular cloning and characterization of an isoflavone 7-O-glucosyltransferase from Puerarialobata[J/OL].Plant Cell Reports,2014,http://dx.doi.org/10.1007/s00299-014-1606-7.
[10]HARMATHA J,NAWROT J.Insect feeding deterrent activity of lignans and related phenylpropanoids with a methylenedioxyphenyl(piperonyl)structure moiety[J].Entomol Exp Appl,2002,104:51–60.
[11]宋 妍,许激扬.杜仲木脂素化合物降压药效学研究与机制初探[J].中医药学刊,2006,24(10):1 934-1 936.
[12]FERGUSB J,GORINGD.The location of guaiacyl and syringyl lignins in birch xylem tissue[J].Holzforschung 1970,24:113-117.
[13]WHITING P,GORING D.Chemical characterization of tissue fractions from the middle lamella and secondary wall of black spruce tracheids[J].Wood Sci Technol.1982,16:261-267.
[14]赵 丹,李晓毓,陈 建,等.杜仲肉桂醇脱氢酶基因全长cDNA克隆及序列分析[J].山地农业生物学报,2012,31(4):283-287.
[15]BOWLESD,LIM E K,POPPENBERGER B,et al.Glycosyltransferases of lipophilic small molecules[J].Plant Biol,Annu Rev.,2006,57,567-597.
[16]LIM E K,LI Y,PARR A,et al.Identification of glucosyltransferase genes involved in sinapate metabolism and lignin synthesis in Arabidopsis[J].Biol.Chem.2001.276:4 344-4 349.
[17]MINAKO K,KIM H R,WONG J C T,et al.Tracking Monolignols during Wood Development in Lodgepole Pine[J/OL].American Society of Plant Biologists,2008,http://www.plantphysiology.org/content/147/4/1750.full.
[18]ALEJANDRO S,LEE Y,TOHGE T,et al.AtABCG29 is a monolignol transporter involved in lignin biosynthesis[J].Curr.Biol,2012,22:1 207-1 212.
[19]卜友泉,杨正梅,宋方洲.新基因功能研究的策略与方法[J].生命科学研究,2006,10(2):95-98.
