湿地挺水植物根际金属离子的分布及界面扩散通量
2014-10-22古小治陈开宁范成新
古小治,陈开宁,范成新
中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏 南京 210008
湖滨带湿地处在一个不同的水环境连续梯度系统内,从轻度干旱状态到全水淹状态的一系列梯度性变化,具有复杂性、多变性和复合性的一系列梯度微生境变化特征。不同水分条件下生长和分布着不同的植物群落,它们的根多为纤维状,主要分布在0~30 cm的土壤表层,随根状茎向四面延伸,形成庞大的须根系,借以吸收土壤内的养分和水分。在土壤中纵横交错,根系的存在具有产生土壤大孔隙、改善土壤微生态环境的作用(Froend和McComb,1994;Gu等,2012),根系的生长发育过程影响其环境功能的发挥及其根土和水土界面微环境的生物地球化学过程。
有关湿地金属离子的研究主要集中在沉积物金属离子分布特征,污染生态风险、再悬浮释放的风险评估等(Cantwell等, 2008; Christensen,1998),湿地植物作为湿地生态系统的主体,其在湿地环境地球化学物质循环过程中起着关键作用。大型挺水植物水-沉积物界面氧化还原异质环境是沉积物各形态金属离子组分赋存及其转化的重要场所,在水土界面会发生扩散、沉淀和溶解以及吸附和解析等许多瞬时过程,这些过程对营养盐及金属离子离子在固相和水相的分配起着重要的作用(Mainea等,2009;申秋实等, 2011)。本文采用高分辨率的原位平衡式间隙水采样方法来获取根际及及非根际沉积物金属离子的分布特征,探讨大型挺水植物生长对金属离子赋存特征及界面行为的影响,阐明说明金属离子对湿地大型挺水植物生长的响应机理,可为科学评估湿地生态环境功能提供决策依据。
1 材料与方法
1.1 Peeper结构简介
Peeper主体是由一系列小室组成,小室两侧覆盖一层渗析膜,室内预先封装去离子水,利用渗析膜过滤的特性,使膜两侧水体(如去离子水和间隙水)中一些可溶离子和分子交换达到平衡。Peeper制作材料为有机玻璃,12个小室并行排列,间隔1 cm,每一小室体积约为6.4 mL,孔径为0.45 μm的渗析膜,具生物惰性,使用时用双面夹板固定于采样器主体板上,如图1所示。

1.2 研究区概况
研究区域位于山东省微山县南四湖,该湖是我国北方最大的淡水湖。湖区总面积约为1266 km2,最大水深2.76 m,湖容16.06亿m3,是南水北调东线工程主要的过水通道,起着蓄水和输水的重要作用。受人为调蓄水位波动较大,水位变幅多年平均达 3.2 m,如此大的变幅对水生植物的生长影响较大,对湖泊生态系统也将会产生重要影响。在南四湖新薛河入湖口的河口湿地分布着大量的天然湿地及人工构建湿地,总面积超过500 hm2,常年大量生长的土著水生植物,包括芦苇(Phragmites australis)、香蒲(Typha latifolia)、茭草(Zizania latifolia)等,其湿地植物形成的廊道作为主要的生态滤床,在削减和消除污染物方面发挥着主要的调蓄功能。
1.3 样品的采集与分析
1.3.1 间隙水的采集与分析
选取湿地植物生长茂盛区域,将Peeper紧贴植物根系垂直插入底泥至预定深度,自Peeper投放时间计起,平衡30 d,从泥中拔出Peeper,即刻用低压水枪冲洗其单面所附泥块,并用吸水纸吸干膜外部湖水,立即用移液枪穿孔抽取适量体积间隙水装入具塞小瓶中,2 h内带回实验室,水样过GF/F滤膜后用ICP-AES仪器(安捷伦公司,美国)对Al3+、Ca2+、Mn2+、Fe3+进行测定。
1.3.2 沉积物样品采集与分析
在收集沉积物孔隙水时,同时利用柱状采泥器(Ф85 mm×600 mm)采集沉积物样品,每样点3根平行样,泥层厚度不少于25 cm,上下加胶塞密封(完整未扰动的柱样及其上覆水)后,小心运回实验室。采样顶推法收集表层0~1 cm沉积物样品,水分测定采用烘干法在105 ℃下烘6 h,含水率为沉积物烘干前后质量差值与原有湿沉积物质量的比值。孔隙度按下式计算(Murray等,2006):

其中:W为沉积物含水率(质量分数);ds为沉积物平均的密度,这里取值2.65 g·cm-3;dw为水的密度,1.000 g·cm-3。
1.3.3 沉积物-水界面的扩散通量
在稳态情况下,沉积物金属离子的分布主要受一维垂向传输和反应过程控制,其在沉积物-上覆水界面的交换通量,可运用Fick第一定律来获得(Ciceri等,1992):

其中:F为沉积物-上覆水界面扩散通量;0ϕ为表层 0~1 cm沉积物的孔隙度为沉积物-上覆水界面的浓度梯度,可通过对表层沉积物间隙水中营养盐-浓度与深度的拟合曲线得出;Ds为考虑沉积物弯曲效应的实际分子扩散系数。沉积物弯曲度的测量是相当困难的,Ullman曾经给出了真实扩散系数Ds与孔隙度φ之间的经验关系式:

D0为无限稀释溶液的理想扩散系数(宋金明,1997),在25 ℃,Al3+,D0=5.59×10-6cm2·s-1;cm2·s-1;Mn2+,D0=6.88×10-6cm2·s-1。通过测定表层1 cm沉积物的孔隙度φ得到Ds的数值。
2 结果与讨论
2.1 湿地挺水植物根际孔隙水中金属离子的分布特征

湿地挺水植物根区附近孔隙水中金属离子剖面分布,如图2所示。整体来看,孔隙水中Al3+、T-Fe、Ca2+和Mn2+含量远高于上覆水,且随深度变化基本呈现先增加,后逐步趋于稳定的变化趋势。与无植被的对照区域相比,4种金属离子含量在植物根区附近显著升高(P<0.05)。其中 Al3+、Fe3+和Ca2+受芦苇生长过程影响最为明显,其在根际孔隙水中峰值含量达 18.3、513 和 5408 μmol·L-1,较对照分别增加了6.0、2.5及25.8倍;而Mn2+在根区的分布受芦苇、香蒲和茭草影响均有显著差异(P<0.05)。多重比较分析结果显示,Mn2+在根区的分布受茭草影响最大,在根区孔隙水中浓度为21~97 μmol·L-1,较对照区的 1.1~52.5 μmol·L-1,平均含量增加65%。
从剖面垂向分布来看,Al3+含量的峰值在大约5 cm 深的区域靠近沉积物的顶层,而 Fe3+、Ca2+和Mn2+含量峰值出现位置相对较深,大约15 cm深的区域存在于沉积物中下层。从沉积物的Eh剖面看,芦苇、香蒲及茭草根区及非根区氧化还原电位15~-300 mV间波动,也即从表层的弱还原状态逐步过渡到深层的强还原状态属极度厌氧区,这影响金属离子尤其是溶解态的铁和锰在孔隙水中的分布(Drobner等,1990)。虽然对照区Eh总体上平均值略低于植被覆盖区,但统计检验发现两者间差异并不显著。Eh随沉积物深度增加,根际比非根际沉积物中Eh下降缓慢,根际略高于非根际的Eh,但经统计检验发现芦苇、香蒲、茭草根际与非根际沉积物 Eh数值间没有显著差异,另外三种植物根际Eh在剖面的分布也没有显著差异(P<0.05),也即大型挺水植物对沉积物 Eh剖面分布影响有限,尽管其根际泌氧,但不是影响 Eh下降的主导因子,可能有机质降解及底栖生物消耗氧气是其 Eh下降的主要因子(Bartoli等,1996;Witek等,2001)。一般Eh较高时,促进沉积物中金属离子氧化和水解,容易形成 Al3+、Fe3+、Ca2+和Mn2+的氧化物和氢氧化物进而被沉积物物理吸附或发生化学沉积过程。在淹水厌氧的条件下,铁和锰被还原为底价的离子从沉积物中大量溶出,产生毒害(Drobner等,1990)。实际上在淹水的沉积物中,锰比铁更难被氧化,另外从图3中可明显看出,在沉积物剖面中深度超过10 cm后Eh小于-200 mV,属强还原状态,此时孔隙水中的总铁主要以Fe2+的为主,并且铁的还原产物Fe2+的存在会抑制锰的氧化。
Warnken等(2001)研究美国德克萨斯州东南部的Galveston Bay湾海相沉积物发现,孔隙水中的锰和铁浓度分别为11.3~282和3.8~122 μmol·L-1;另外Rivera-Duarte和Flegal(1997)研究洛杉矶的圣弗朗西斯科湾海相沉积物孔隙水中相应锰和铁浓度0.1~237和1.2~243 μmol·L-1。本研究中湿地锰和铁的浓度分别为0.26~136和0.65~513 μmol·L-1,锰含量明显低于海相沉积物水平,但铁含量相对丰富,尤其是贴近植物根系的下层沉积物中含量更高。在无植被的对照区上覆水的含量相对孔隙水铁含量由2.3增加到34.3μmol·L-1,富集系数为15,而芦苇、香蒲和茭草根区的上覆水中平均浓度分别为0.9、1.9和8.1 μmol·L-1,孔隙水中的平均含量达到53、328和301 μmol·L-1,富集系数依次为66、200和37,随深度增加富集系数由表层向下层沉积物呈明显增强的趋势;与铁分布显著不同,锰受大型挺水植物的影响就相对较弱,对照区上覆水中相对于孔隙水中含量为0.66和22 μmol·L-1,富集倍数为34。芦苇、香蒲和茭草根区的上覆水相对于孔隙水中平均含量依次为1.3、2.8和0.9及61.8、118.5和51.3 μmol·L-1,富集倍数47、42及57,经比较分析发现,芦苇、香蒲和茭草均显著高于对照(P<0.05)。

2.2 挺水植物根际孔隙水中金属离子的在沉积物-水界面扩散通量
金属离子在沉积物-水界面扩散主要受控于表层沉积物性质及金属离子的分布规律。从图3分布情况来看,表层0~5 cm孔隙水中金属离子呈线性递增的趋势,拟合曲线相关系数r2大于0.85,呈极显著正相关关系。湿地植物根区 Al3+、Fe3+、Ca2+和Mn2+的扩散通量均为正值,表现为从沉积物孔隙水向上覆水迁移的扩散特征。受植物根区环境的影响,Fe3+和 Ca2+在植物根区释放速率明显加快,其中茭草根区释放速率明显加快,分别为(35.38±3.05)和(240.18±20.71) μmol·m-2·d-1(表 1),与对照相比增加达10倍之多;而Mn2+则正好相反,湿地植物存在直接导致锰在界面的交换速率显著降低,由对照的240.18±20.71下降为芦苇区2.06±0.44,削减的幅度超过 99%;Al3+在界面的交换过程相对较为复杂,芦苇和茭草区Al3+释放速率显著加快,但香蒲区Al3+释放过程明显受到抑制,扩散速率仅为对照的50%。
Ca2+在沉积物-水界面的扩散过程主要受制于表层沉积物的pH值。表层及亚表层沉积物pH下降导致孔隙水中碳酸盐固化的金属离子释放,进而加大其释放潜力导致沉积物释放速率加快(Cravotta和Trahan,1999)。铁和锰在界面的环境变化过程主要受Eh控制,也即铁锰氧化物的氧化还原循环过程(Manceau等,1992)。Fe2+和Mn2+主要以还原态的形式存在于沉积物的缺氧层到底层的厌氧层的区域,铁锰氧化物沉积和还原过程是导致其扩散通量差异的主要原因(Wieder,1993)。一般认为水土微界面及附近沉积物快速氧化过程导致铁锰离子的释放速率下降;另外,沉积物下层硫化物形成的共沉积过程也可能是导致铁锰扩散通量差异的主要因素(Choi等,2006)。
3 结论
金属离子在湿地沉积物的分布和界面传输过程受植物影响显著,随植物种群类型变化而异。主要表现为:
1)湿地沉积物孔隙水中 Al3+、Fe3+、Mn2+和Ca2+的含量较上覆水存在着明显的富集现象。其中Fe3+、Mn2+受大型挺水植物影响最为显著,且随沉积物深度增加,富集效应有进一步加剧趋势。从剖面垂向分布来看,Al3+含量的峰值靠近沉积物的表层,而Fe3+、Ca2+和Mn2+含量峰值出现位置相对较深存在于沉积物中下层。
2)湿地沉积物孔隙水中 Al3+、Fe3+、Mn2+和Ca2+的含量较无植物的对照区显著升高,最高时两者相差 26倍。从挺水植物对金属离子分布的根际效应来看,芦苇显著高于香蒲和茭草。
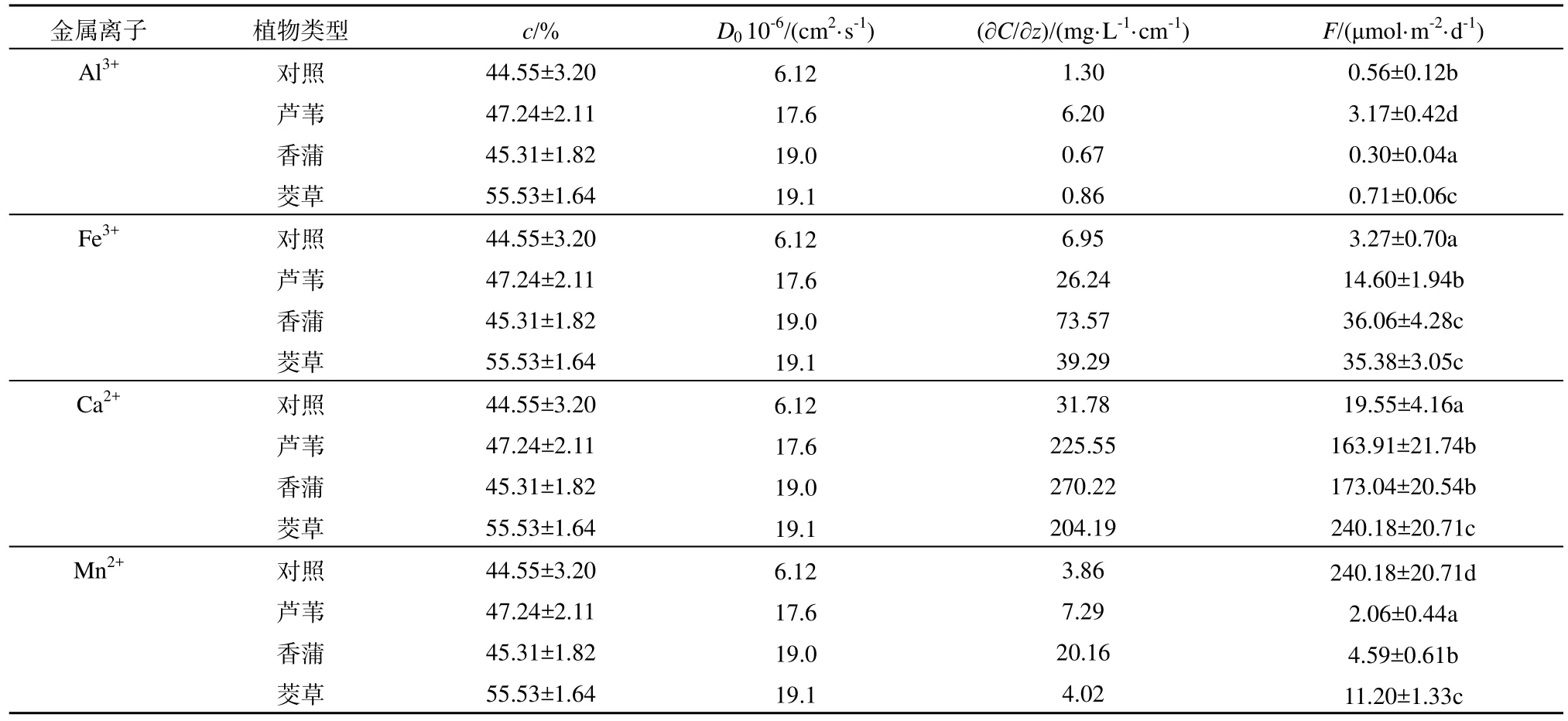
表1 沉积物-水土界面金属离子的扩散通量1)Table 1 Diffusive fluxes across the sediment-water interface of PO43-, NH4+ , NO3- and NO2-
3)挺水植物改变了根际环境,增强了孔隙水中 Al3+、Fe3+、Ca2+向水体的释放速率,但显著地降低了Mn2+的释放风险,这与湿地植物明显改变沉积物氧化还原状态密切相关。
BARTOLI M, CATTADORI M, GIORDANI G, et al.1996.Benthic oxygen respiration, ammonium and phosphorus regeneration in surficial sediments of the Sacca Di Goro (Nothern Italy) and two French coastal lagoons: a comparative study[J].Hydrobiologia, 329,143-159.
CANTWELL M G, BURGESS R M, KING J W.2008.Resuspension of contaminated field and formulated reference sediments Part I:Evaluation of metal release under controlled laboratory conditions[J].Chemosphere, 73(11): 1824-1831.
CHOI J H, PARK S S, JAFFE P R.2006.The effect of emergent macrophytes on the dynamics of sulfur species and trace metals in wetland sediments.Environmental Pollution, 140, 286-293.
CHRISTENSEN E R.1998.Metals, acid-volatile sulfides, organics, and particles distributions of contaminated sediments[J].Water Science &Technology, 37: 149-156.
CICERI G, MARAN S, MARTINOTTI W, et al.1992.Geo-chemical cycling of heavy metals in a marine coastal area: benthic flux determination from pore water profiles and in situ measurements using benthic chambers[J].Hydrobiologia, 235-236, 501-517.
CRAVOTTA LII C A, Trahan M K.1999.Limestone drains to increase pH and remove dissolved metals from acidic mine drainage.Applied Geochemistry, 14, 581-606.
DROBNER E, HUBER H, WACHTERHAUSER G, et al.1990.Pyrite formation linked with hydrogen evolution under anaerobic conditions.Nature, 346: 742-744.
FROEND R H, MCCOMB A J, 1994.Distribution, productivity and reproductive phenology of emergent macrophytes in relation to water regimes at wetlands of South-western Australia[J].Australian Journal of Marine and Freshwater Research, 45: 1491-1508.
GU Xiaozhi, CHEN Kai-ning, HUANG Wei, et al.2012.Preliminary application of a novel and cost-effective in-site technology in compacted lakeshore sediments for wetland restoration[J].Ecological Engineering, 44: 290-297.
MAINEA M A, SUNE N, HADAD H.et al.2009.Influence of vegetation on the removal of heavy metals and nutrients in a constructed wetland[J].Journal of Environmental Management, 90: 355-363.
MANCEAU A, GORSHKOV A I, DRITS V A.1992.Structural chemistry of Mn, Fe, Co, and Ni in Mn hydrous oxides.II.Information from EXAFS spectroscopy, electron and X-ray diffraction[J].American Mineralogis, 77, 1144-1157.
MURRAY L G, MUDGE S M, NEWTON A, et al.2006.The effect of benthic sediments on dissolved nutrient concentrations and fluxes [J].Biogeochemistry, 81: 159-178.
RIVERA-DUARTE I, FLEGAL, A R.1997.Pore-water silver concentration gradients and benthic fluxes from contaminated sediments of San Francisco Bay, California, U.S.A.Marine Chemistry, 56: 15-26.
Ullman W J, Sandstron M W.Dissolved nutrient flux from the nearshore sediments of Bowling Green Bay,Central Great Barrier Reef Lagoon(Australia) [J].Esturine, Coastal and Shelf Science.1987, 24(3):289-303.
WARNKEN K W, GILL G A, GRIFFIN L L, et al.2001.Sediment-water exchange of Mn, Fe, Ni and Zn in Galveston Bay, Texas[J].Marine Chemistry, 73: 215-231.
WIEDER R K.1993.Ion input/output budgets for wetlands constructed for acid coal mine drainage treatment[J].Water, Air, and Soil Pollution, 71:231-270.
WITEK Z, DRGAS A, AMERYK A, et al.2001.Production and mineralization of organic matter in the Pomeranian Bay (Baltic Sea)[J].Bulletin of the Sea Fisheries Institute, Gdynia, 154 (3): 49-69.
申秋实,邵世光,王兆德, 等.2011.太湖月亮湾湖泛发生过程模拟及水土物化性质的响应[J].水科学进展, 22(5): 710-719.
宋金明.1997.中国近海沉积物: 海水界面化学[M].北京: 海洋出版社:62-81.
