不典型急性主动脉综合征患者五例临床分析
2014-10-21练睿张国强
练睿 张国强

DOI:10.3760/cma.j.issn.1671-0282.2014.09.023
作者单位:100029 北京,中日友好医院急诊科
通信作者:张国强,Email:zhangchong2003@vip.sina.com
急性主动脉综合征(acute aortic syndrome,AAS)是一组严重威胁生命的主动脉性疾病,通常大部分临床医生所认识到的典型临床表现为急剧的、撕裂样的转移性胸背痛,疼痛一旦發作即达高峰。当病变累及到升主动脉时,疼痛可放射到前胸部或颈部;累及降主动脉时,疼痛可以放射到后背部[1]。但值得重视的是近年来中老年甚至青年患者发病率呈逐年升高趋势,部分患者往往起病隐匿,表现极不典型,病情重,预后差,其中相当比例患者首诊就诊于急诊科。现回顾性分析中日友好医院急诊科诊治的5例不典型急性主动脉综合征患者临床资料,结合文献分析如下。
1 资料与方法
患者1,男,74岁,主因“吞咽困难1周,呕血伴黑便2 d”于2012年10月5日收入本院急诊科。患者于入院前1周无明显诱因出现吞咽困难,进食明显减少,未予诊治。2 d前出现呕少量鲜血,约30 mL,伴黑便1次,伴右上腹痛、大汗,并出现一过性意识不清,持续约10 min自行转清,无四肢抽搐、二便失禁,无胸闷、胸背痛,由120送入本院急诊,收入抢。入院查体:T 36.5 ℃,P 104次/min,R 23次/min,BP 100/60 mmHg(1 mmHg=0.133 kPa),意识清,贫血貌,双侧瞳孔等大等圆,d 3 mm,对光反射存,浅表淋巴结未触及,颈无抵抗,双肺呼吸音粗,无明显干湿啰音,律齐,腹软,右上腹压痛无反跳痛,肝、脾触诊不满意,肠鸣音3次/min,双下肢无水肿。双病理征阳性。
辅助检查:血常规、血生化、血氨未见明显异常;心梗五项:BNP、TnI均(-),D-二聚体1800 ng/mL ;腹部B超示脂肪肝,胆囊餐后,壁厚不光滑,胆囊炎?右肾囊肿;胸正位片:双肺纹理粗,左上肺陈旧病灶,心影增大;头CT:双基底节、放射冠多发脑梗死。
入院诊断考虑:吞咽困难、上消化道出血待查:食管占位?急性胆囊炎?入抢后予以禁食水、抗感染、抑酸、输血、适当补液营养支持治疗,并进一步行胸腹部CT检查,提示后纵隔软组织结节灶,与食管下段分界不清。
经上述处理,患者仍频繁出现腹痛伴气短,伴少量呕鲜血,并出现背痛,较剧烈。治疗效果不满意,与放射科进行讨论,共同阅片后发现:食管内肿物似与主动脉相连。见图1所示。
予以心包穿刺并留置导管引流血性液体共约200 mL,家属拒绝进一步检查治疗,患者于1 h后突发意识丧失,呼吸停止,家属拒绝有创抢救,宣布死亡 。最终诊断为主动脉夹层(Ⅰ型可能)。
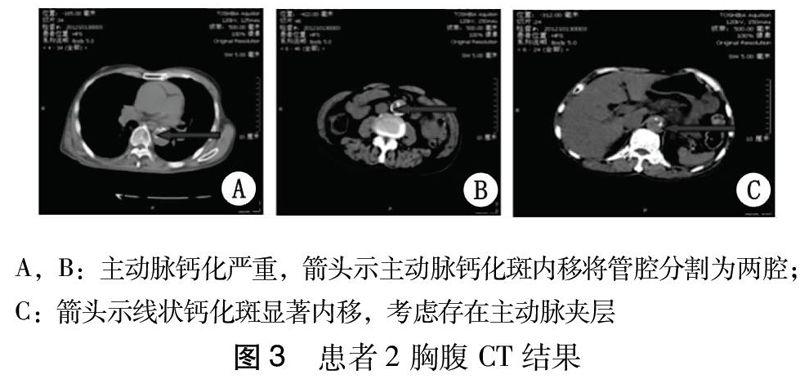
患者3,男,46岁。因“上腹不适6 h”于2012年10月27日急诊入院。患者6 h前睡醒后突发上腹不适,伴恶心,呕吐胃内容物1次,呕吐物不含血及咖啡样物。行心肌酶化验:cTnI(-),血常规WBC 22.9×109/L,N 92%,Hb 143 g/L,PLT 206×109/L,为进一步治疗收入抢。既往史:高脂血症。未正规用药治疗。查体:T 38.5 ℃,P 95次/min,R 27次/min,BP:左146/100 mmHg,右150/99 mmHg,SPO299%。神志清楚,急性病容。心肺无殊。腹平坦,上腹压痛(+)无反跳痛,未触及包块。肝脾未触及。双下肢无水肿。入抢救室后复查WBC 20.67×109/L,N 86.6%,Hb 141 g/L;生化:淀粉酶142 U/L、脂肪酶742 U/L,Urea 6.07 mmol/L,Cr 123 μmol/L,电解质正常。心梗肌红蛋白126 ng/mL,肌钙蛋白I<0.05 ng/mL,BNP <5 pg/mL,D-二聚体5000 ng/mL。ECG示V4-V6 T波倒置。立位腹平片未见异常。床旁超声示腹主动脉明显增宽。急行主动脉CTA检查,示主动脉壁呈环形增厚,主动脉真腔发生变形并变细。见图4。最终诊断为主动脉壁内血肿。
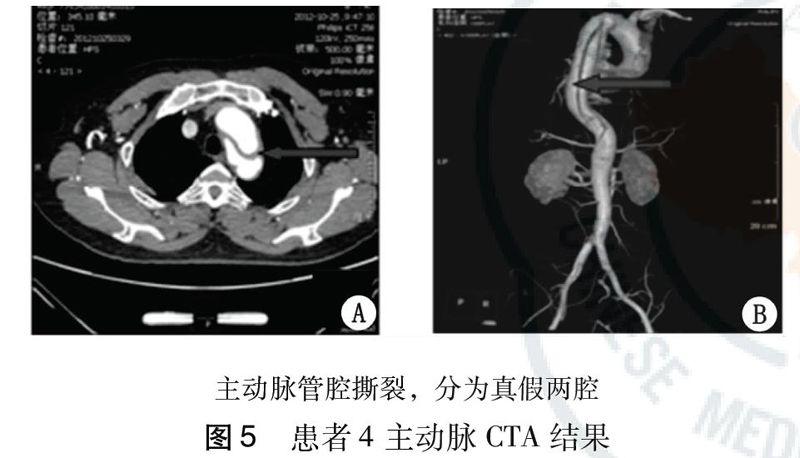
患者4,男性,29岁,主因“腰部不适1 d”就诊于2012年12月25日急诊。患者于1 d前晨起伸腰后突发腰部不适,伴脐周隐痛,排黄色软便一次,量少,予外院抗感染、解痉对症治疗后(头孢类、山莨菪碱)腹痛较前有所缓解返家。患者返家睡眠过程中再次感腰痛加剧,遂于凌晨3:00就诊于本院急诊。既往体健。入院查体:意识清晰,急性病容,双肺呼吸音清,未闻及干湿啰音。HR 90次/min,律齐,未闻及病理性杂音。腹软,脐周轻压痛,无反跳痛,肠鸣音7~9次/min,腹主动脉未闻及杂音。双肾区无叩痛。入院测血压230/120 mmHg,行床旁心电图示窦性心律,V1-V5导联ST段压低0.05~0.1 mV,因患者血压升高显著,立即监测双上肢血压:左上肢血压240/125 mmHg,右上肢血压230/120 mmHg,测双侧桡动脉、股动脉、足背动脉搏动对称。立即予以盐酸乌拉地尔持续泵入降压治疗,同时复查血常规、血生化功能、胰腺功能、心肌酶及凝血功能均未见异常,D-二聚体1.46 mg/L(参考值0~0.5 mg/L),行腹部CT、腰椎正侧位片及尿常规均未见异常。考虑到患者青年男性,无任何病史,在体位改变后突发腹痛,持续时间长,且血象无明显升高,应用抗生素后无缓解,一般感染性腹痛诊断证据不足,且患者血压明显升高,临床查体虽无明确靶器官损害征象,但仍应警惕血管疾病。急行床旁B超示腹主动脉扩张,管腔内似可见絮状漂浮物。强烈建议患者继续留观并积极联系行急诊胸腹主动脉CTA检查。见图5。最终诊断为主动脉夹层(Ⅲ型),转入血管外科进一步行手术治疗。最终诊断: DeBaKeyⅢ型主动脉夹层。患者5,男,33岁,因“突发双下肢无力半小时”于2008年7月8日入院。患者于入院前半小时余由坐位起身时突发双下肢无力并摔倒在地,不能站立行走,进行性加重,伴胸闷、腰痛,无胸背痛,无头晕、头痛,无意识丧失、二便失禁。既往史体健 。入院查体:T 36.5 ℃,P 59次/min,R 19次/min,Bp 135/50 mmHg 。意识清晰,双侧瞳孔等大等圆,d 3 mm,对光反射存,颈无抵抗,心肺腹查体未见异常,双侧足背动脉未扪及搏动。脑神经正常,双上肢肌力正常,双下肢肌力1级,肌张力低,病理征阳性,T3以下痛触觉及音叉震动觉减退。入院查血常规、生化全项、心电图及头CT均未见异常,凝血功能:PTA 45%,D-二聚体>20 mg/L,考虑患者无神经系统定位体征,结合查体患者存在椎体束征及感觉平面异常体征,结合有腰痛,考虑脊髓病变可能,但不能解释双足背动脉无法扪及,该体征提示患者主动脉异常并影响了从主动脉发出的供应脊髓的节段性动脉供血,进而导致脊髓缺血。立即行主动脉CTA提示患者存在主动脉夹层。最终诊断:主动脉夹层(Ⅰ型)。
2 讨论
急性主动脉综合征又称为急性胸痛综合征,它包括一组有相似临床症状的异质性疾病:主动脉夹层(AD),壁内血肿(IMH),穿透性动脉粥样硬化性溃疡(PAU)。该组疾病由Vilacosta 和San Roman[2]于2001年首先提出,而在2009年Vilacosta 等[3]又加入了第四种病变即主动脉不完全夹层,指主动脉壁有裂伤而内膜尚未完全撕裂,血流尚未完全穿透病变中层。该组疾病患者往往首先就诊于急诊并具有非常相似的临床表现,但其潜在的病生理机制却是完全不同的。在某些病例中往往在同一患者身上可同时出现这组疾病中数种甚至全部病理改变,这也提示该组各个疾病间是有密切联系的甚至可以相互转化。主动脉炎、主动脉腔内血栓及外伤所致主动脉撕裂具有不同的临床表现及病生理特点,因此不归类于这组疾病。
AD始于主动脉内膜撕裂,血流穿透病变中层,主动脉壁分离层之间被血流充盈成为假腔。值得重视的是夹层导致的器官缺血表现往往易与其他疾病混淆,从而延误诊治,约30%~50%的患者由于夹层假腔压迫甚至闭塞真腔而出现器官缺血的表现。 在夹层形成过程中,主动脉分支血管的阻塞使血流受影响,如冠状动脉、头臂干动脉、肋间动脉、肾动脉、肠系膜动脉、髂动脉等,引起相应组织缺血、灌注不良。心肌灌注不良的发生率为7%,脑灌注不良发生率为5%~46%,脊髓灌注不良发生率为4%,腹腔脏器灌注不良发生率为25%~30%,下肢灌注不良发生率为25%[4-5]。本文患者1即出现了脑灌注不足及下肢灌注不足表现,起病即为昏迷,为诊断造成了极大困难。而患者5即出现了供应脊髓的节段性动脉供血障碍,进而导致脊髓缺血。起病隐匿,病情发展迅速,预后极差。
IMH的病理基础为滋养血管的破裂导致血肿进入动脉外膜,没有内膜撕裂,实际上是主动脉中层的内涵性血肿。IMH患者一般年龄较大,多数有高血压和广泛的主动脉粥样硬化。最初表现多为胸痛(50%~74%),背痛(44%~84%),半数患者可以出现左侧胸腔积液,当升主动脉受累时可以出现心包积液。其他少见的症状有晕厥、声嘶、截瘫、肠系膜缺血、急性肾衰竭等[5-6]。患者3即虽出现上腹痛症状,高度怀疑AD,但影像学示主动脉壁呈环形增厚,主动脉真腔发生变形并变细,与典型的AD区别为它没有相应的内膜片或中层与动脉腔之间的直接交通。所以IMH的影像学特征为增厚的环形或新月形的主动脉壁内高密度区域,其形状可随时间动态改变,主动脉壁增厚>7 mm,不伴内膜撕裂和假腔[7]。
PAU是主動脉粥样硬化病变上的溃疡穿透内弹力层并在动脉中层形成血肿,并可进展为动脉瘤、假性动脉瘤、主动脉破裂及AD等。PAU多发生于>60岁的老年男性,多伴有高血压及广泛的动脉粥样硬化和钙化。早期症状为类似典型AD的胸痛和背痛(76%),急性发病者占68%,初诊时往往血压较高[8]。影像学特征为在斑块溃疡即壁在性“充盈缺损”伴有较深大的龛影,可合并局限性壁间血肿或外穿形成假性动脉瘤[8-9]。本文患者1即为老年男性,存在广泛的动脉粥样硬化和钙化,初期表象与普通上消化道出血很相像,现在回顾考虑其出血原因为腹主动脉瘤长期压迫食管导致局部黏膜缺血坏死所致,极具迷惑性。
对于急性起病,表现为剧烈胸背痛的病例临床医生一般不难考虑到该诊断,但由于本组疾病病生理的多样化及解剖结构的复杂性,对于类似上述极不典型病例目前仍缺乏敏感性及特异性俱佳的检测方法,加之主动脉增强CT实施需要一定的设备及相关人员且需要搬动患者并耗费一定的时间,不适合在急诊情况下尽早筛选AAD患者,因此,相当数目的AAS得不到及时有效的诊治。近年来,越来越多的研究已开展目的为寻找更为便捷、快速的检测手段。早期研究偏重于D-二聚体水平的阴性预测价值[10-11],Sodeck等[12]甚至提出D-二聚体水平阴性可以100%排除AAD的存在。而IRAD-Bio研究[13]指出在AAD患者发病24 h内D-二聚体水平具备较高的阴性预测值(95%),此时D-二聚体截点水平为500 ng/mL,而在患者出现症状6 h内,如D-二聚体水平超过1600 ng/mL,则提示存在AD的可能性很大,在这一时间窗内,AD患者的D-二聚体水平甚至远超急性冠脉综合征及肺栓塞患者。而在起病6 h后其他疾病D-二聚体水平也将逐渐升高。
本文患者3表现为发热、腹痛,血像明显升高,极易与感染性腹痛混淆,但其D-二聚体水平显著升高,引起首诊医师注意从而得到及时确诊。此外也有一些针对其他血清标记物的研究如心脏脂肪酸结合蛋白、金属蛋白酶、弹力蛋白片段、平滑肌肌球蛋白重链等,但由于其敏感性低或费用问题等尚未得到广泛应用[5,11]。
目前床旁超声在AAS中的应用也得到了广泛关注,该方法快捷、无创、可重复性高。经食管超声可更加清楚显示增厚、钙化、不规则的管腔及管腔内血栓的形成[2]。此外,通过超声在不同部位、不同切面的扫查还可快速明确AAS对血流动力学、心脏房室功能及瓣膜的影响[9]。本文病例4年轻患者即是床旁B超提供了诊断的关键线索。
针对AAS的治疗,目前公认主动脉腔内修复术(EVAR)是一种适宜的治疗方法。研究表明,EVAR创伤小,并发症少,甚至一些之前认为只能保守治疗无法手术的病例也可采用此方法并取得较为满意效果,因此应用越来越广泛[14]。尽管许多研究结果令人鼓舞,但EVAR的应用也存在一定局限性,它对于解剖条件的要求较高且可并发肠梗死、远端栓塞、支架移位,感染,内漏等,后果常较严重[1]。此外,对于降主动脉应用该方法的远期疗效仍需进一步评估[15]。
AAS患者病情危急,须及时诊断和治疗,虽然目前已有越来越多的血清及影像学检查帮助诊断,但是不典型急诊AAS患者的早期诊断仍具有一定难度,仍缺乏快捷、敏感性和特异性俱佳的检测手段,这就需要临床医师,尤其是急诊医生提高警惕,改变对AAS的传统认识,结合临床表现及检查结果综合分析,从而不断积累临床经验,大幅提高不典型AAS的诊断率。
参考文献
[1] 卢振华,马业新. 急性主动脉综合征的诊治进展[J]. 临床心血管病杂志,2008,24(49):404-406.
[2] Vilacosta I, San Roman JA. Acute aortic syndrome[J]. Heart, 2001,85(4):365-368.
[3] Vilacosta I, Aragoncillo P, Canadas V, et al. Acute aortic syndrome: a new look at an old conundrum[J]. Heart,2009,95(14):1130-1139.
[4] Nallamothu BK, Mehta RH, Saint S, et al. Syncope in acute aortic dissection. Diagnostic, prognostic and clinical implications[J]. Am J Med, 2002,113(6):468-471.
[5] Frangiskos P, Emmanuel K, Alexandros P, et al. Diagnosing acute aortic syndromes: The role of specific biochemical markers[J]. Int J Cardiol, 2010,145(1):3-8.
[6] Elena C, Ramzi R, Peter D, et al. Intramural aortic hematoma definitive diagnosis combining computed tomography and magnetic resonance imaging[J]. J Am Coll Cardiol, 2011,58(16):e30.
[7] Kang N, Edwards MG. Intramural aortic hematoma syndrome[J]. Ann Thorac Surg, 2001,71(1):374.
[8] Ryan W, Brooks L, Peter S. Penetrating atherosclerotic aortic ulcer[J]. West J Emerg Med, 2010,11(5):528-529.
[9] Booher AM, Eagle KA, Bossone E. Acute aortic syndromes[J]. Herz, 2011,6(36):480-487.
[10] Weber T, Hgler S, Auer J, et al. D-dimer in acute aortic dissection[J]. Chest, 2003,123(5):1375-1378.
[11] Mir MA. Aortic dissection-in pursuit of a serum marker[J]. Am J Emerg Med, 2008, 26(8): 942-945.
[12] Sodeck G, Domanovits H, Schillinger M, et al. D-dimer in ruling out acute aortic dissection: a systematic review and prospective cohort study[J]. Eur Heart J, 2007,28(24):3067-3075.
[13] Suzuki T, Distante A, Zizza A, et al. Diagnosis of Acute Aortic Dissection by D-Dimer : The International Registry of Acute Aortic Dissection Substudy on Biomarkers (IRAD-Bio) Experience[J]. Circulation,2009,119(20):2702-2707.
[14] Ian MN, Robert JH, Ian ML, et al. Management of Acute Aortic Syndrome and Chronic Aortic Dissection[J]. Cardiovasc Intervent Radiol, 2011,34(5):890-902.
[15] Di Eusanio M, Russo V, Buttazzi K, et al. Endovascular approach for acute aortic syndromes[J]. J Cardiovasc Surg, 2010,51(3):305-312.
(收稿日期:2014-02-11)
(本文編辑:郑辛甜)
P1043-4046
