硅基负载全氟丁基磺酰亚胺催化纤维素的水解
2014-10-20冯菊红任小菲马忠华
冯菊红,熊 蕾,,任小菲,马忠华*
1.武汉工程大学化工与制药学院,湖北 武汉 430074;2.华中农业大学理学院化学系,湖北 武汉 430070
0 引 言
非食用纤维素在自然界含量丰富,是生物能源及生产高附加值化工品的理想原料.纤维素由脱水葡萄糖单元(AGU)构成,单元间通过β-1,4糖苷键连接.在催化剂作用下,纤维素可水解转化为液体燃料和5-羟甲基呋喃甲醛等产品[1-2].
固体酸催化纤维素水解的策略,有利于催化剂循环使用,降低成本及对环境的影响,在催化剂回收、产品分离等方面有望克服均相催化的一些缺陷[3-14].Rinaldi等[4]首先报道了Amberlyst树脂催化离子液体中纤维素的可控解聚,树脂再生后可循环使用[15].Suganuma 等[5-7]报道了含SO3H,COOH和OH多官能团的无定型碳催化纤维素水解,能简单回收利用.其他一些固体酸催化也被报道,如磁性 Fe3O4-SBA-SO3H[10-11],SO3H功能化离子液体修饰的二氧化硅[12],拟纤维素酶磺化氯甲基聚苯乙烯树脂[13],超酸S2O-28/ZrO2-SiO2-Sm2O3[14]等等.催化剂的强酸性及多官能团的协同效应,往往有利于纤维素水解过程[3,15].
据报道有一种介孔二氧化硅负载的全氟丁基磺酰亚胺固体酸 PSFSI-MSMA15/SiO2(图1)[16-17],具有良好的耐水性,在酯化反应中至少循环使用7次.本研究将PSFSI-MSMA15/SiO2用于催化离子液体中的纤维素水解,获得较好的还原糖(TRS)和5-羟甲基呋喃甲醛(HMF)产率,对影响产物产率的因素及催化剂可循环使用性进行了进一步考察.
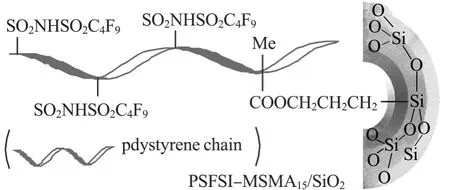
图1 固体酸PSFSI-MSMA15/SiO2的结构Fig.1 Structure of PSFSI-MSMA15/SiO2
1 实验部分
1.1 试剂与仪器
常规合成溶剂均为国产分析纯试剂,使用前预处理.离子液体1-丁基-3-甲基咪唑氯([C4C1IM]Cl,质量分数为99%,J&K);5-羟甲基呋喃甲醛(HMF,质量分数>99%,Aldrich);微晶纤维素(超级纯,上海恒信)直接使用;二氧化硅负载全氟丁基磺酰亚胺为实验室自制,酸含量0.66mmol/g,比表面233m2/g,孔径3.8~6.6nm.
Agilent 1200型高效液相色谱仪(美国Agilent公司),含 VWD检测器/XDB-C18柱(250mm×4.6mm,5μm),或 RID检测器/Ca-NP10柱(7.8×300mm,10μm);Avatar 330傅里叶变换红外波谱仪;UV-2450紫外光谱仪;Varian Infinityplus-400核磁共振仪.
1.2 PSFSI-MSMA15/SiO2 催化纤维素水解
取0.20g纤维素溶于3.8g[C4C1IM]Cl,100℃加热3h使完全溶解.加入去离子水,调节到预定反应温度,持续搅拌20min使析出的纤维素重新溶解,并稳定体系温度.加入PSFSI-MSMA15/SiO2开始反应.间隔一定时间抽取约100μL反应液,准确称量 (M1),立即用3mL去离子水淬灭.所获得的样品溶液用微孔膜过滤,备用.
1.3 产物分析
还原糖(TRS)产率采用3,5-二硝基水杨酸法(DNS)测定[18].将1.5mL DNS试剂,0.2mL上述1.2节所制备用液(准确称量,M2),以及1.8mL去离子水加入20mL具塞刻度试管,100℃加热5min,冷至室温,去离子水稀释定容,在540nm进行UV-vis检测.
5-羟甲基呋喃甲醛(HMF)和葡萄糖的产率通过HPLC检测.移液枪移取1 000μL上述样品溶液(准确称量,M3).进样10μL,流速0.5mL/min.HMF检测,柱温35℃,流动相水-甲醇(80∶20,v∶v),VWD 检测(284nm);葡萄糖检测,柱温80℃,流动相去离子水,RID检测器.
根据标样工作曲线计算产品浓度(R>0.999),TRS产率基于葡萄糖工作曲线计算.质量和产率分别采用下面的式子进行计算.MT/G/H分别是TRS/葡萄糖/HMF的质量;M0为反应溶液总质量.TRS产率基于葡萄糖分子量计算.

2 结果与讨论
2.1 反应条件对水解产物的影响
酸催化纤维素水解的复杂的产物体系,明显受反应温度影响.不同温度下,产物随时间的变化如图2所示.摩尔百分数10%的PSFSI-MS-MA15/SiO2为催化剂,水的用量为投入纤维素所含AGU单元的摩尔量的2倍(记作nAGU∶nH2O=1∶2).
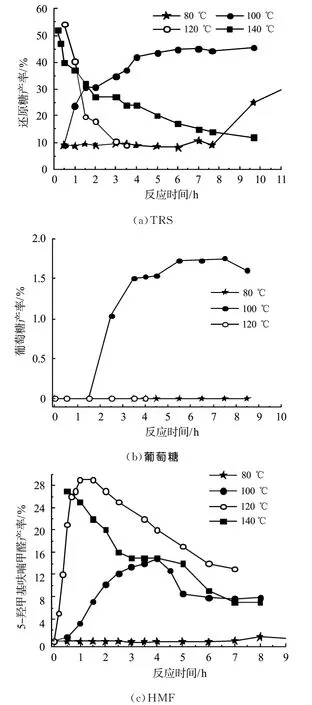
图2 PSFSI-MSMA15/SiO2催化水解产物随时间的变化Fig.2 Time courses of PSFSI-MSMA15/SiO2-catalyzed hydrolysis products
初步的实验结果表明,最大葡萄糖产率仅约2%,120℃时,HMF和TRS产率分别达到约29%和54%.升高反应温度到140℃时,HMF产率27%,但在30min内产生大量黑色不溶物,表明反应温度过高,导致更多胡敏素等降解产物产生.低于100℃,水解效果不明显,见图3.因而,笔者选择TRS和HMF在120℃下,进行进一步条件优化.
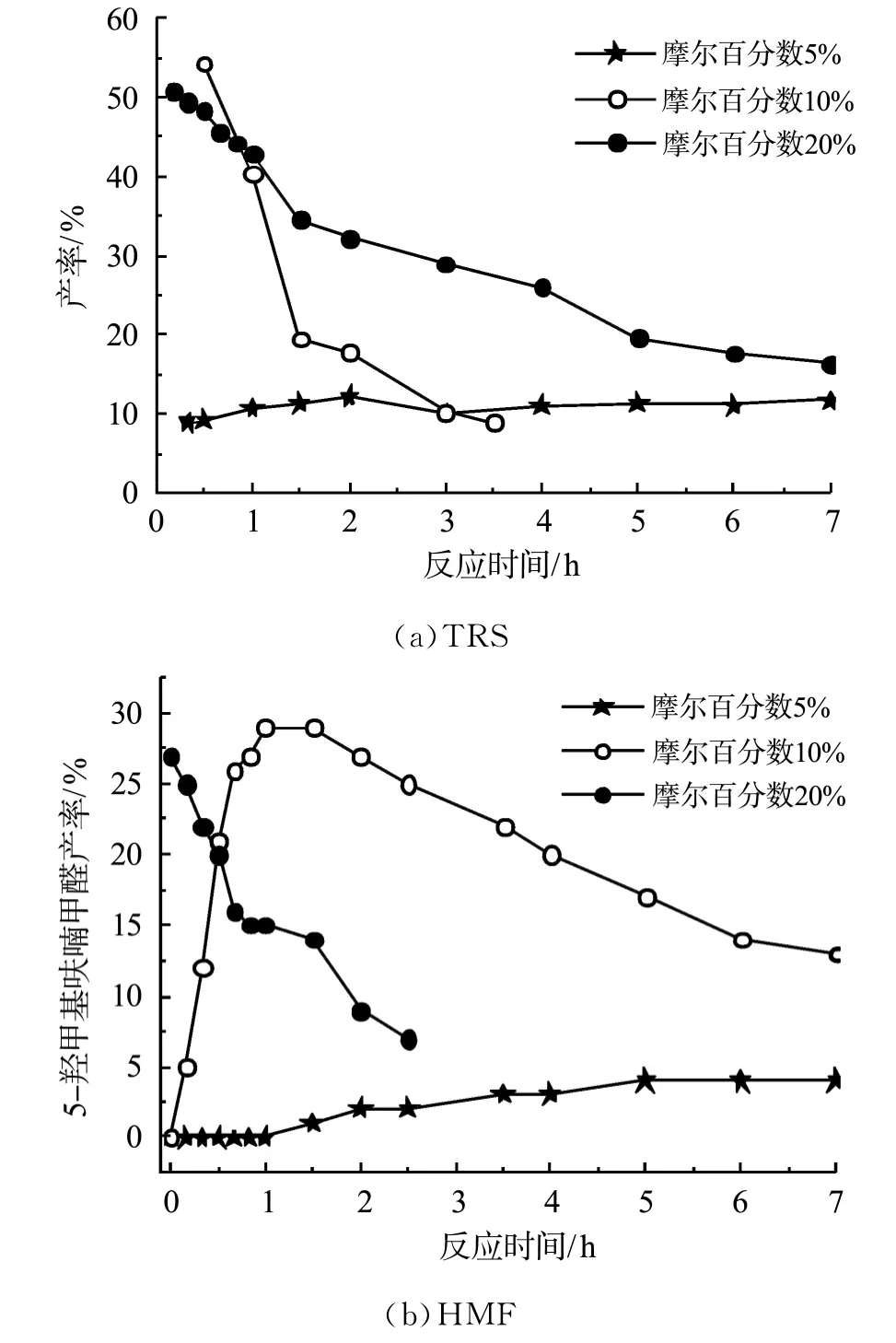
图3 PSFSI-MSMA15/SiO2对水解产物的影响Fig.3 Influence of PSFSI-MSMA15/SiO2dosage on hydrolysis products
使用摩尔百分数为5%~20%的催化剂(基于纤维素中AGU摩尔量),产物变化如图4所示.催化剂用量增加到摩尔百分数20%,水解反应速率明显加快.10min内,TRS和HMF产率分别达到51%和27%,然后明显下降.相反,使用摩尔百分数5%的催化剂,催化效果并不明显,仅仅12%TRS产率和4%HMF产率.如上所述,用摩尔百分数10%的催化剂,获得54%TRS产率和29%HMF产率.因而,优化的催化剂用量为摩尔百分数10%.
进一步考察水的用量对水解反应的影响.基于AGU单元的摩尔数,使用1~8倍摩尔量的水(依次记作nAGU∶nH2O=1∶1~1∶8),不同产物产率随时间的变化,及不同含水量体系中产率的变化规律如图4所示.
水用量对产率有明显影响.用水量(nAGU∶nH2O)从1∶1变化到1∶5时,在30min内,TRS产率上升到67%,但是进一步增加水用量到1∶6~1∶8,产率减少到62%~60%[图4(c)].在反应体系中,水是纤维素β-1,4糖苷键水解必须的试剂,但过量的水对纤维素的溶解性产生不利影响,也不利于后续的脱水降解.
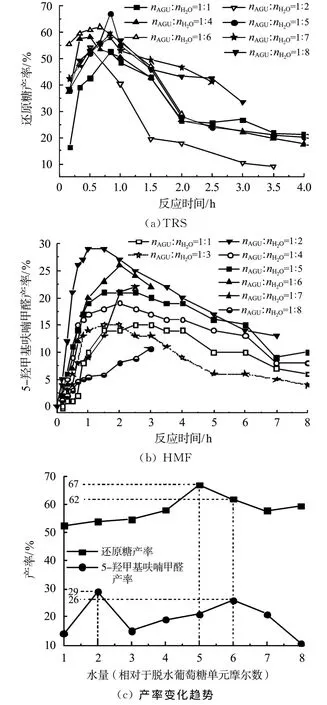
图4 水的用量对水解产物的影响Fig.4 Influence of water content on hydrolysis products
反应1.5~2h,HMF获得最大29%的产率(nAGU∶nH2O=1∶2),而后随着用水量增加,下降到15%,然后再次上升到第二高值26%(nAGU∶nH2O=1∶6).而后,HMF产率下降到约11%.众所周知,HMF一般经过水解产生的己糖脱水生成.在这个反应中,较少量的水比较有利于水解产物的脱水,而较多量的水会限制水解产物的脱水程度,因而HMF产率下降到15%.从实验结果来看,用水量在1∶3~1∶5之间,对糖苷键的裂解是比较有利的.相应地,TRS产率逐渐增加到最大值和第二大值,67%(nAGU:nH2O=1∶5)和62%(nAGU∶nH2O=1∶6).当用水量较大时,有利于水解过程产生足够的可进一步转化的己糖.因而,使用1∶3~1∶6摩尔量的水,HMF产率能保持在26%.用水量进一步增加则导致水解和进一步的脱水效率降低,TRS和HMF产率降低.
本实验结果与文献结果有所不同.Rinaldi等[4,15]报道,相似水解条件下,Amberlyst 15DRY催化得到13%TRS产率和48%纤维素转化率,未转化纤维素能分离回收.在本研究的实验中,在反应2.5h后,并未分离到可回收的纤维素残渣.
FT IR用于分析不同温度下纤维素的转化(图5).在上述优化条件下,不使用 PSFSI-MSMA15/SiO2,处理后的纤维素在1 166,1 068cm-1处出现两个清晰的强峰.其中,1 166cm-1吸收峰受到催化剂在1 172cm-1(S—O)处的特征吸收干扰[16].最强峰1 068cm-1(C—O 伸缩振动)可被用于鉴定纤维素.
在80℃和100℃,反应2.5h后仍能清晰观察到1 068cm-1峰,表明纤维素转化不完全.延长水解时间到4.5h,吸收峰消失(图5(b)).提高反应温度到120℃,峰信号在1.5h内变得模糊,在2.5h完全消失(图5(c)),表明纤维素在120 ℃下,2.5h内完全转化为水溶性产物.
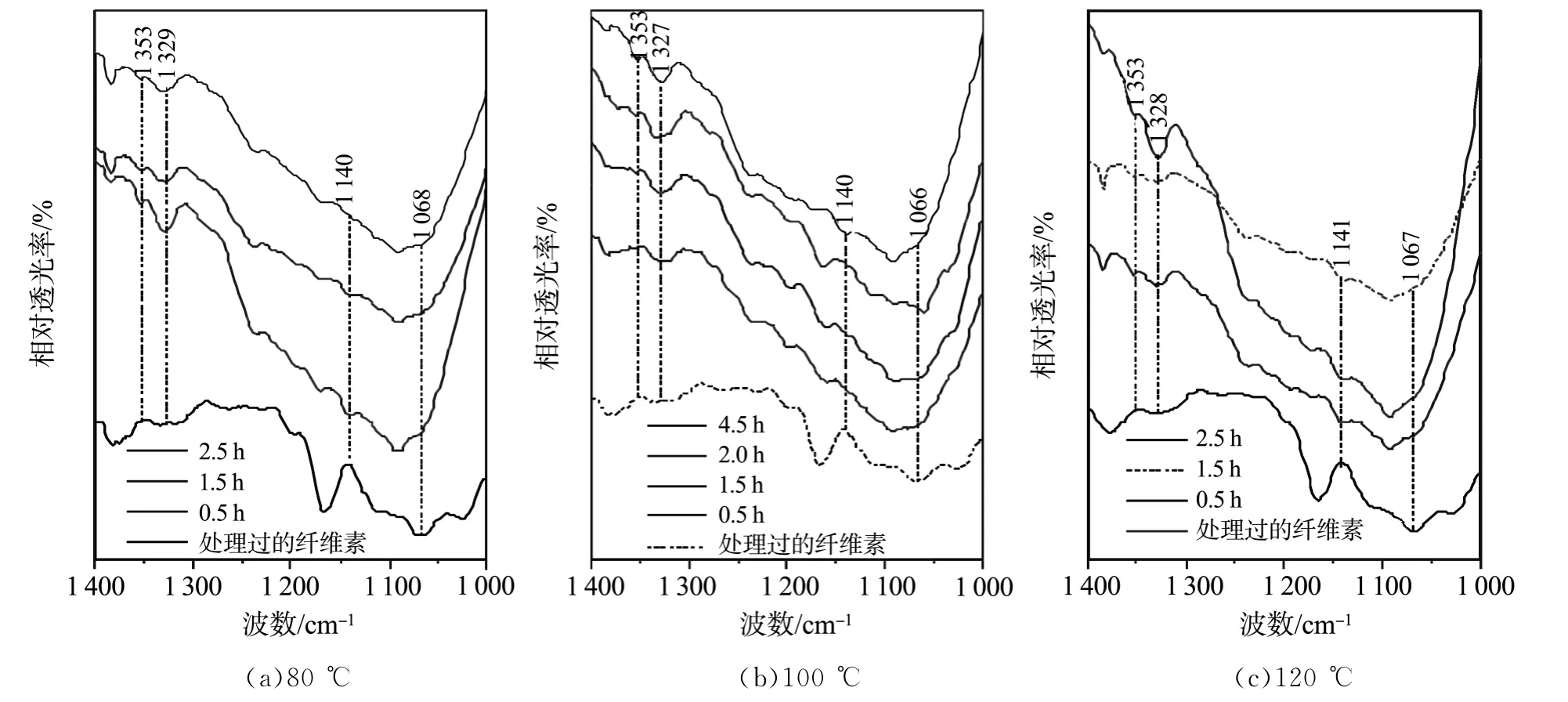
图5 不同温度下水解固体残渣的FT IR图Fig.5 FT IR spectra of solid residues under different hydrolysis temperatures(offset for clarity)
2.2 纤维素水解机理
在纤维素水解过程中,糖苷键O—位点质子化是第一步(图6).由于糖苷氧具有弱碱性,水解必须强酸催化[15,19-20].
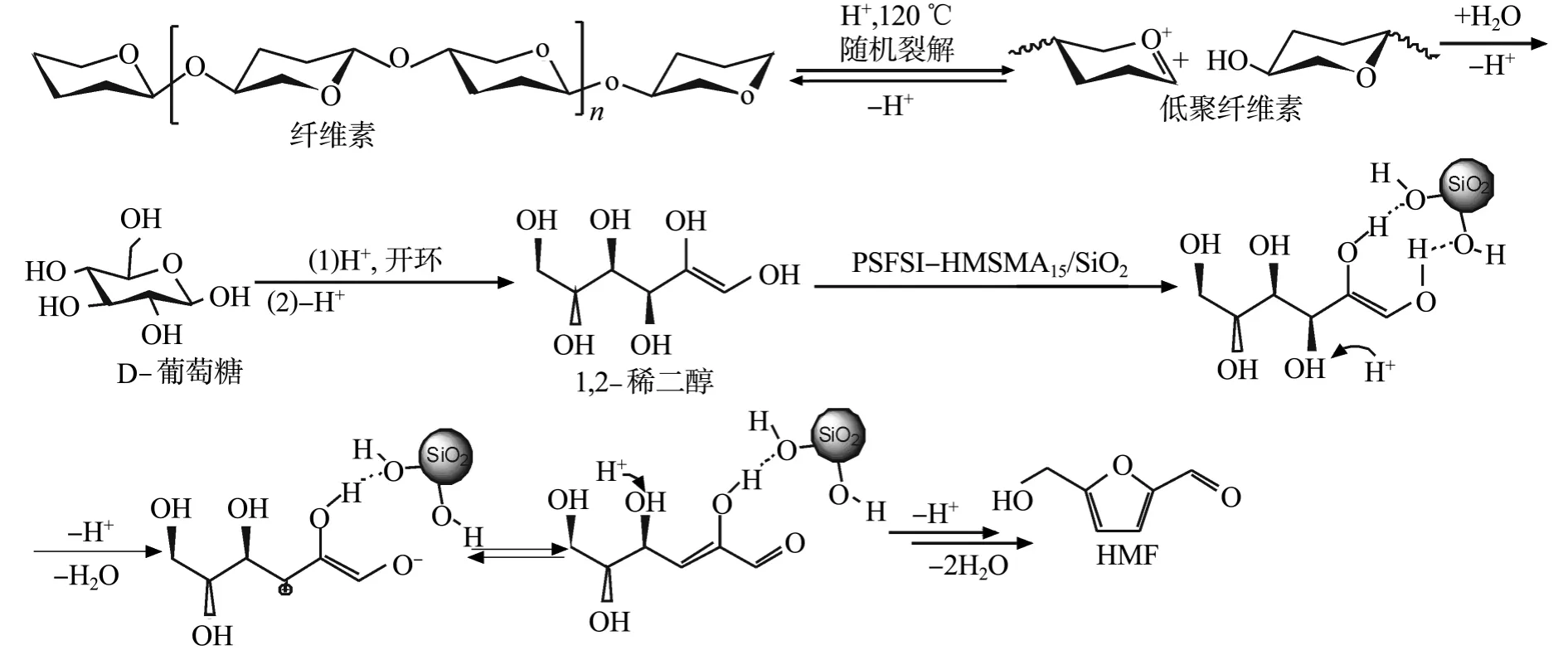
图6 PSFSI-MSMA15/SiO2催化纤维素水解的机理Fig.6 Proposed mechanism for cellulose hydrolysis over PSFSI-MSMA15/SiO2
笔者采用13C-丙酮为探针分子,采用固体核磁测定了PSFSI-MSMA15/SiO2酸强度,如图7所示.其中,231.0峰尽管较弱但很清晰,对应于较低含量的SO2NHSO2C4F9强酸位点.这表明PSFSI-MSMA15/SiO2酸强度明显强于介孔硅 MSUSO3H(化学位移217.2)和粘土 HZSM-5(化学位移223)[16],是一类典型的强酸.
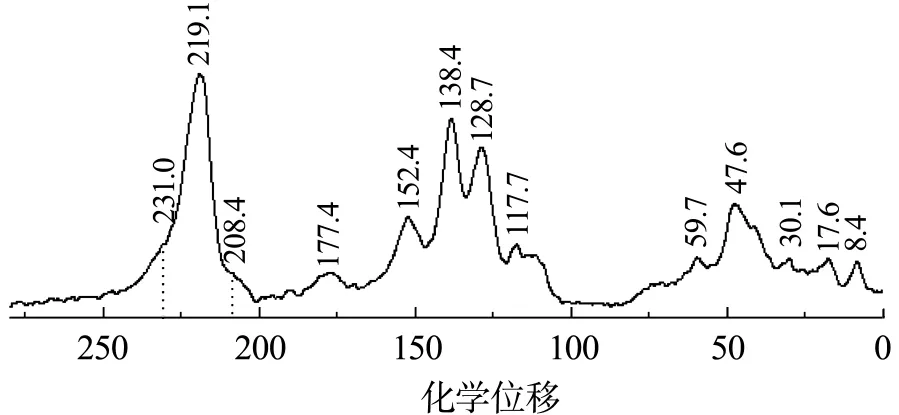
图7 PSFSI-MSMA15/SiO2吸附13 C-丙酮分子探针的13 C CP/MAS谱图Fig.7 13 C CP/MAS spectrum of acetone-2-13 C adsorbed on PSFSI-MSMA15/SiO2
在离子液体体系中,可利用强酸的酸强度而避免水的拉平效应的影响.笔者推断,PSFSI-MSMA15/SiO2的强酸性有力促进糖苷键的质子化过程,糖苷键继而随机裂解,产生低聚糖及己糖[15,19].己糖在 PSFSI-MSMA15/SiO2强酸性及Si—OH的协同作用下,迅速脱去三分子水,降解产生 HMF[21].
2.3 PSFSI-MSMA15/SiO2 可循环使用性
所有水解回收残渣的FT IR谱图中,能清晰观察到1 353cm-1(C—F)峰,而且不受处理过的纤维素的特征峰干扰[16].此外,1 328cm-1(O —S—O)和1 140cm-1(C—F)峰也很明显,不过受到部分干扰.这些特征峰的出现表明,PSFSIMSMA15/SiO2在这个催化体系中是稳定的,见表1.
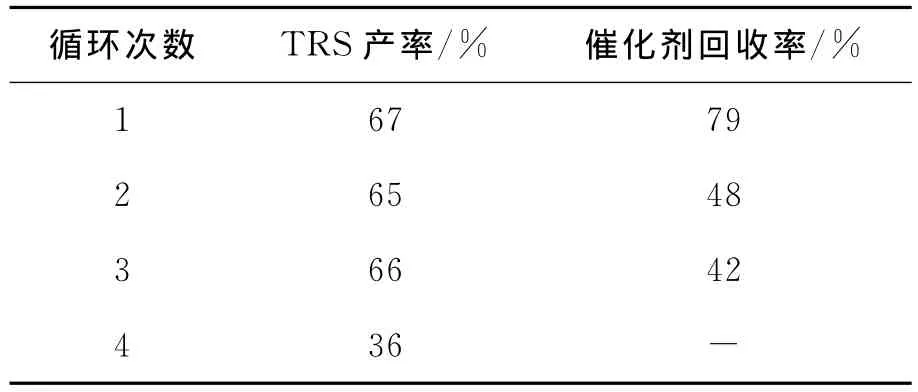
表1 PSFSI-MSMA15/SiO2a的循环使用结果Table 1 Recycling results of PSFSI-MSMA15/SiO2a
PSFSI-MSMA15/SiO2在催化过程中,会释放H+进入纤维素/[C4C1IM]Cl溶液[15],因而,需要用6mol/L HCl进行再生.丙酮可除去其中深色物质.使用新鲜催化剂获得67%TRS产率(表1),催化剂再生后,至少在随后两轮催化反应中保持活性没有明显损失,TRS产率分别为65%和66%.但在第四次循环使用过程中,产率降低至36%.其中原因需进一步进行研究.催化剂3次回收率依次为79%,48%和42%.粉状催化剂在过滤、再生过程中存在一些损失.
3 结 语
介孔硅负载全氟丁基磺酰亚胺(PSFSI-MSMA15/SiO2)可用作纤维素水解的有效催化剂,循环使用3次,没有明显活性损失,是一类有应用前景的耐水性固体酸.水解反应最高获29%HMF产率和67%TRS产率.
[1]CHHEDA J N,HUBEI G W,DUMESCI J A.Liquid-phase catalytic processing of biomass-derived oxygenated hydrocarbons to fuels and chemicals chem[J].Angewandte Chemie International Edition,2007,46(38):7164-7183.
[2]BINDER J B,RAINES R T.Fermentable sugars by chemical hydrolysis of biomass[J].Journal of American Chemistry Society,2009,131(5):1979-1985.
[3]HUANG Y B,FU Y.Hydrolysis of cellulose to glucose by solid acid catalysts[J].Green Chemistry,2013,15(5):1095-1111.
[4]RINALDI R,PALKOVITS R,SCHUTH F.Depolymerization of cellulose using solid catalysts in ionic liquids[J].Angewandte Chemie International Edition,2008,47(42):8047-8050.
[5]SUGANUMA S,NAKAJIMA K,KITANO M,et al.Hydrolysis of cellulose by amorphous carbon bearing SO3H,COOH,and OH groups[J].Journal of American Chemistry Society,2008,130(38):12787-93.
[6]KITANO M,YAMAGUCHI D,SUGANUMA S,et al.Adsorption-enhanced hydrolysis ofβ-1,4-glucan on graphene-based amorphous carbon bearing SO3H,COOH,and OH groups[J].Langmuir,2009,25(9):5068-5075.
[7]SUGANUMA S,NAKAJIMA K,KITANO M,et al.Synthesis and acid catalysis of cellulose-derived carbon-based solid acid[J].Solid State Science,2010,12(6):1029-1034.
[8]ZHANG Z,ZHAO Z K.Solid acid and microwave-as-sisted hydrolysis of cellulose in ionic liquid[J].Carbohydrate Research,2009,344(15):2069-2072.
[9]KOBAYASHI H,KOMANOYA T,HARA K,et al.Water-Tolerant mesoporous-carbon-supported ruthenium catalysts for the hydrolysis of cellulose to glucose[J].Chem Sum Chem,2010,3(4):440-443.
[10]LAI D M,DENG L,GUO Q X,et al.Hydrolysis of biomass by magnetic solid acid[J].Energy & Environment Science,2011,4(9):3552-3557.
[11]LAI D M,DENG L,GUO Q X,et al.Hydrolysis of cellulose into glucose by magnetic solid acid[J].Chem Sus Chem,2011,4(1):55-58.
[12]ONDA A,OCHI T,YANAGISAWA K.New direct production of gluconic acid from polysaccharides using a bifunctional catalyst in hot water[J].Catalysis Communications,2011,12(6):421-425.
[13]SHUAI L,PAN X.Hydrolysis of cellulose by cellulase-mimetic solid catalyst[J].Energy & Environment Science,2012,5(5):6889-6894.
[14]CHEN H,YU B,JIN S.Production of levulinic acid from steam exploded rice straw via solid superacid,S2O82-/ZrO2-SiO2-Sm2O3[J].Bioresource Technology,2011,102(3):3568-3570.
[15]RINALDI R,MEINE N,STEIN J V,et al.Which Controls the Depolymerization of Cellulose in Ionic Liquids:The Solid Acid Catalyst or Cellulose?[J].Chem Sus Chem,2010,3(2):266-276.
[16]YANG Q H,MA Z H,MA J Z,et al.Mesoporoussilica supported water-stable perfluorobutylsulfonylimide and its catalytic applications in esterification[J].Microporous and Mesoporous Materials,2013,172:51-60.
[17]马忠华,杨秋红,马敬中.二氧化硅负载全氟丁基磺酰亚胺的制备与耐水性研究[J].化学学报,2012,70(3):311-317.MA Zhong-hua,YANG Qiu-hong,MA Jin-zhong.Preparation and water tolerance study of SiO2-supported perfluorobutylsulfonylimide[J].Acta Chimica Sinica,2012,70(3):311-317(in Chinese).
[18]MILLER G L.Protein determination of large numbers of samples[J].Analytical Chemistry,1959,31(5):964-964.
[19]DEE S J,BELL A T.A Study of the acid-catalyzed hydrolysis of cellulose dissolved in ionic liquids and the factors influencing the dehydration of glucose and the formation of humins[J].Chem Sus Chem,2011,4(8):1166-1173.
[20]VANOYE L,FANSELOW M,HOLBREY J D,et al.Kinetic model for the hydrolysis of lignocellulosic biomass in the ionic liquid,1-ethyl-3-methyl-imidazolium chloride[J].Green Chemistry,2009,11(3):390-396.
[21]HUANG Z,PAN W,ZHOU H,et al.Nafion-resinmodified mesocellular silica foam catalyst for 5-hydroxymethylfurfural production from D-fructose[J].Chem Sus Chem,2013,6(6):1063-1069.
