罗伊氏乳杆菌葡萄糖基转移酶的生化特性及催化行为初探
2021-06-30赵新崎缪铭
赵新崎,缪铭
(食品科学与技术国家重点实验室(江南大学),江苏无锡,214122)
膳食纤维是一类不被小肠中内源性酶水解,但在结肠内可被微生物发酵利用的碳水化合物,包括天然及合成两类[1]。它具有调节血清中的血脂[2]、控制血糖浓度[3]、降低结肠癌发病率及改善免疫调节等诸多优点[4-6]。近年来,膳食纤维的制备方法主要是化学法,TRITHAVISUP等[7]通过盐酸水解及干燥等工艺制备木薯抗性糊精,MUDGIL等[8]采用纤维素酶酶解结合柠檬酸水解的方法制备部分水解的瓜尔豆胶,但这些方法存在成本高、得率低、安全性差以及易造成环境问题等缺点。酶法合成具有工艺简单、转化率高及安全环保等优点,现已成为膳食纤维的研究热点。
葡萄糖基转移酶(glucosyltransferase,GTase)是一类对淀粉及其水解产物具有转葡萄糖基作用的酶,GTase最初是在乳杆菌中被鉴定出来并被归类于糖苷水解酶70家族(glucoside hydrolases 70,GH70)中1个新的亚家族。近年来,随着研究的不断深入,在西伯利亚杆菌、黄曲霉固氮菌及嗜热链球菌中也发现了GTase的存在。GTase可以通过转糖苷作用合成新的糖苷键如α-1,2糖苷键、α-1,3糖苷键及α-1,6糖苷键等[9],进而提高不消化营养片段的含量。本实验室前期研究得到了1株产GTase的罗伊氏乳杆菌,在此基础上,本文对GTase的酶学性质及其催化行为进行了初步探究。以期为淀粉新型衍生物的创制及营养健康产业的发展提供理论指导和技术支撑。
1 材料与方法
1.1 实验材料与试剂
罗伊氏乳杆菌,实验室保藏菌种;EscherichiacoliBL21 (DE3)、质粒、胰蛋白胨、酵母提取物、氨苄青霉素、异丙基-β-D-硫代半乳糖糖苷,上海生工生物有限公司;马铃薯直链淀粉、糖化酶、猪胰腺α-淀粉酶,美国Sigma公司;麦芽糊精(DE12),上海罗盖特公司;β-淀粉酶、异淀粉酶、异普鲁兰酶、葡萄糖试剂盒,爱尔兰Megazyme公司。
1.2 实验仪器
Delta pH计(320 s型),美国Mettler-Toledo公司;电热恒温水槽(DK-8D型),上海森信实验仪器有限公司;紫外-可见光谱仪(722E型),上海翱艺有限公司;多角度激光散射系统(DAWN HELEOS-Ⅱ型),美国Watty公司;全数字化核磁共振波谱仪(Avance Ⅲ 400 MHZ型),美国Brucker公司;离子色谱仪(ICS 5000型),美国戴安公司。
1.3 实验方法
1.3.1 GTase的制备及纯化
将已构建的重组质粒转入E.coliBL21中表达,然后将重组菌接种至含氨苄的LB液体培养基中,37 ℃过夜培养。然后吸取2%(体积分数)的接种液进行下一步扩大培养,当培养到适宜阶段(OD660值0.4~0.5)时,添加异丙基-β-D-1-硫代吡喃半乳糖苷诱导蛋白表达(18 ℃,24 h),最后于4 ℃离心(8 000 r/min,15 min)收取沉淀部分。经蛋白复性、Ni2+亲和色谱柱纯化及冰浴透析得到脱盐后的目的纯酶液。SDS-PAGE实验中,上层胶的质量浓度为120 g/L,下层胶的质量浓度为40 g/L,采用的染色液为考马斯亮蓝,脱色液为5%(体积分数)的乙醇和10%(体积分数)的乙酸溶液的混合物。
1.3.2 GTase酶活力测定
以0.25%(质量分数)的马铃薯直链淀粉为底物,在乙酸钠缓冲液(pH 5.0)中加入0.3 g/L的GTase进行酶反应(40 ℃,10 min),沸水浴灭酶10 min后将混合物离心(12 000 r/min,10 min)取上清液测定OD660值。
单位酶活力(U)定义为1 min消耗1 mg的直链淀粉所需的酶量[10]。
1.3.3 GTase酶学性质
(1)为确定GTase的最适pH,在25 mmol/L的不同缓冲体系中,包括乙酸钠缓冲液(pH 4.0~6.0)、Tris-HCl缓冲液(pH 6.0~8.0)和的甘氨酸-NaOH缓冲液(pH 8.0~11.0)于40 ℃进行酶反应,以最高酶活力为100%。
(2)为研究pH对酶稳定性的影响,将纯酶液于不同缓冲液中在4 ℃下保存12 h后,于40 ℃下进行酶反应,以相对初始酶活力为100%。
(3)为确定GTase的最适温度,在不同温度范围(20~80 ℃)内于pH 5.0的乙酸钠(NaAC-HAC)缓冲液中进行酶反应,以最高酶活力为100%。
(4)为研究温度对GTase稳定性的影响,将纯酶液于恒温水浴锅(30~50 ℃)中保温不同时间后进行酶反应,缓冲体系为pH 5.0的NaAC-HAC缓冲液,以相对初始酶活力为100%。
(5)为确定各种金属离子(Li+、Co3+、Pb2+、Ni+、Na+、Fe3+、K+、Al3+、Ba2+、Mn2+、Ca2+、Mg2+、Cu2+)对酶活的影响,分别添加不同金属离子进行酶反应(pH 5.0,40 ℃)确保其终浓度为1 mmol/L,为确定Ca2+对GTase活力的影响,在添加终浓度为0~1.4 mmol/L Ca2+的条件下进行酶反应,以未添加金属离子时酶活力为100%。
(6)为研究GTase的动力学参数,以不同浓度的麦芽糊精(0.4~2 g/L)作为底物进行酶反应(40 ℃,pH 5.0),采用非线性回归方法计算Michaelis-Menten常数(Km)和反应的最大速度(vmax)。
1.3.4 GTase催化产物的合成
将麦芽糊精(DE12)以10 g/L的添加量置于乙酸钠缓冲液(50 mmol/L,pH 5.0)中,使用高压灭菌锅(121 ℃,30 min)进行糊化,然后将溶液转移至恒温循环水搅拌装置中冷却至40 ℃后保温。加入4 U/mL的GTase反应72 h后,加入3倍体积的无水乙醇醇沉产物,离心并将乙醇挥发除去后冷冻干燥备用。
1.3.5 产物结构解析
(1)高效尺寸排阻色谱-多角度激光散射-示差折光联用(HPSEC-MALL-RI)分析。样品用去离子水配制成5 g/L的溶液,用0.22 μm针头式滤膜过滤,测试条件:采用Shodex OH-pak SB-804凝胶柱;流动相为0.1 mol/L的NaNO3溶液;流速为0.5 mL/min[11]。
(2)核磁共振氢谱分析。准确称取30 mg样品于核磁管中,加入0.5 mL D2O,加热使样品溶解。探针型号:5 mm PABBO-BB,脉冲序列:zg30,测试温度70 ℃。
(3)酶指纹图谱法分析。采用的不同酶组合,组合Ⅰ:异淀粉酶;组合Ⅱ:异淀粉酶和β-淀粉酶;组合Ⅲ:异淀粉酶、β-淀粉酶和异普鲁兰酶,酶解样品。用25 mmol/L的NaAC-HAC缓冲液(pH 4.0)将样品配制成5 mg/mL的溶液,各组合中每种酶的添加量均为0.4 U,然后于40 ℃反应24 h,沸水浴灭酶(10 min),离心(120 000 r/min,10 min),取上清液过0.22 μm针头式滤膜。测试条件:采用CarboPacPA200型色谱柱;洗脱液A为NaOH溶液(150 mmol/L),洗脱液B为乙酸钠溶液(50 mmol/L)与NaOH溶液(150 mmol/L)的混合液;测试温度25 ℃。
1.3.6 产物消化性能分析
分别称取麦芽糊精(DE12)及产物各0.1 g,分别溶于NaAC-HAC(50 mmol/L,pH 5.2)缓冲溶液中,加入猪胰腺α-淀粉酶(2 900 U)和糖化酶(150 U)后进行酶反应(37 ℃,160 r/min)。在反应0、20及120 min取样。吸取0.2 mL样品后立即于1 mL无水乙醇中灭酶。采用葡萄糖试剂盒测定葡萄糖含量,具体操作可见说明书。其中易消化淀粉(rapidly digestible starch,RAS)、慢消化淀粉(slowly digested starch,SDS)和抗性淀粉(resistant starch,RS)含量的分别按公式(1)(2)(3)计算:
(1)
(2)
RS/%=100-RDS-SDS
(3)
式中:G20,水解20 min时葡萄糖的释放质量,mg;G120,水解120 min时葡萄糖的释放质量,mg;FG,游离葡萄糖的质量,mg;TS,底物的葡萄糖总质量,mg。
1.3.7 数据处理
各部分实验均重复3次,利用Origin 8.5软件对实验数据进行统计分析并作图。
2 结果与讨论
2.1 GTase分子质量
为确定GTase的分子质量,以标准蛋白的分子质量的对数值为纵坐标,以标准蛋白在SDS-PAGE上的相对迁移率为横坐标,得到标准曲线方程为:y2=-0.64x+5.27(r2=0.978)。
图1为GTase的SDS-PAGE的电泳分析图。在电泳图中,GTase的的相对迁移量为1.22 cm,通过标准曲线方程计算出GTase的分子质量为105 kDa。实验测得粗酶比酶活力为(0.15± 0.02)U/mL,纯化后的比酶活力为(0.85± 0.03) U/mL。

1-标样;2-粗酶;3-纯酶图1 葡萄糖基转移酶的SDS-PAGE分析图Fig.1 SDS-PAGE analysis of glucanotransferase
2.2 GTase酶学性质研究
2.2.1 pH对GTase酶活力及稳定性的影响
如图2-a所示,40 ℃下GTase的最适pH为5.0;在pH 5.0~6.0,GTase能够保持70%以上的酶活力;pH>8.0后,酶活迅速下降;当pH为11.0时,酶活仅剩20%。GTase与来源于Staphylothermusmarinus和LactobacillusgasseriATCC 33323的GTase具有相同的最适pH,温和的酸性条件(5.0~6.0)有利于麦芽糊精的转化[12-14]。目前为止报道的大多数GTase的最适pH为6.0~7.0[15-17],相比而言GTase较低的最适pH可能更适合应用于淀粉工业。
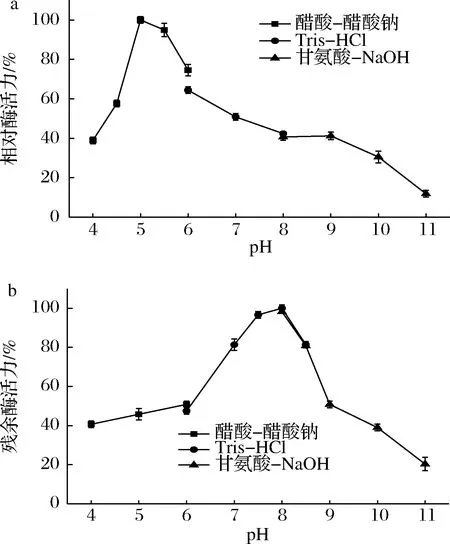
图2 pH对葡萄糖基转移酶活力(a)及稳定性(b)的影响Fig.2 Effect of pH on glucosyltransferase of activity(a)and stability(b)
如图2-b所示,GTase在pH 7.0~8.5的环境中于4 ℃保存12 h后,仍具有80%以上的残余酶活力。在pH 3.5~6.0及pH 9.0~11.0时酶活受到较强的抑制。由此可知,GTase的最佳保存pH为8.0,在该条件下保存12 h酶活力几乎不变。
2.2.2 温度对GTase酶活力及稳定性的影响
如图3-a所示,GTase的最适温度为40 ℃,在35~45 ℃,酶活力仍保持在70%以上。在50 ℃后酶活力开始迅速下降,在80 ℃时几乎为0。这可能是由于随着温度的升高,酶的结构受到破坏导致的。

图3 温度对葡萄糖基转移酶活力(a)及稳定性(b)的影响Fig.3 Effect of temperature on glucosyltransferase of activity (a) and stability (b)
如图3-b所示,在30~35 ℃下保存150 min,GTase残余酶活力均在75%以上,当温度达40 ℃后,酶稳定性迅速下降,在45 ℃下保存30 min后酶活力损失近60%,由此可知,该酶在30~40 ℃下热稳定性较好,可在此条件下实现麦芽糊精的转化。
2.2.3 金属离子对GTase酶活及稳定性的影响
如图4-a所示,Pb2+、Ba2+、Cu2+、Fe3+、Co3+和Al3+对酶活力具有不同程度的抑制作用,其中Fe3+对酶活力的抑制作用最强,残余酶活力仅剩30%。Na+和Ni2+对酶活力无明显影响,Mn2+、Ca2+、Mg2+、Li+和K+对酶活力具有不同程度的促进作用。其中Ca2+对酶活力的促进作用最强,可使酶活力达到210%,相比对照组提高了1倍多。来源于罗伊氏乳杆菌的SK24.003葡聚糖蔗糖酶也有类似的性质,在反应中添加Ca2+后可使酶活力增加到原来的4倍[18]。这可能是由于它们的结构中能够形成与Ca2+结合的配体,从而激活了供/受体底物与酶的结合[19]。
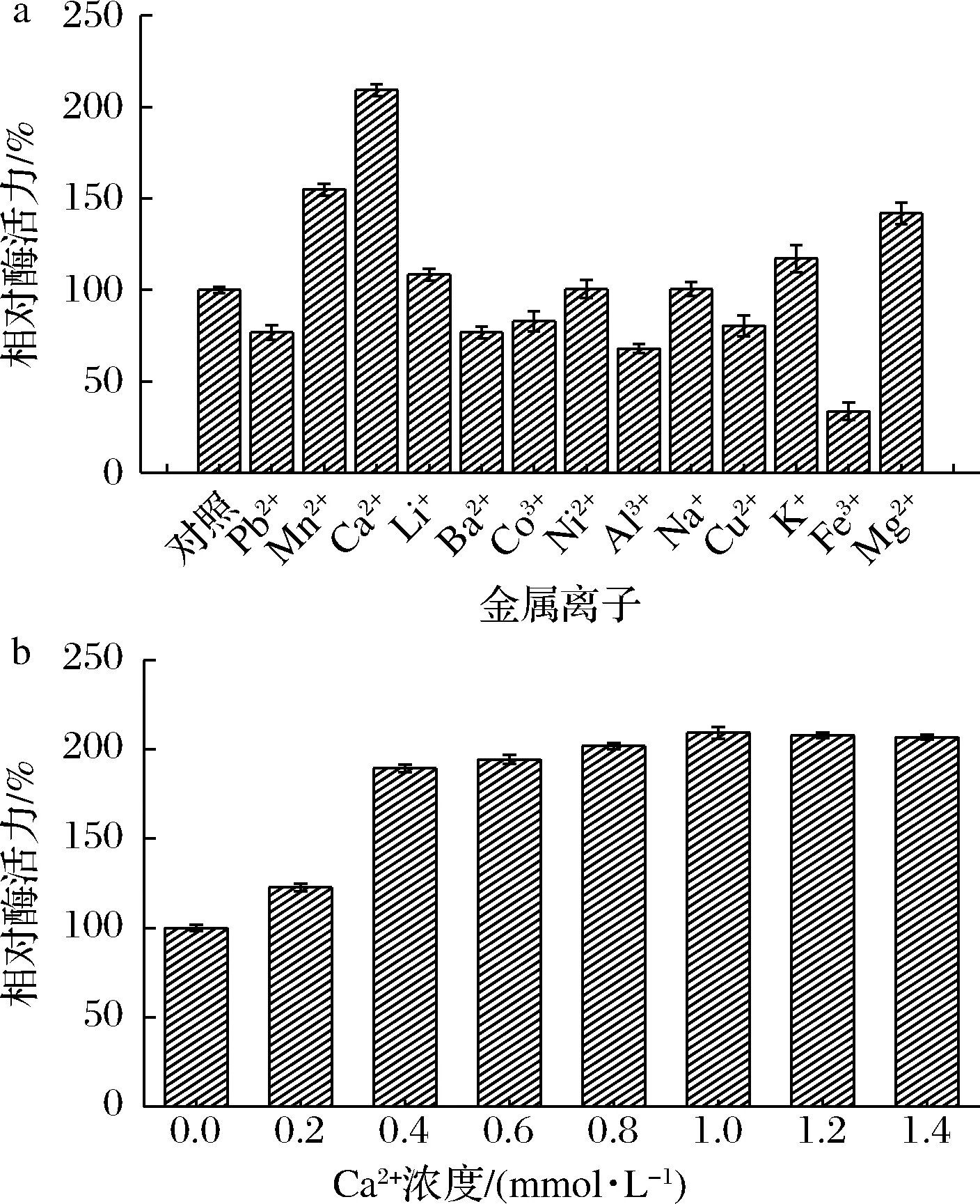
图4 金属离子(a)及Ca2+浓度(b)对葡萄糖基转移酶活力的影响Fig.4 Effects of metal ion (a) and Ca2+ concentration (b) on the activity of glucosyltransferase
由图4-b可知,当Ca2+浓度在0~1.4 mmol/L,GTase酶活力随着Ca2+浓度的增加而增加;当Ca2+浓度>1 mmol/L时,对酶的促进作用不再增加。由此可知,Ca2+的浓度为1 mmol/L时对酶的激活作用最显著,其原因可能是浓度高于1 mmol/L时,该酶和Ca2+的结合达到饱和状态。
2.2.4 酶反应动力学
底物浓度与酶促反应速率之间的关系可以由Michaelis-Menten方程表示。Km值是酶的特征常数之一,它可以近似地反应出酶与底物的亲和力大小,通常来说Km值越小,亲和力越大。以麦芽糊精(DE12)为底物,GTase的Km为(1.18±0.21)g/L,Vmax为2.6 μg/s,转化率(Kcat)和催化效率(Kcat/Km)分别为(4.72±1.4)s-1和(3.97±3.2)L/(g·s),说明GTase对麦芽糊精(DE12)具有较高的亲和力。
2.3 产物结构
麦芽糊精(DE12)及其产物的核磁共振氢谱图如图5所示,样品中α-1,6糖苷键的出峰位置在δ4.97 ppm,α-1,4糖苷键的出峰位置在δ 5.38 ppm,对峰面积进行积分处理后得出2种糖苷键的比例。发现经GTase反应72 h后,α-1,6糖苷键的比例由(3.4±0.08)%增加至(41.8±0.12)%,提高了约12倍,说明GTase具有转苷活性,可以很好的作用于麦芽糊精,并将其结构中的α-1,4糖苷键转化为α-1,6糖苷键。

图5 麦芽糊精(DE12)(a)及其产物(b)的核磁共振氢谱图Fig.5 1H NMR profiles of maltodextrin(DE12) (a) and its product (b)
GANGOITI等[20]曾报道过,利用来源于L.fermentumNCC2970的糖基转移酶对淀粉进行改性,产物中的α-1,3糖苷键可达40%,其主要是合成了α-1,4糖苷键与α-1,3糖苷键交替连接的结构。
如图6所示,麦芽糊精(DE12)的保留时间在14.1 min左右,经GTase改性后的产物的保留时间有所滞后,大概在14.9 min,重均分子质量由(1.16±0.07)×105g/mol降为(6.78±0.14)×104g/mol,这是由于GTase将麦芽糊精(DE12)水解成了相对分子质量较小的产物。此外,产物的洗脱曲线分布范围变窄,分子质量分布曲线范围变小,说明经由GTase的改性产物相对分子质量的分布更加均一。
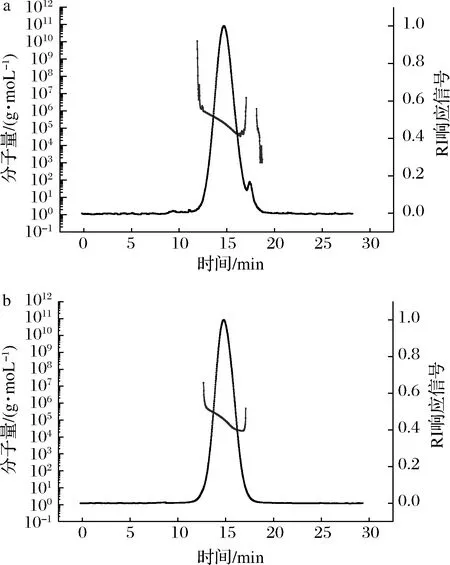
图6 麦芽糊精(DE12)(a)及产物(b)的HPSEC-MALL-RI图Fig.6 HPSEC-MALL-RI profiles of maltodextrin(DE12) (a) and product (b)
采用不同酶组合(Ⅰ、Ⅱ、Ⅲ)对产物进行水解,其中异淀粉酶专一性切割α-1-4,6分支点处的α-1,6糖苷键;β-淀粉酶专一性切割线性α-1,4糖苷键,并将其水解为麦芽糖;异普鲁兰专一性切割α-1,6-葡萄糖-α-1,4结构中的α-1,4糖苷键[21]。如图7所示,在异淀粉酶(Ⅰ)的作用下,主要产生了2种片段:被α-1,6-葡萄糖-α-1,4结构屏蔽了非还原性末端的糖链和未被屏蔽非还原性末端的糖链。这2种片段的分布范围较宽,在1~12.5 min均有不同聚合度的片段被洗脱下来。在异淀粉酶和β-淀粉酶共同水解的作用下(Ⅱ),主要产生2种片段:麦芽糖和被α-1,6-葡萄糖-α-1,4结构屏蔽了非还原性末端的糖链。在DP 2处有大量的麦芽糖被洗脱下来,在2.5 ~7.5 min,12.5~21 min被洗脱下来的片段为被α-1,6-葡萄糖-α-1,4结构屏蔽非还原性末端,其聚合度主要分布在DP 2~DP 6,也有少数分布在DP 7~DP 12。异普鲁兰酶专一性切割α-1,6-葡萄糖-α-1,4结构中的α-1,4糖苷键,这使得被α-1,6-葡萄糖-α-1,4结构屏蔽非还原性末端的糖链重新暴露出来,因而可被β-淀粉酶水解。在异淀粉酶,β-淀粉酶和异普鲁兰酶的共同作用下,被洗脱下来的片段主要分布在DP 6以内。从而解析出产物结构中α-1,6糖苷键的主要存在形式有以分支点形式存在的α-1,6-葡萄糖-α-1,4结构和α-1-4,6分支点及线性α-1,6糖苷键。
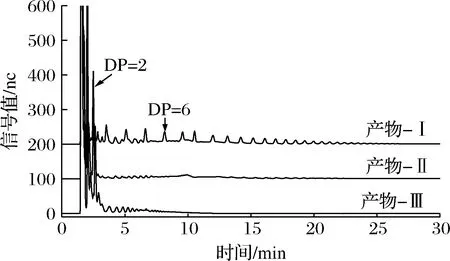
图7 产物离子色谱图Fig.7 HPAEC profiles of product
2.4 产物消化性能
根据淀粉的消化率和消化程度,淀粉可分为RDS、SDS和RS[22]。其中,SDS和RS在体内能够被缓慢吸收并持续释放出能量,对人体健康有着积极的作用。经GTase改性后产物中RDS的含量由83.95%降为57.99%,SDS和RS的含量均有不同程度的增加,其中SDS的含量提高了约8.73倍,RS的含量由14.89%提高至32.53%(表1),该结果与核磁共振氢谱分析得到的结果相一致,并验证了通过GTase的改性作用不仅可以改变产物营养片段的组成,同时还能够提高产物中不消化营养片段的含量。据报道,利用α-D-葡聚糖支化酶对木薯淀粉改性10 h后,其产物中α-1,6糖苷键的比例增加了11.5%,SDS和RS的含量分别增加了47.3%和13.5%[23]。

表1 麦芽糊精(DE12)及其改性产物中不同营养片段的含量Table 1 The content of different nutrition fractions in maltodextrin (DE12) and product
3 结论
本文对来源于罗伊氏乳杆菌的GTase的酶学性质及催化行为进行了初步的探究。GTase的最适温度为40 ℃,最适pH为5.0,在pH为8.0的Tris-HCL缓冲液的稳定性最好,可实现短期储存。在研究的13种金属离子中,Mn2+、Ca2+及Mg2+能够促进酶活,而Ba2+、Fe3+、Pb2+则会抑制酶活力。GTase同时具有转苷及水解作用,其转苷作用主要是引入了α-1,6-葡萄糖-α-1,4结构及线性α-1,6糖苷键两种结构。麦芽糊精(DE12)经GTase改性72 h后,α-1,6糖苷键的含量可达41.8%,RAS含量降低了25.96%,SDS及RS的含量分别提高了8.97%和17.76%。
