SATB-1与前列腺癌的研究进展
2014-10-17胡华刚徐斯凡
江 涛 胡华刚 徐斯凡
中央民族大学中国少数民族传统医学国家民委-教育部重点实验室,北京 100081
前列腺癌是工业化国家中50岁以上男性最常发的癌症[1],而且也是最常见的非皮肤病学的恶性肿瘤,是美国男性中引起死亡的第二大癌症[2],在中国的发病率也在不断地上升。随着前列腺特异性抗原(prostate-specific antigen,PSA)筛查技术、核磁共振(magnatic resonance imaing,MRI)成像技术以及新的前列腺活组织切片检查技术等技术的发展,侦测和定位前列腺肿瘤的精确性已经有了很大的提高,但是仍然有5%的病例显示在诊断时已经出现了转移的损伤[3]。前列腺癌最常见的转移位点是骨骼,常常伴有的症状是:疼痛、衰弱和功能性的损伤[4]。因此,研究进展过程当中的分子机制和前列腺癌的转移对于提供更好的抑制和治疗前列腺癌的策略是非常重要的。
核因子的过度表达已经被认为和癌症的发展和进程是相关的。这些转录因子的不适当的表达被认为可以脱离组织环境重建细胞生长、分裂的程序,而且有助于肿瘤的形成和发展[1]。SATB-1是一种具有核染色质组织者功能的核因子,能够调节染色质的结构和基因的表达[5]。SATB-1已经在各种类型的癌症中显现出了不正常的表达,并且被提议作为促进癌症恶化的一个致癌基因[6-8],SATB-1在各种类型的人类癌症的生物学中扮演着关键的角色[9]。然而,SATB-1在前列腺癌中的表达和作用尚未完全搞清楚。
1 SATB-1的介绍
1.1 SATB-1的背景
SATB-1(special AT-rich sequence binding protein 1)是在1992年以具有核染色质组织者功能的蛋白被发现和克隆出来的[10]。SATB-1通过提供一个细胞骨架的平台并促进染色体的重组和调节组蛋白的甲基化和乙酰化的水平来调节基因的表达[11-12],并参与多种基因的表达[13]。在正常的生理状态下,SATB-1只在胸腺中高度表达,在睾丸、胎儿的脑中以及造骨细胞中的表达水平很低,在其他组织中几乎侦测不到SATB-1的存在[14-15]。近期的研究表明,SATB-1在众多肿瘤中都有不正常的表达,并且在一定程度上促进了肿瘤细胞的生长和转移。
1.2 SATB-1的结构
SATB-1是一种特异性表达的核基质附着区结合蛋白,1992年 Dickinson等[10]采用免疫球蛋白重链 μ链基因增强子3′端的核基质结合区序列探针,从人类cDNA库中筛选得到了SATB-1相应的基因序列。SATB-1是由763个氨基酸残基组成的,它位于3号染色体的3p23区。SATB-1在细胞核内形成一独特的笼状结构将异染色质包围在其中,一些高盐抽提等化学处理方法无法轻易将该结构破坏[16]。SATB-1分子中包含有PDZ样结构域(PDZ-like domain,PSD-95,Disc-large,ZO-1),核定位信号序列(nuclear localization sequence,NLS),MARs 结合区域(MARs binding domain,MD),同源结构域(homeodomain,HD)[17],核基质靶向序列(nuclear matrix targeting sequence,NMTS)(图1)等[18]多个功能结构域。核定位信号序列(NLS)位于SATB-1分子N端的20~40位氨基酸。SATB-1 N端的90~204位氨基酸可以介导SATB-1形成二聚体[19],经对比发现这段序列和PDZ结构域同源,称为PDZ样结构[17]。PDZ结构域存在于Disc-large、ZO-1、PSD-95中。多项研究证明核基质靶向 序 列 (nuclear matrix targeting sequence,NMTS) 是 224~278位的氨基酸序列[18],可以与核基质结合。MD区为位于SATB-1的346~495位点间的氨基酸序列,MD包含有一个完整的 CRD-1(cut reapeat domains)和一小部分的 CRD-2(cutreapeat domains)。
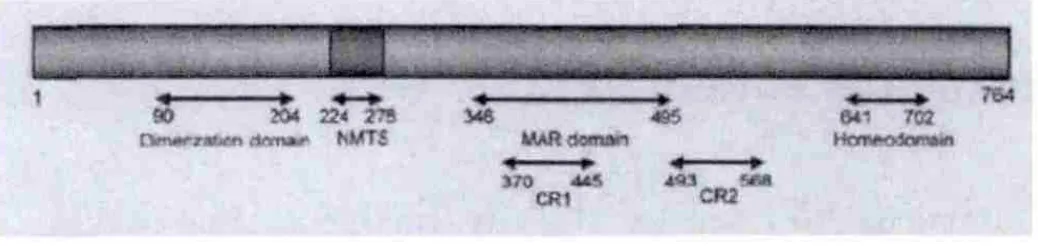
图1 SATB-1分子结构图和功能域
1.3 SATB-1的功能
SATB-1是一种特异性的细胞型染色体组织者,它在组织染色体高级结构相关生物活动方面扮演着重要的角色[20],SATB-1还可通过与 DNA的核基质结合区(MAR)结合来调节基因的表达,SATB-1主要是通过将染色体折叠成为环状的区段来调节基因的,这也是SATB-1的另一基本功能[21]。
1.3.1 SATB-1一些特殊片段的功能 SATB-1分子中的PDZ样结构域能够介导蛋白质的相互作用以及蛋白质自身的多聚化,不仅能够调节SATB-1和其他蛋白质的相互作用,还能调节SATB-1与DNA的结合能力,对基因表达宏观调控起到了分子开关的作用。研究发现,缺失了NMTS(nuclear matrix targeting sequence)的 SATB-1与核基质的结合部位减少,对小鼠乳腺癌的抑制作用也相应减弱,但SATB-1与DNA的结合未受影响[18]。MD区间的氨基酸序列能强亲和力地特异性结合MARs,因此称这段序列为MD结合区域[18],MD区间包含的 CRD-1、CRD-2及 HD是3个SATB-1的DNA结合位点。CRD以低特异性、弱的亲和力结合到DNA大沟,而HD以高特异性、强的亲和力结合到DNA小沟,但是SATB-1的HD不能直接与DNA结合,只有当MD和HD结合之后才能以MD-HD融合蛋白的方式与 MARs结合,但结合力几乎是单独 MD的 10倍,说明HD能够协助MD以非常强的亲和力特异性结合MARs[22]。
1.3.2 SATB-1对T细胞的分化、发育、成熟的影响 SATB-1通过与MAR和核基质的结合来发挥其生物学功能[16]。SATB-1主要在T细胞中表达,多项研究表明:SATB-1能够抑制IL-2Rα和IL-7Rα两个基因,而这两个基因的过表达会导致T细胞发育的不完全,在正常的T细胞中这两个基因是不表达的[21]。所以,SATB-1对T细胞的分化、发育、成熟具有重要的影响。
1.3.3 SATB-1与凋亡 实验显示,SATB-1第254位点的氨基酸在胸腺细胞的凋亡过程中被caspase-6或caspase-6样酶水解为20 kD和65 kD的2个氨基酸残基,使SATB-1丧失了与MAR结合的能力,并从染色体上解离下来,促进了染色体解体为染色质,终止了细胞的程序性死亡,从而抑制了细胞的凋亡。另外,SATB-1还可通过与原癌基因Bcl-2主断裂区(major breakpoint regionn)结合来正向调控Bcl-2的表达[23],使细胞转变为无线增殖的癌细胞来抑制细胞的凋亡。
2 SATB-1与癌症
研究发现,SATB-1与包括消化系统、呼吸系统、生殖系统、泌尿系统、内分泌系统以及皮肤肿瘤在内的数十种相关的癌症有关。研究证实:在上述的所有癌症的相关实验中发现癌细胞中的SATB-1及其对应的mRNA的含量都比正常的细胞高出很多,而且在容易转移的癌细胞当中的SATB-1及其相应mRNA的含量也比不发生转移的良性肿瘤细胞中的SATB-1及其相应的mRNA的含量要高出很多。可见,SATB-1有助于癌症的发生、发展、扩散以及癌细胞的浸润。
3 SATB-1与前列腺癌
Mao等[1]在一项研究中首次检验了SATB-1在临床前列腺癌组织中的表达,免疫组织化学分析显示有转移的前列腺癌组织对SATB-1的染色要明显强于无转移的前列腺癌组织对SATB-1的染色,但是在前列增生初期的组织中未检测出SATB-1的存在,另外,上述研究还表明SATB-1的表达和前列腺癌的骨转移以及gleason评分有着极大的相关性。为了更进一步的研究,又做了一项以LNCaP、DU-145和PC-3细胞株的功能为指标的实验,发现SATB-1在DU-145细胞株当中的表达水平是最高的,同时还发现SATB-1在LNCaP细胞株当中的表达水平是最低的,由此推断SATB-1在前列腺癌细胞中的表达量和前列腺癌细胞的浸润能力成正比的关系[1]。接下来,又将一部分DU-145细胞中控制SATB-1表达的基因敲除掉,结果导致了这些DU-145细胞的增生和浸润减少;还通过调控SATB-1基因使另一部分DU-145细胞中的SATB-1过度表达,结果发现这些细胞的浸润和增生都有所增加。因此,这些都说明了在体外条件下SATB-1能够促进前列腺癌的增生和浸润,而且这些结果也和临床前列腺癌样品的数据是保持一致的[1]。
Shukla等[24]也在相关的实验中得到了与 Mao等[1]的实验结果相似的实验结果,再次证明了SATB-1能够促进前列腺癌的增生和扩散。Barboro等[25]报道称SATB-1和核基质结合区(MARs)序列的相互作用对于前列腺癌细胞的扩散和浸润的潜力是很重要的。另外,最近的研究显示,敲掉高扩散性前列腺癌细胞PC-3M细胞的SATB-1基因之后,肿瘤的生长和浸润都受到了抑制,同时伴随着E钙黏蛋白表达量的增加,表明SATB-1借由上皮细胞和间叶细胞之间的相互转换来促进了前列腺癌的扩散[24]。
这些研究结果都提供了一个关于SATB-1在前列腺癌中致癌性角色的新的观念和洞察力,而且表明SATB-1对于前列腺癌来说是一个很有前景的生物标志物和治疗靶点。
4 前景
多项的研究结果都提供了可靠的数据证实了SATB-1与前列腺癌细胞的增生、扩散和浸润是成正相关的,因此将来可以尝试通过以检测前列腺癌细胞中SATB-1的含量来判断前列腺是否发生癌变以及前列腺癌发展的具体阶段,从而采取相应的具体治疗措施,即把SATB-1作为检测前列腺癌的一个标准。另外,也可以通过抑制前列腺癌患者的前列腺癌细胞中SATB-1的表达来抑制前列腺癌的发展和恶化,以达到治疗甚至治愈前列腺癌的目的。当然,仍有大量的前期工作需要去完成,而且对于SATB-1和前列腺癌仍存在很多盲区还有待被探索和研究,许多机制原理还不是太清楚,仍需要付出巨大的努力去将SATB-1在抗前列腺癌方面的机制研究透彻,以期能够让SATB-1在抗前列腺癌的领域“大展身手”。
[1]Mao L,Yang C,Wang J,et al.SATB1 is overexpressed in metastatic prostate cancer and promotes prostate cancer cell growth and invasion[J].J Transl Med,2013,11:111-120.
[2]Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010 [J].CA Cancer J Clin,2010,60(5):277-300.
[3]Saad F,Pantel K.The current role of circulating tumor cells in the diagnosis and management of bone metastases in advanced prostate cancer[J].Future Oncol,2012,8(3):321-331.
[4]Raheem O,Kulidjian AA,Wu C,et al.A novel patient-derived intrafemoral xenograft model of bone metastatic prostate cancer that recapitulates mixed osteolytic and osteoblastic lesions[J].J Transl Med,2011,9:185-197.
[5]Galande S,Purbey PK,Notani D,et al.The third dimension of gene regulation:organization of dynamic chromatin loopscape by SATB-1[J].Curr Opin Genet Dev,2007,17(5):408-414.
[6]Chu SH,Ma YB,Feng DF,et al.Upregulation of SATB1 is associated with the development and progression of glioma [J].J Transl Med,2012,10:149-161.
[7]Meng WJ,Yan H,Zhou B,et al.Correlation of SATB1 overexpression with the progression of human rectal cancer[J].Int J Colorectal Dis,2012,27(2):143-150.
[8]Chen H,Takahara M,Oba J,et al.Clinicopathologic and prognostic significance of SATB1 in cutaneous malignant melanoma [J].J Dermatol Sci,2011,64(1):39-44.
[9]Shen Z,Zeng Y,Guo J,et al.Over-expression of the special AT rich sequence binding protein 1 (SATB1)promotes the progression of nasopharyngeal carcinoma:association with EBV LMP-1 expression[J].J Transl Med,2013,11:217-228.
[10]Dickinson LA,Joh T,Kohwi Y,et al.A tissue-specific MAR/SAR DNA-binding protein with unusual binding site recognition[J].Cell,1992,70(4):631-645.
[11]Galande S,Purbey PK,Notani D,et al.The third dimension of generegulation:organization of dynamic chromatin loopscape by SATB1[J].Curr Opin Genet Dev,2007,17(5):408-414.
[12]Purbey PK,Singh S,Notani D,et al.Acetylation-dependent interaction ofSATB1 and CtBP1 mediates transcriptional repression by SATB1[J].Mol Cell Biol,2009,29(5):1321-1337.
[13]Kouzarides T.Histone acetylases and deacetylases in cell proliferation[J].Curr Opin Genet Dev,1999,9(1):40-48.
[14]Liu J,Barnett A,Neufeld EJ,et al.Homeoproteins CDP and SATB1 interact:potential for tissue-specific regulation [J].Mol Cell Biol,1999,19(7):4918-4926.
[15]Alvarez JD,Yasui DH,Niida H,et al.The MAR-binding protein SATB1 orchestrates temporal and spatial expression of multiple genes during T-cell development[J].Genes Dev,2000,14(5):521-535.
[16]Cai S,Han HJ,Kohwi-Shigematsu T.Tissue-specific nuclear architecture and gene expression regulated by SATB1 [J].Nat Genet,2003,34(1):42-51.
[17]Notani D,Ramanujam PL,Kumar PP,et al.N-terminal PDZ-like domain of chromatin organizer SATB1 contributes towards its function as transcription regulator[J].J Biosci,2011,36(3):461-469.
[18]Seo J,Lozano MM,Dudley JP.Nuclear matrix binding regulates SATB1-mediated transcriptional repression [J].J Biol Chem,2005,280(26):24600-24609.
[19]Purbey PK,Singh S,Kumar PP,et al.PDZ domain-mediated dimerization and homeodomain-directed specificity are required for highaffinity DNA binding by SATB1 [J].Nucleic Acids Res,2008,36(7):2107-2122.
[20]Nakayama Y,Mian IS,Kohwi-Shigematsu T,et al.A nuclear targeting determinant for SATB1,a genome organizer in the T cell lineage[J].Cell Cycle,2005,4(8):1099-1106.
[21]Yasui D,Miyano M,Cai S,et al.SATB1 targets chromatin remodeling to regulate genes over long distances[J].Nature,2002,419(6907):641-645.
[22]Dickinson LA,Dickinson CD,Kohwi-Shigematsu T.An atypical homeodomain in SATB1 promotes specific recognition of the key structural element in a matrix attachment region[J].J Biol Chem,1997,272(17):11463-11470.
[23]Yang N,Gong F,Sun L,et al.Poly(ADP-ribose)polymerase-1 binds to BCL2 major breakpoint region and regulates BCL2 expression[J].J Cell Biochem,2010,110(5):1208-1218.
[24]Shukla S,Sharma H,Abbas A,et al.Upregulation of SATB1 is associated with prostate cancer aggressiveness and disease progression[J].PLoS One,2013,8(1):e53527.
[25]Barboro P,Repaci E,D'Arrigo C,et al.The role of nuclear matrix proteins binding to matrix attachment regions (Mars) in prostate cancer cell differentiation[J].PLoS One,2012,7(7):e40617.
