毛脉酸模体外抗菌及抗病毒作用的实验研究
2014-10-16马微微岳赛男任秀明王振月
刘 奂 ,马微微,岳赛男,任秀明,郭 美,王振月
(黑龙江中医药大学,哈尔滨,150040)
毛脉酸模(Rumex gmelini Turcz.)蓼科酸模属植物,分布于黑龙江省大、小兴安岭、张广才岭以及东部山区,民间以根入药,对淋病、癣病、癌症、疮毒等具有治疗作用,还能止血、调血脂.现代药学研究表明酸模属植物主要具有抗肿瘤作用,亦有抗菌、抗病毒、止血、免疫调节、抗氧化等方面的作用.现已从毛脉酸模根中已分离得到萘类、二苯乙烯类,蒽醌类、等化合物[1].其中蒽醌类、萘类是主要的抗菌抗病毒活性成分[2-6].广大学者已对毛脉酸模的药理作用进行了大量的实验研究,药理研究表明:其具有抗心肌缺血、抗肿瘤等生物活性,但毛脉酸模的抗菌抗病毒效果尚未见报道.本试验对毛脉酸模不同部分的抗菌抗病毒活性进行了研究,以期为毛脉酸模的开发利用提供科学依据.
1 实验材料
1.1 药物
毛脉酸模根采自黑龙江省桃山林业局,大黄药材购自哈尔滨三棵树药材市场,均经黑龙江中医药大学中药资源与开发教研室主任王振月教授鉴定;双黄连口服液购自哈尔滨医药股份有限公司中药二厂;土霉素片购自哈尔滨市肉联生化制药一厂,批号940129.
1.2 菌株
金黄色葡萄球菌、大肠杆菌、伤寒杆菌、绿脓杆菌、乙型链球菌、甲型链球菌、白葡萄球菌、白喉杆菌,以上菌株均由黑龙江中医药大学微生物教研室提供.
1.3 病毒株和宿主细胞
流感病毒和MDCK细胞购自中国预防科学科学院病毒所.
2 毛脉酸模体外抗菌实验研究方法
2.1 受试药物的制备
取毛脉酸模粗粉,水浸30 min,每次加4倍量的水,首次煎沸30min,二煎沸20 min,过滤,取滤液合并,浓缩至1 g/mL的浸膏,4℃冰箱保存备用;另取毛脉酸模细粉用70%乙醇浸没放置24h,过滤,取药渣,重复以上操作1次,合并滤液,浓缩至1 g/mL的浸膏,4℃冰箱保存备用.
2.2 阳性对照药材的制备
取100 g生大黄细粉用70%乙醇浸没放置24 h,过滤,取药渣,重复以上操作1次,合并滤液,浓缩至1 g/mL的浸膏,4℃冰箱保存备用.土霉素片研成细粉,生理盐水溶解,使每毫升水溶液相当于50万单位的土霉素,过滤,备用.
2.3 实验方法
在无菌操作台上,取900只试管,每组10只,将配制好且已灭菌的供试药液(1 g/mL)用肉汤培养基分别作二倍递减浓度稀释[7-8],即取上述药液各0.5 mL,肉汤培养基1.5 mL分别加入第一管中,将药液依次按1∶2,1∶4,1∶8,...,1∶256 的比例进行稀释,最终药液的质量浓度依次为0.25,0.125,0.062 5,....,0.001 953 g/mL.每管分别加入0.05 mL菌液,其中第9号试管只加最低稀释倍数的药液,不加菌液,第10号管只加菌液和肉汤,不加药液,分别作为标准阴阳性对照管,每组平行做3次,将各试验管和对照管置37℃的恒温培养箱中培养18 h,观察各管澄清度,细菌不生长的最高药物稀释度为该药的最低抑菌浓度(MIC).
用直径4 mm的白金耳,取MIC管及药物浓度大于MIC管的各管培养液无菌操作划线接种于平皿上,37℃的恒温培养箱中培养18 h,无细菌生长或只生长5个菌落(含5个)以下的药物最低浓度即为该药对该株菌的最小杀菌浓度.
3 毛脉酸模体外抗病毒实验研究方法
3.1 受试药物的制备
毛脉酸模根部75%乙醇回流提取,提取物水混悬后依次用乙酸乙酯、水饱和正丁醇萃取,得到萃取物乙酸乙酯提取物,正丁醇提取物,水提取物.另取毛脉酸模水煎液.75%乙醇提取液(制备方法同2.1),均浓缩至1 g/mL的浸膏,4℃冰箱保存备用.
3.2 实验方法
3.2.1 病毒毒力测定
将病毒悬液用10倍递减稀释为10-1到10-8共8个稀释度,加入MDCK细胞已长成单层的96孔培养板中,每个病毒稀释度接种3孔[9-10],每孔200 μL,37 ℃,5%CO2中孵育72 h,弃病毒液,用Hanks洗板2次,最后一次控干并加入100μL维持液,同时设正常细胞对照组,倒置显微镜下每天观察细胞病变(令-为0%CPE,+为1% -25%CPE,++为25% -50%CPE,+++为50%-75%CPE,++++为75% -100%CPE),且细胞对照正常时,MTT法进行细胞染色,酶标仪570 nm处测定染色后OD值,根据OD值判断不同浓度的病毒对细胞的抑制作用,采用 Reedmuench法计算半数感染量TCID50.
3.2.2 药物毒力测定
将已过滤除菌的各个供试药液及阳性对照药(双黄连口服液)用维持液对倍稀释后,加入已长成单层细胞的96孔培养板中[11],同时设空白组,将各浓度药液加入细胞培养板中,每个浓度3孔,每孔200μL.于37℃,5%CO2温箱中培养4 h,置显微镜下观察细胞形态.计算最大无毒浓度(TC0)和50%毒性浓度(TC50).(计算方法同病毒毒力测定方法)
3.2.3 药物对流感病毒的抑制作用
用100TCID50的流感病毒每孔200μL接种到96孔培养板中已长成单层的MDCK细胞中,于37℃,5%,CO2中孵育72 h后,弃去病毒液,将最大无毒质量浓度的各供试药物用细胞生长维持液连续对倍稀释后,加入到病毒感染细胞中200μL/孔,同时设正常细胞对照组、病毒感染对照组,每组三个复孔.于37℃,5%CO2中孵育,逐日在倒置显微镜下观察CPE情况,待病毒感染对照组CPE达到+++ ~++++时终止实验.计算药物对病毒的抑制浓度IC50值,并按药物的治疗指数(TI)公式:TI=TD50/IC50计算各药物的TI值.
4 实验结果
毛脉酸模水煎液和70%醇冷浸液均显示有明显的体外抑菌和杀菌活性.其中以毛脉酸模醇提液的体外抗菌活性最强,毛脉酸模70%醇冷浸液对白葡萄球菌、甲型链球菌、绿脓杆菌的抗菌效果均高于大黄,对乙型链球菌、伤寒杆菌的抗菌效果与大黄相同,对白葡萄球菌、绿脓杆菌的抗菌效果高于土霉素,对伤寒杆菌和大肠杆菌的作用效果相当于土霉素.毛脉酸模根部水煎液的最小抑菌浓度见表1,毛脉酸模根部75%乙醇提取液的最小抑菌浓度见表2.毛脉酸模根部70%乙醇冷浸液的最小杀菌浓度见表3.毛脉酸模水提液和醇提液对流感甲型病毒的抑制最强.正丁醇部位提取物、水部位提取物、水提取液、醇提物均对流感甲型病毒有抑制活性,活性高低为:75%乙醇提取物>水提取物>水部位提取物>正丁醇部位提取物,乙酸乙酯部位提取物没有抑制活性.毛脉酸模75%乙醇提取物抗流感病毒的活性与双黄连口服液抗病毒的活性相当.毛脉酸模各有效部位对流感病毒的抑菌效果见表4.
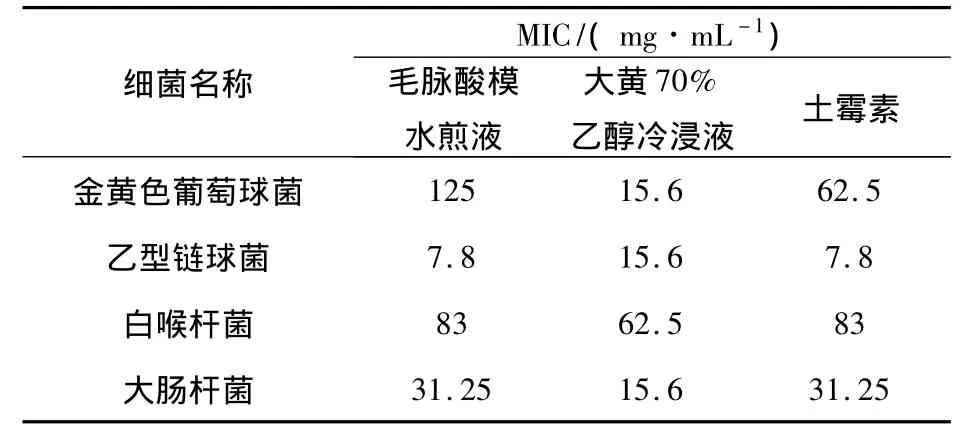
表1 毛脉酸模水煎液对4种细菌的最小抑菌质量浓度

表2 毛脉酸模根部70%乙醇冷浸液对6种细菌的最小抑菌质量浓度
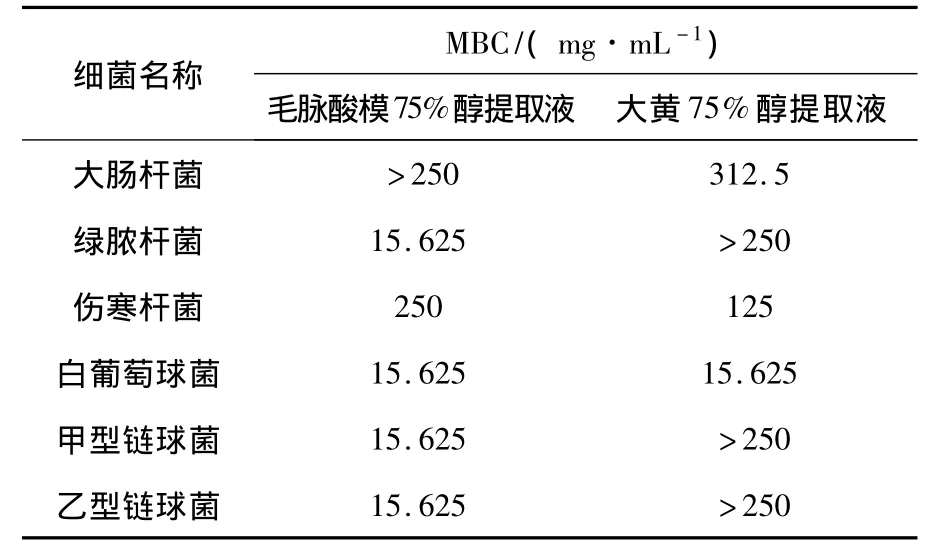
表3 毛脉酸模根部70%乙醇冷浸液对6种细菌的最小杀菌质量浓度
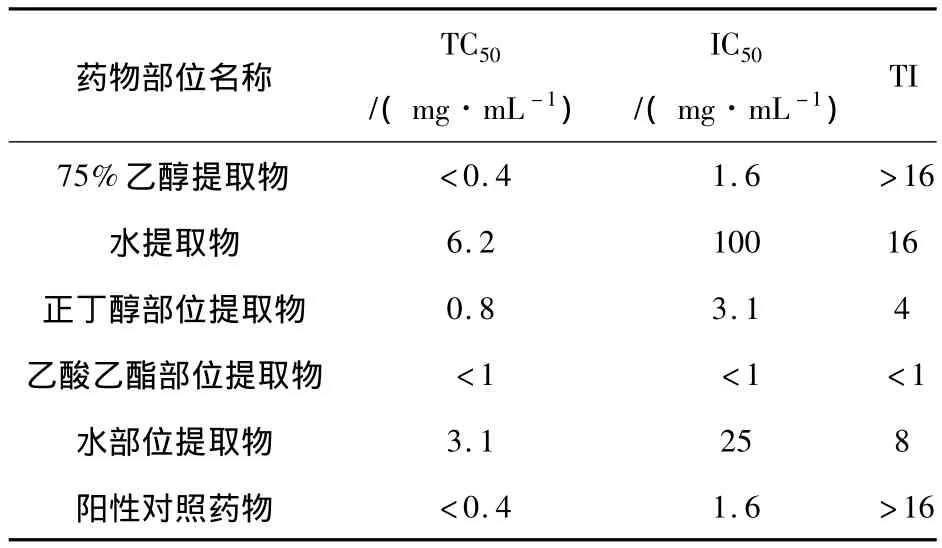
表4 毛脉酸模各有效部位对流感甲型病毒的抑菌效果
5 讨论
王振月等已分离出大黄素,大黄酚,大黄素甲醚,大黄酚苷,酸模素,酸模素苷,白藜芦醇等化合物[1],相关资料报告均具有一定的抗菌活性[2-6],与实验结果一致.毛脉酸模水煎液和70%乙醇冷浸液的抗菌效果略有差异,说明不同提取液对毛脉酸模根部有效成分的溶出率是有差异的.对乙型链球菌而言,水煎液抗菌活性高于70%乙醇冷浸液.毛脉酸模70%乙醇冷浸液对白葡萄球菌、甲型链球菌、绿脓杆菌的抗菌效果高于大黄,对白葡萄球菌、绿脓杆菌的抗菌效果高于土霉素;毛脉酸模多个部位均具有抗病毒的活性,但是以75%乙醇提取物的活性最强,其抗流感甲型病毒的活性与双黄连口服液抗病毒的活性相当,本实验表明,毛脉酸模根部用乙醇提取的方法,较之水煎煮的方法有明显的优越性,可最大限度的提取抗菌和抗病毒的有效成分,为科学合理地制备毛脉酸模摸出了一条有效途径,为其临床卓著的治疗效果,提供了可靠的实验依据.为今后进一步深入研究奠定了良好基础.
[1]王振月,左月明,康毅华,等.毛脉酸模化学成分的研究(II)[J].中草药,2005,36(11):1626-1627.
[2]李成林,叶于薇,孙菊英.大黄素和芦荟大黄素的抗菌活性研究[J].中国药理学通报,1989,5(6):381-384.
[3]BASU S,GHOSH A,HAZRA B.Evaluation of the antibacterial activity of Ventilago madraspatana Gaertn,Rubia cordifolia Linn.and Lantana camara Linn.:isolation of emodin and physcion as active antibacterial agents[J].Phytotherapy Research,2005,19(10):888 -894.
[4]MICHIKO T,JUGO K.Naphthoquinone derivative of Rumex japonicus as microbicide for foods[J].Agric Biol Chem,1977,31(2):151-152.
[5]周 侠,吕秋军,王 林,等.白藜芦醇及其衍生物抗乙型肝炎病毒体外实验研究[J].中国药学杂志,2005,40(24):1904-1906.
[6]HO T Y,WU SL,CHEN J C,etal.Emodin blocks the SARS coronavirus spike protein and angiotensin-converting enzyme 2 interaction[J].Antiviral Research,2007,74(2):92 -101.
[7]陈奇.中药药理研究方法学[M].北京:人民卫生出版社,1993:259- 278.
[8]马绪荣,苏德模.药品微生物学检验手册[M].北京:科学出版社,2001:210-212.
[9]徐淑云,方如谦,陈 修,等.药理学实验方法学[M].北京:人民卫生出版社,1991:1346,1350,1398,1409.
[10]卢长安,龚翠红,郭 伟,等.润喉灵抗病毒作用的研究[J].中成药,1994,16(6):31-33.
[11]吕邵娃,刘玉婕,孟永海,等.细菌耐药性产生机制与控制措施[J].哈尔滨商业学学报:自然科学版,2011,27(2):148-150.
