混菌固态发酵小曲白酒糟生产蛋白饲料的研究
2014-10-13汪江波薛栋升
王 炫,汪江波,薛栋升
(湖北工业大学轻工学部,湖北 武汉430068)
我国是白酒生产大国,酒糟年产量超过3 000万t[1]。由于白酒糟水分大,酸度高,极易腐烂变质,不易保管和运输,除一部分白酒糟用作饲料或肥料,大部分成为废弃物,既浪费资源,又污染环境[2]。据分析,由于酒糟中含有淀粉(10%左右)、粗纤维(20%左右)、粗蛋白(7%~9%)[3],能量和玉米几乎相当,且酒糟中含有微量的氨基酸,丰富的有机酸、磷脂和维生素,但直接作为饲料,动物适口性不好且不利于动物营养吸收[4]。本文探讨以混合菌种为发酵菌进行酒糟发酵生产饲料的工艺条件,以改善酒糟作为饲料的营养组成的,得到一种动物适口性好、营养丰富、易被动物吸收的生物活性蛋白饲料,为饲料生产提供新的蛋白质来源。
1 材料和方法
1.1 试验材料
1.1.1 原料和配料 酒糟由劲牌有限公司阳新枫林酒厂提供,初始含水量为70.0%;麸皮购于武汉南湖农贸市场,初始含水量1.3%。
1.1.2 菌 种 白 地 霉 (Geotrichu m candidiu m,G.),购于武汉大学微生物保藏中心;产软假丝酵母(Candida utilis,C.),实验室保藏菌种。
1.1.3 培养基 YPD培养基(种子培养基):酵母膏,1%;蛋白胨,2%;葡萄糖,2%;水,1 000 mL;调整p H 至6.0,用于活化白地霉(G.);调整p H 至6.5,用于活化产朊假丝酵母(C.)。
基本发酵培养基:酒糟与麸皮的干重比例(糟麸比)为9∶1,按基质干重添加5%葡萄糖,0.5%CO(NH2)2、0.5% (NH4)2SO4、0.5%KH2PO4、0.1%MgSO4无机盐,调整含水量为60%,并用Na OH调整p H至5.0。
1.2 主要仪器及试剂
见表1、表2.
1.3 分析方法
分析方法见表3.

表1 主要仪器

表2 主要试剂

表3 分析方法汇总
1.4 试验方法
1.4.1 菌种活化 斜面菌种一环→接种到YPD液体培养基→摇床(30℃,48h,180 r/min)→一级种子。
1.4.2 菌种的扩大培养 YPD液体培养基→分装三角瓶(250 mL)→灭菌(115℃,30 min)→接种一级种子→培养(30℃,48 h,180 r/mi m)→二级种子。
1.4.3 发酵培养 发酵培养基→分装三角瓶(500 mL)→灭菌→纤维素酶预处理(50℃、6 h)→接种(二级种子,接种量10%,V(G.)∶V(C.)=1∶1)→培养(30℃,72 h,发酵24 h扣瓶)。
2 结果与讨论
试验采取纤维素酶预处理酒糟,将其中的粗纤维降解为G.和C.可以利用的小分子的物质以供菌种生长并积累蛋白质;添加麸皮补充氮源的同时,调整基质的疏松度,增加基质含氧量。
2.1 菌种生长曲线的测定
采用比浊法[6]确定G.和C.的生长曲线。一级种子分别接种于YPD培养基中,培养12 h后,每隔2 h取样,用可见分光光度计测其OD值(测定波长为620 n m),记录数据,并将所测的OD值与其对应的培养时间作图,分别绘出G.和C.(YPD培养基,30℃,180 r/min)的生长曲线(图1)。所以,使用培养36 h的二级种子作为发酵菌种。
2.2 糟麸比对固态发酵的影响
培养基配方是充分利用原料中的营养物质,最大限度完成生物转化量的基础[7]。以酒糟和麸皮(总干重20 g)为主要原料,V(酒糟)∶V(麸皮)分别按9∶1、8∶2、7∶3、6∶4配制发酵培养基,其他组成与基本发酵培养基一致,纤维素酶预处理后,接种G.和C.,30℃培养72h,烘干,测其蛋白质含量,确定最佳糟麸比。定性检测硫酸铵和尿素剩余与否[5]。

图1 菌种G.和C.的生长曲线
由图2可知,添加麸皮比不添加的效果好,同时随着麸皮所占比例增大,蛋白含量也增加,但所增幅度不大,所以选择糟麸比为9∶1来配置发酵培养基。

图2 糟麸比对蛋白含量的影响
2.3 纤维素酶预处理对固态发酵的影响
小曲白酒的原料经过糖化和发酵,纤维素在酒糟中的比例明显增高,添加纤维素酶[8]以降解粗纤维,以白地霉和假丝酵母来积累蛋白[9-10]。进行纤维素酶添加量(预处理时间为6 h)和预处理时间(纤维素酶添加量为3%)对固态发酵影响的试验,试验结果见图3和图4。

图3 纤维素酶添加量对固体发酵的影响

图4 纤维素酶预处理时间对固体发酵的影响
由图3和4可知,随着纤维素酶的添加量和预处理时间的增加,蛋白含量也会随着增加;纤维素酶量的增加到5%后,蛋白含量的增量不明显,说明5%的纤维素酶足以将底物分解,确定5%的纤维素酶添加量;经12 h 50℃高温处理,蛋白含量可达到29.672 0%,随时间的延续,蛋白含量反而降低,这可能与高温下酶的半衰期缩短导致酶不能完全降解纤维素有关,但预处理时间增长至24 h时,蛋白含量有上升趋势,这可能与菌种在发酵初期有足够的由纤维素酶降解的小分子物质而大量生长。在最适温度下,预处理对蛋白的积累有益,但为了达到最好的生产效益,初步确定预处理时间约为12 h。
2.4 初始p H值对固态发酵的影响
由于发酵采用白地霉和假丝酵母混合菌种,两菌种生长的最适p H有所差异,而固态发酵过程中不必对微生物生长环境中的p H加以测控,只要调好培养基的初始p H[11]。
由图5可知,培养基初始p H5.0时,菌体蛋白含量最高28.329 8%。在发酵过程中,代谢产物的积累会影响菌种发酵能力,如酵母通过活跃分泌的H+到培养基中降低p H值,固态发酵基质的缓冲能力较大,p H的变化不会太大,故确定发酵初始p H值5.0作为发酵p H值。
2.5 初始含水量对固态发酵的影响
固态发酵的最大特点是没有游离水,因此基质含水量的变化必然会对微生物的生长及代谢能力产生重要影响[11]。对发酵培养基的初始含水量设置梯度,进行试验。

图5 初始p H值对酒糟固态发酵生产蛋白饲料的影响
由图6可知,随着初始含水量的上升,蛋白含量先上升后下降,70%的初始含水量,得到的发酵产物的粗蛋白含量最高。这是由于含水量低则造成基质膨胀程度低,微生物生长受到抑制,发酵后期微生物生长及蒸发使物料较干,微生物难以生长,产量降低;而含水量过高,导致基质多孔性降低,减少了基质内气体的体积和气体交换,难以通风降温。
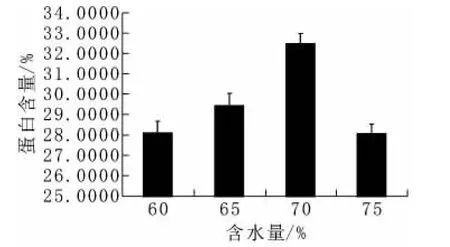
图6 初始含水量对固体发酵的影响
2.6 料层厚度对固态发酵的影响
为达到优质高产的目标,就一定要满足好氧微生物对氧气的需求量。三角瓶静置培养的方式,其料层厚度——装瓶量(按物料总干重计算)直接影响到基质的含氧量,培养基厚度适中时,不仅使发酵反应器得到最大的空间利用率,而且尽可能增加含氧量。由图7可以看出,随着装瓶量的增加,所测得蛋白含量先增加后减少,在装瓶量为15 g时达到最大值29.454%。
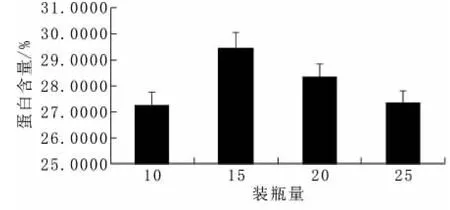
图7 装瓶量对蛋白含量的影响
2.7 发酵时间对固态发酵的影响
在30℃恒温培养箱中分别培养2 d、3 d、4 d、5 d、6 d,测其蛋白质含量,确定最佳发酵时间。
由图8可知,在发酵初期时,粗蛋白含量提高明显,5 d之后蛋白含量积累较少。因为微生物在生长过程中要经历迟缓期、对数生长期、稳定生长期和衰亡期,菌种在协同发酵过程中,发酵后期到达衰亡期,其发酵能力大大下降。所以,确定最佳发酵时间为5 d。

图8 发酵时间对蛋白含量的影响
2.8 发酵温度对固态发酵的影响
温度可以充分影响微生物内酶的活性,进而影响微生物的生长。在确定最适酶处理方式、初始p H值、最佳发酵时间、初始含水量、最佳糟麸比、料层厚度和发酵时间的基础上,分别在25℃、30℃、35℃恒温培养箱中培养,测其蛋白质含量,以确定最佳培养温度。
由图9可知,白地霉和假丝酵母混菌发酵的最适温度为30℃。温度过低,蛋白含量不高,这是由于温度低,微生物体内的酶活力较低,微生物生长繁殖慢,随着温度升高,细胞内参与生命活动的酶反应速度加快,代谢和生长也相应加快,所积累的蛋白含量高;但温度过高,蛋白含量亦不高,这是由于微生物体内的活性物质(如蛋白质、核酸等)失活,细胞功能下降,甚至死亡。

图9 培养温度对固体发酵的影响
2.9 正交试验
对单因素发酵温度、发酵时间、发酵厚度设计4因素3水平的正交试验(表4),以确定最佳的发酵条件。通过方差分析(表5),可以得到3个因素对发酵所积累蛋白含量的影响大小为:发酵时间>发酵温度>初始含水量>料层厚度。蛋白含量最高的实验小组为第六组,即发酵时间为120 h,发酵温度为30℃,初始含水量为70%,料层厚度为5 c m(即12 g)。

表4 正交试验

表5 方差分析
3 结论
通过单因素试验确定初步发酵条件,在此基础上,进行正交试验,得出结论:发酵培养基糟麸比为9∶1、初始含水量为70%、料层厚度为5 c m、p H值为5.0,灭菌后,添加5%的纤维素酶在50℃预处理12 h,再接种1∶1的白地霉和假丝酵母(10%),30℃培养120 h,可以混菌固态发酵生产酒糟饲料蛋白含量达到30.094 8%。试验对培养基无机盐组成及含量未进行探讨分析,以后的试验还会探究。
[1]李日强,张 峰,韩文辉,等.不同菌株固态发酵废白酒糟生产饲料蛋白的研究[J].重庆环境科学,2003,11(25):63-65.
[2]陆步诗,李新社.曲酒丢糟培养白地霉生产饲料的研究[J].资源开发与利用,2006(04):60-61.
[3]刘 军,牛广杰,孙东伟.混合菌种协同发酵酒糟生产菌体饲料蛋白的研究[J].酿酒科技,2009(09):116-118.
[4]汪善锋,陈安国.白酒糟资源的开发利用途径[J].饲料工业,2003,24(05):43-46.
[5]孙东伟,刘 军,牛广杰.多菌种固态发酵酒糟生产菌体饲料蛋白的研究[J].中国饲料,2010(07):38-39.
[6]沈 萍,陈向东.微生物学实验.北京:高等教育出版社,2007:85-88.
[7]梁 峰,刘秀花,马原松.发酵白酒糟生产饲料蛋白工艺研究(一)——发酵条件单因子分析[J].商丘师范学院学报,2000,16(06):84-88.
[8]莫 凯,张丽莺,张文学,等.白酒丢糟糖化降解液的制备条件探讨[J].酿酒科技,2007(10):85-87.
[9]孙丙升,孙莉莉,刘天明,等.白地霉的应用进展[J].食品开发与研究.2008(09):163-166.
[10]侯国亮,贾 峥,赵守贤.利用酒糟生产酶制剂的试验研究[J].中国饲料,1999(03):28-29.
[11]邱立友.固态发酵工程原理及应用[M].北京:中国轻工业出版社,2008:26-26.
