TiO2/AC复合催化剂光催化降解布洛芬
2014-10-12闫春燕伊文涛李法强
闫春燕,伊文涛,李法强
(1. 枣庄学院 化学化工与材料科学学院,山东 枣庄 277160;2. 鲁南煤化工工程技术研究院,山东枣庄 277160;3. 中国科学院 青海盐湖研究所,青海 西宁 810008)
药物及个人护理品(PPCP,包括处方与非处方药物、兽医药剂、化妆品、遮光剂、诊断剂以及营养保健品等)是一类重要的潜在新生污染源[1]。近几年,我国也开始了相关研究,在水体、大气等环境介质中均检测到了残留PPCP。布洛芬是苯丙酸类非甾体抗炎药物,是一种重要的PPCP类物质[2]。环境中的布洛芬主要来自制药企业排放的废水及人体排泄物。布洛芬不易挥发、物理性质稳定、半衰期较长、不易被吸附、较少发生化学降解,故被认为是“持久性”环境污染物,其残留危害和污染风险较大。纳米TiO2作为一种半导体光催化剂,具有光照下氧化能力强、物理化学性质稳定、无毒、价格低廉等优点,能有效降解烃类和多环芳烃、染料、表面活性剂及农药等,可将其脱色、矿化为无毒的无机小分子物质,从而消除对环境的污染[3-6],应用前景光明;但同时存在着催化效率不高、回收困难等问题。近年来,高效负载型光催化剂的研制成为光催化领域重要的发展方向之一。活性炭(AC)孔隙结构发达,比表面积大,吸附能力强,是一种理想的催化剂载体。研究结果表明,TiO2/AC复合物可显著提高光催化体系的综合效率[7]。但以TiO2/AC为催化剂光催化处理布洛芬废水的研究至今未见有文献报道。
本工作以钛酸丁酯为钛源、粉末AC为载体,采用溶胶-凝胶法制备了TiO2/AC负载型复合催化剂,并采用XRD和FE-SEM技术对其进行了表征;研究了TiO2/AC光催化降解布洛芬的影响因素。
1 实验部分
1.1 试剂、材料和仪器
布洛芬:纯度大于等于98%;钛酸丁酯:分析纯。
AC:粉末状,比表面积500~1 000 m2/g,吸碘值大于900 mg/g,灰分小于5%。
TU-1810型紫外可见分光光度计:北京普析通用仪器有限责任公司;6100型X射线衍射仪:日本岛津公司;LEO 1550型场发射扫描电子显微镜:Zeiss集团;Zetasizer Nano型纳米粒度、Zeta电位和绝对分子量分析仪:Malvern仪器公司;TL-D 18W/BLB型紫外灯:Philips公司;SK 3200H型超声波清洗器:上海科导超声仪器有限公司;ZNCL-DS型数显智能磁力多点搅拌器:河南爱博特科技发展有限公司。
1.2 催化剂的制备
取一定量的粉末AC,用1 mol/L的HNO3浸泡2.5 h,在超声波清洗器中清洗0.5 h,用蒸馏水洗至中性,置于105 ℃烘箱中烘干3 h,得处理后的粉末AC。将适量处理后的粉末AC加入到10 mL钛酸丁酯、20 mL无水乙醇和5 mL冰醋酸的混合液中,磁力搅拌均匀,得A液;将15 mL无水乙醇加入到5 mL蒸馏水和2 mL冰乙酸中,并用2 mol/L的H2SO4调节溶液pH至2~3,混合均匀,得B液。强力搅拌下逐滴将B液缓慢加入到A液中,滴加完毕后,继续搅拌1 h,得溶胶。将该溶胶在室温下凝结老化24 h,再于105 ℃下干燥12 h,研磨后置于马弗炉中,以不同温度焙烧3 h,冷却至室温,研磨,得TiO2/AC催化剂(AC含量为10%(w))。同时,以相同的方法制备纯TiO2催化剂,以作性能比较。
1.3 布洛芬的光催化降解
吸附及光催化降解实验在自制箱式反应器中进行,反应器侧面安装有小型电风扇以维持体系的温度。将一定量的TiO2/AC催化剂加入到100 mL质量浓度为40 mg/L的布洛芬溶液中,以6 mol/L的H2SO4调节溶液pH,于温控多点磁力搅拌器上避光搅拌60 min,达到吸附-脱附平衡后将反应器置于5支紫外灯管(18 W、主波长为365 nm)下10 cm处进行光照,反应器底部用微型泵以15 mL/min的流量鼓入空气以增加溶解氧含量,每隔30 min取样一次,反应180 min。如无特殊说明,反应均在室温下进行。
将使用过的TiO2/AC催化剂离心分离,用95%的乙醇洗涤3次,于85 ℃下真空干燥,重复上述光催化实验操作,以验证TiO2/AC催化剂的稳定性。
1.4 分析方法
采用XRD技术考察不同焙烧温度对TiO2/AC催化剂晶粒尺寸、晶体结构的影响。采用FE-SEM技术观察TiO2/AC催化剂的微观形貌。以去离子水为分散剂,以0.01 mol/L的NaOH溶液和HCl调节溶液的pH,将TiO2/AC催化剂超声分散5 min,静置10 min,取上层分散液,采用纳米粒度、Zeta电位和绝对分子量分析仪测定分散液的Zeta电位。
取自反应器的试样以0.2 μm的膜过滤器过滤后,采用紫外可见分光光度计测定溶液的吸光度(最大吸收273 nm),并计算不同反应时间(t,min)下的布洛芬降解率(η,%)。
2 结果与讨论
2.1 XRD和FE-SEM表征结果
不同焙烧温度下TiO2/AC催化剂的XRD谱图见图1。由图1可见:TiO2/AC催化剂在500 ℃及以下焙烧时为锐钛矿型结构;当焙烧温度高于600℃时,即有明显的金红石相特征衍射峰出现。Scherrer公式[8]计算结果表明,随热处理温度的升高,TiO2的平均晶粒尺寸逐渐增大,由400 ℃时的15.2 nm增至700 ℃时的23.2 nm。
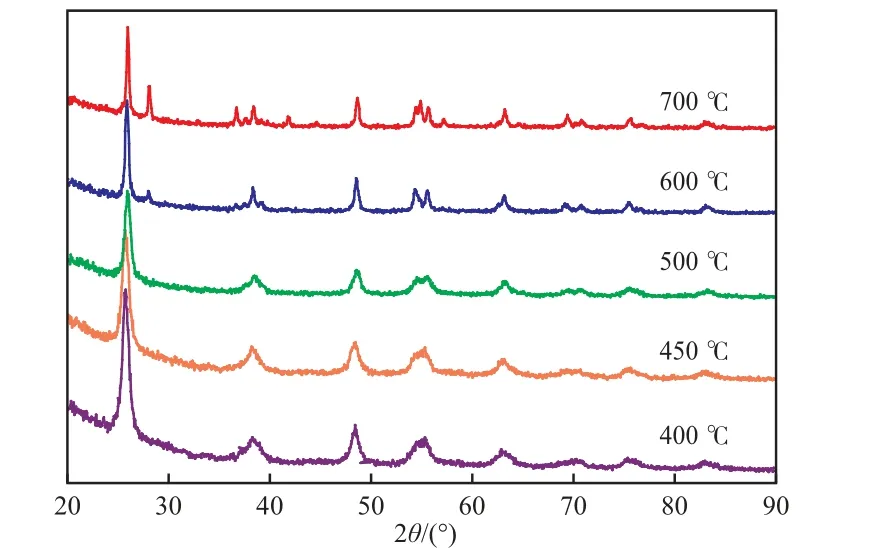
图1 不同焙烧温度下TiO2/AC催化剂的XRD谱图
焙烧温度为500 ℃的TiO2/AC催化剂的FESEM照片见图2。由图2可见,试样总体呈现无定形多孔结构,TiO2以AC为成核基体,分布在AC表面及其孔道内,颗粒间团聚较少,粒径较小。试样兼具AC的多孔结构和TiO2纳米粒子的高分散特性。

图2 焙烧温度为500 ℃的TiO2/AC催化剂的FE-SEM照片
2.2 不同体系的吸附及光催化性能比较
在布洛芬质量浓度40 mg/L、焙烧温度500℃、催化剂加入量2.0 g/L、溶液pH 3.0的条件下,暗箱吸附阶段的取样分析结果表明,AC、纯TiO2及TiO2/AC催化剂体系均可在30 min内达到吸附-脱附平衡。纯TiO2对布洛芬的吸附率较低,仅为3.6%;而AC的吸附率最大,达到12.6%,TiO2/AC催化剂的吸附率也达到了8.2%。
以此条件下光照阶段布洛芬的降解率表示光催化效果,不同体系的布洛芬降解率见图3。由图3可见:布洛芬在光照条件下的自降解率几乎为0;相同条件下AC无光催化活性;纯TiO2表现出了较好的光催化活性,180 min时布洛芬的光催化降解率达到了55.0%;TiO2/AC催化剂的光催化活性最高,180 min时布洛芬的降解率达85.6%。光催化属于非均相反应,其反应机理为吸附-表面反应-解吸,TiO2/AC催化剂可发挥AC的吸附性能及TiO2光催化的协同效应,故其光催化效果最佳。

图3 不同体系的布洛芬降解率
2.3 光催化降解布洛芬的影响因素
2.3.1 反应温度的影响
反应温度是光催化研究的重要因素之一。在焙烧温度500 ℃、布洛芬质量浓度40 mg/L、催化剂加入量2.0 g/L、溶液pH 3.0的条件下,光催化反应60 min时,反应温度对布洛芬降解率的影响见图4。
由图4可见:在所研究的温度范围内,光催化降解过程对温度的依赖性不强;随温度的升高,降解率略有增大,但变化不大。综合考虑,选择在室温下进行实验即可。
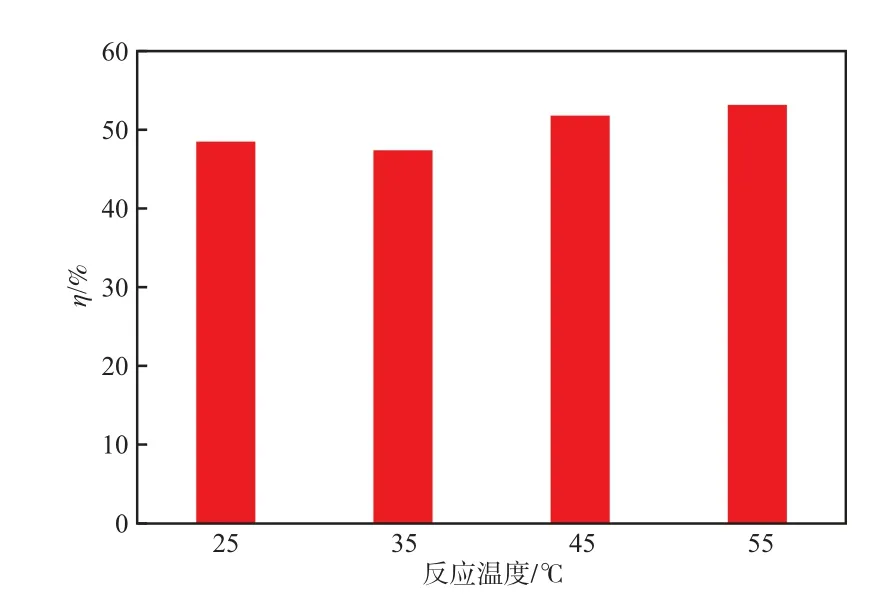
图4 反应温度对布洛芬降解率的影响
2.3.2 焙烧温度的影响
研究结果表明,TiO2/AC催化剂的焙烧温度对其光催化性能有显著影响[9]。在室温、布洛芬质量浓度40 mg/L、催化剂加入量2.0 g/L、溶液pH 3.0的条件下,焙烧温度对布洛芬降解率的影响见图5。由图5可见,焙烧温度对催化剂的催化效果有较大的影响,焙烧温度为500 ℃时TiO2/AC催化剂具有最高的光催化降解活性,这与其具有适宜的表面结构、粒子大小及晶相结构有关。因此,选择焙烧温度为500 ℃。
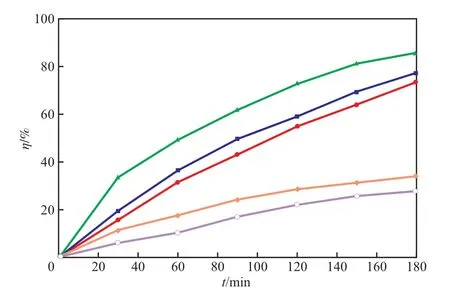
图5 焙烧温度对布洛芬降解率的影响
2.3.3 TiO2/AC催化剂加入量的影响
在室温、布洛芬质量浓度40 mg/L、焙烧温度500 ℃、溶液pH 3.0的条件下,TiO2/AC催化剂加入量对布洛芬降解率的影响见图6。由图6可见,起初,布洛芬的降解率随催化剂加入量的增加而增大,催化剂加入量为2.0 g/L时降解率最高,随后出现减小的情况。这可能是因为:催化剂加入量较少时,催化剂不能完整地接收入射的紫外光,表现为其光催化活性较低;当催化剂加入量过多时,催化剂颗粒对紫外光的漫反射加强,降低了紫外光辐射强度,从而导致其光催化效果降低。因此,选择催化剂加入量为2.0 g/L。
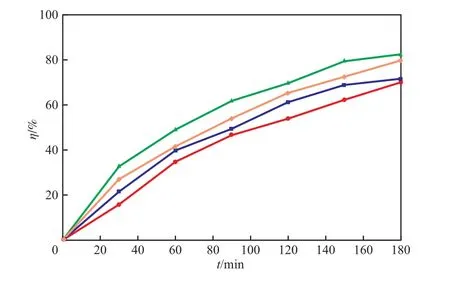
图6 TiO2/AC催化剂加入量对布洛芬降解率的影响
2.3.4 溶液pH的影响
在室温、布洛芬质量浓度40 mg/L、焙烧温度500 ℃、TiO2/AC催化剂加入量2.0 g/L的条件下,溶液pH对布洛芬降解率的影响见图7。由图7可见,随pH的增大,降解率先增大后减小,当pH=3.0时达到最大。这可能与溶液pH会影响纳米粒子的表面电荷分布等电性质,而表面电荷对吸附性能会产生一定影响有关。Zeta电位的测试结果显示:pH为5.0和7.0时,分散液的Zeta电位均为负值且绝对值较低,分别为-8.82 mV和-19.72 mV,说明此时催化剂表面带负电,分散液的稳定性较差;随pH的减小,分散液的Zeta电位转为正值且逐渐增高,说明在低pH条件下,催化剂表面质子化,带正电;当pH=3.0时,Zeta电位达到31.02 mV,说明此条件下纳米粒子之间的排斥力较大,分散液的稳定性高,有利于对布洛芬的吸附和降解。因此,选择溶液pH为3.0。

图7 溶液pH对布洛芬降解率的影响
2.3.5 小结
综上所述,布洛芬质量浓度为40 mg/L时,TiO2/AC光催化降解布洛芬的最佳条件:室温,焙烧温度500 ℃,催化剂加入量2.0 g/L,溶液pH 3.0。
2.3.6 共存离子的影响
溶液中分别加入Cl-,NO-3,Fe2+,Cu2+,在最佳条件下,光催化反应120 min时,共存离子对布洛芬降解率的影响见图8。由图8可见:Cl-对光催化降解有抑制作用,当Cl-的浓度达到3.0 mmol/L时,随Cl-浓度的增加,这种抑制作用趋于平缓;NO-3对光催化降解起到明显的抑制作用,当NO-3浓度达到1.0 mmol/L后降解率明显降低,这可能是因为NO-3更容易被TiO2/AC催化剂吸附而占据了吸附活性位所造成的。由图8还可见:Fe2+和Cu2+对布洛芬的光催化降解作用均呈现两面性,随金属离子浓度的增加,降解率先增大后减小;当Cu2+浓度为0.2 mmol/L、Fe2+浓度为0.5 mmol/L时,光催化效果最佳。这可能是因为:Fe2+与Cu2+均是电子的有效接受体,在一定浓度范围内可以接受电子,减小了光生电子和空穴的复合几率,从而提高了降解率;随Fe2+和Cu2+浓度的继续增加,过多的Fe2+与Cu2+成为光生电子和空穴的复合中心,导致体系的光催化活性降低。

图8 共存离子对布洛芬降解率的影响
2.3.7 氧化性物种H2O2的影响
氧化性物种H2O2等的存在对TiO2光催化反应体系会产生一定的影响[10]。H2O2的加入不会引入新的杂质,且产物不会产生环境污染。在最佳条件下,光催化反应60 min时,H2O2浓度对布洛芬降解率的影响见图9。由图9可见,随H2O2浓度的增加,降解率先逐渐增大,当H2O2浓度超过0.5 mmol/L后降解率反而下降。这可能是因为:H2O2作为一种电子接受体在一定浓度范围内会吸收电子产生·OH,从而加速布洛芬的降解;但当H2O2浓度过高时,反而会与体系中的·OH反应,使反应活性物种的浓度降低,导致降解率减小。

图9 H2O2浓度对布洛芬降解率的影响
2.3.8 TiO2/AC催化剂重复使用的性能
在最佳条件下,光催化反应60 min时,TiO2/AC催化剂使用次数对布洛芬降解率的影响见图10。由图10可见,体系中布洛芬的残留浓度基本无变化,说明该催化剂具有良好的稳定性,可多次重复使用而不失活。
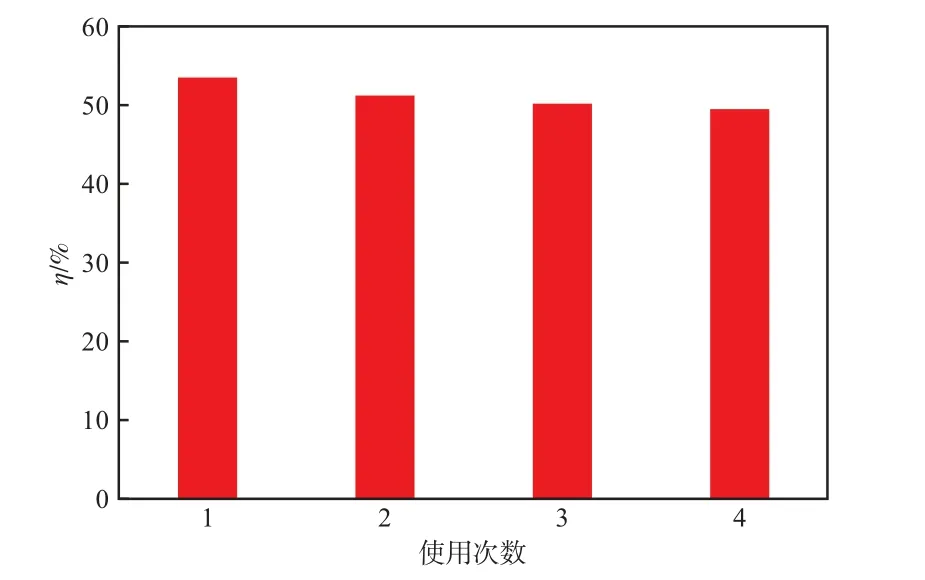
图10 TiO2/AC催化剂使用次数对布洛芬降解率的影响
3 结论
a)采用溶胶-凝胶法制备、经500 ℃焙烧3 h得到的TiO2/AC催化剂为多孔结构的锐钛矿相。
b)布洛芬质量浓度为40 mg/L时,在室温、焙烧温度500 ℃、TiO2/AC催化剂加入量2.0 g/L、溶液pH 3.0的最佳条件下,光催化降解180 min时布洛芬的降解率达85.6%。Cl-和NO3-对布洛芬的降解有强烈的抑制作用;Fe2+,Cu2+,H2O2对布洛芬的降解作用均呈现两面性,随物种浓度的增加,布洛芬的降解率先增大后减小。
c)TiO2/AC催化剂具有良好的稳定性,可多次重复使用而不失活。
[1] Yu Yong,Liu Yin,Wu Laosheng. Sorption and degradation of pharmaceuticals and personal care products(PPCPs) in soils[J]. Environ Sci Pollut R,2013,20(6):4261-4267.
[2] 王红娟,齐飞,封莉,等. 污泥基活性炭催化臭氧氧化降解水中微量布洛芬的效能研究[J]. 环境科学,2012,33(5):1591-1596.
[3] Chen Xiaobo,Liu Lei,Yu P Y,et al. Increasing solar absorption for photocatalysis with black hydrogenated titanium dioxide nanocrystals[J]. Science,2011,331(6018):746-750
[4] Fabiola Méndez-Arriaga,M Ignacio Maldonado,Jaime Gimenez,et al. Abatement of ibuprofen by solar photocatalysis process:Enhancement and scale up [J].Catal Today,2009,144(1/2):112-116.
[5] Lin Yixin,Ferronato C,Deng Nansheng,et al. Study of benzylparaben photocatalytic degradation by TiO2[J].Appl Catal,B,2011,104(3/4):353-360.
[6] Chen Guihua,Wang Jianling,Wu Changyu,et al.Photoelectrocatalytic oxidation of glutathione based on porous TiO2-Pt nanowhiskers[J]. Langmuir,2012,28(33):12393-12399.
[7] 李佑稷,陈伟,李志平,等. 过渡金属掺杂TiO2/活性炭复合体的制备及双协同光催化性能[J]. 中国科学:化学,2010,40(12):1814-1822.
[8] 丁鹏,谢忠雷,唐艳茹,等. TiO2-Bi2O3纳米粒子气相光催化降解对二甲苯[J]. 化工环保,2012,32(2):109-112.
[9] 徐鑫,王晓静,胡中华,等. 溶胶-凝胶和浸渍-水热制备方法对TiO2/AC光催化剂结构和性能的影响[J].物理化学学报,2010,26(1):79-86.
[10] 鲁秀国,孟锋,涂沁. H2O2协同TiO2光催化处理模拟苯胺废水[J]. 化工环保,2012,32(6):489-492.
