FeCl3蚀刻液膜电解阴极液中Ni2+的萃取回收
2014-10-12童欣欣沈筱芳保积庆胡芳琴李秀红
童欣欣,沈筱芳,徐 劼,保积庆,胡芳琴,李秀红
(1. 嘉兴学院 南湖学院, 浙江 嘉兴 314001;2. 常州大学 环境与安全工程学院,江苏 常州 213100;3. 嘉兴学院 生物与化学工程学院,浙江 嘉兴 314001 )
随着电脑、电视机等常用电器的快速普及,高性能彩色显像管的需求量日益增加,而荫罩是显像管关键部件之一。荫罩生产中的蚀刻工艺,对高浓度FeCl3蚀刻液的需求量极大[1-2]。在蚀刻过程中,FeCl3蚀刻液中不断富集Ni2+,而蚀刻液中的有效成分FeCl3不断被还原成FeCl2,从而导致蚀刻液对荫罩的蚀刻能力降低,蚀刻产品质量变差[3-5]。失效的蚀刻液若不经处置而直接排放,不仅会污染环境,还将造成资源的极大浪费。
国内外有关废FeCl3蚀刻液中Ni2+的去除方法有较多的研究报道,包括沉淀法、还原法、离子交换法、电解法、反渗透法、无机膜法等[6-12]。目前,有采用FeCl3浸出高冰镍或采用浓缩法再生FeCl3蚀刻液的工艺,但这些处理工艺比较复杂,且除Ni2+效率低,成本高。而采用LK-C2萃取剂的分离工艺,则存在可操作性不强等缺点[13]。本课题组自制研发了SSX萃取剂,对溶液体系中的Fe2+和Ni2+具有较好的分离选择性,且价格便宜。
本工作采用萃取工艺, 采用SSX萃取剂对蚀刻液经前期电解工艺处理后的阴极液(简称废液)进行萃取处理,制备NiCl2产品。考察了萃取pH、萃取剂含量、萃取相比(SSX萃取剂与废液的体积比)、萃取时间、萃取级数对阴极蚀刻液中Ni2+萃取率的影响;以及反萃剂HCl溶液浓度、反萃相比(反萃剂体积与萃取液的体积比)、反萃时间对Ni2+反萃取率的影响。
1 实验部分
1.1 材料、试剂和仪器
原FeCl3蚀刻废液来源于某印制线路板厂(废液呈深蓝色),经膜电解处理后阴极液呈亮绿色,其主要成分为FeCl2和NiCl2,其中Fe2+质量浓度为151.2 g/L、Ni2+质量浓度为16.42 g/L。
SSX:摩尔比为1∶2的萘磺酸盐与吡啶羧酸酯的复配物;煤油:工业级;HCl溶液:分析纯。
PHS-25型pH计:上海智光仪器仪表有限公司;FA1004型电子分析天平:上海良平仪器仪表有限公司。
1.2 实验方法
将SSX与煤油混合,得到不同含量(w)的SSX萃取剂。按一定的萃取相比将SSX萃取剂与废液混合,置于分液漏斗中,经充分振荡后静置分层、分液。为保证较高的萃取率,分离后的萃取液和萃余液可再进行多次萃取,取样分析萃余液中的Ni2+含量,并计算萃取过程中Ni2+的萃取率。
以一定浓度的HCl溶液作为反萃剂,与含Ni2+的萃取液按一定比例置于分液漏斗中,经充分振荡后静置分层、分液,取样测定反萃液中的Ni2+含量,并计算反萃取过程中Ni2+的反萃率。经过HCl溶液反萃后,SSX萃取剂得到再生。
1.3 分析方法
采用丁二酮肟重量法和EDTA滴定法测定Ni2+含量[14];采用重铬酸钾法测定Fe2+含量[15];采用玻璃电极法测定pH[16]。
2 结果与讨论
2.1 萃取工艺
2.1.1 萃取pH对Ni2+萃取率的影响
当SSX萃取剂含量30%(w)、萃取相比1.0、萃取时间10 min、1次萃取时,萃取pH对Ni2+萃取率的影响见图1。由图1可见,随萃取pH的增大,Ni2+的萃取率先增大后减小;当萃取pH为2.0时,Ni2+的萃取率最大(为53.32%),这是因为,在此酸度条件下,SSX萃取剂能与Ni2+生成稳定性较高的络合物,从而提高了对Ni2+的选择性。故选择萃取pH为2.0较适宜。
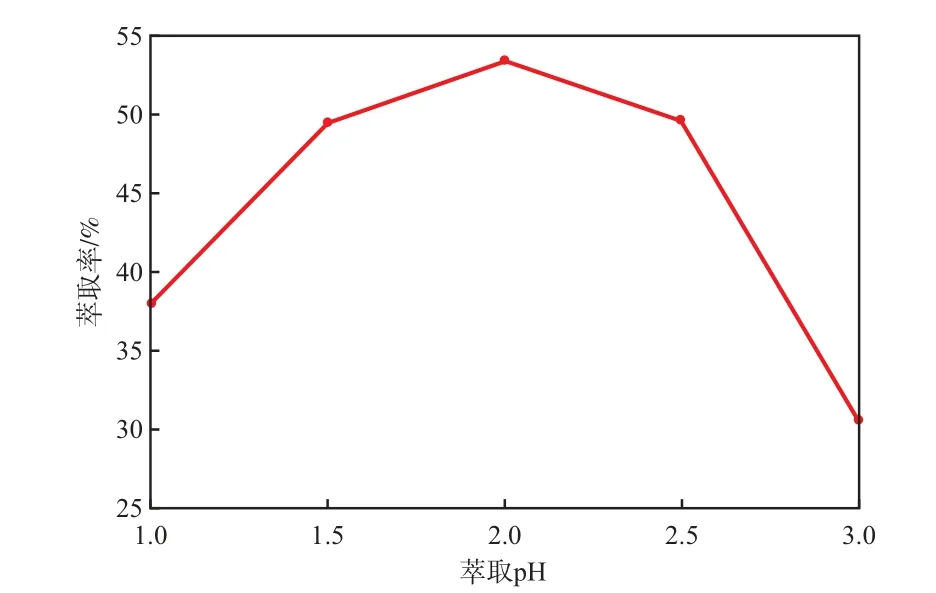
图1 萃取pH对Ni2+萃取率的影响
2.1.2 SSX萃取剂含量对Ni2+萃取率的影响
当萃取pH 2.0、萃取相比1.0、萃取时间10 min、1次萃取时,SSX萃取剂含量对Ni2+萃取率的影响见图2。
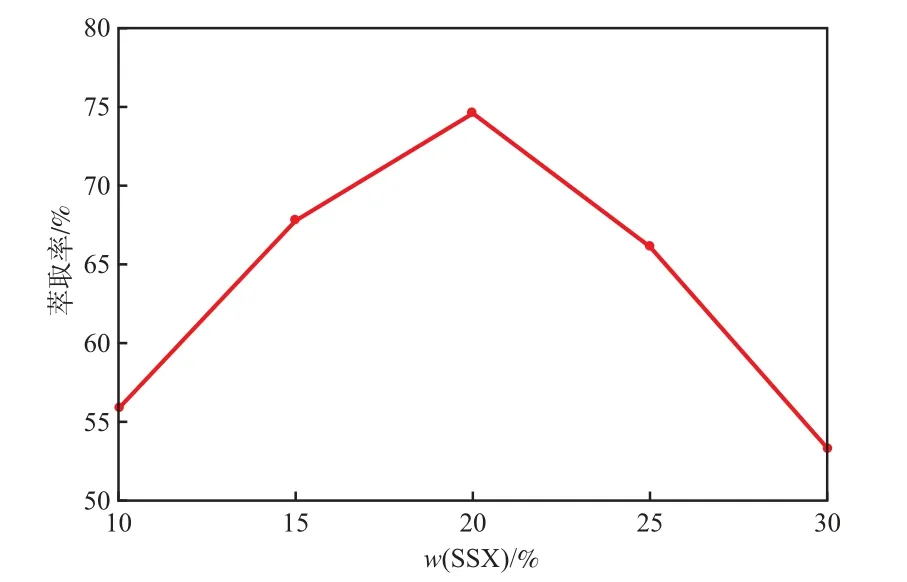
图2 SSX萃取剂含量对Ni2+萃取率的影响
由图2可见:当SSX萃取剂含量为10%(w)时,Ni2+的萃取率较低,这是由于萃取剂有效成分含量较低时,Ni2+无法完全被萃取到有机相;随SSX萃取剂含量的增加,Ni2+的萃取率明显增大;当SSX萃取剂含量为20%(w)时,Ni2+的萃取率达最大值(为74.56%);而当SSX萃取剂含量进一步增大时,由于有机相黏度也会相应增大,从而导致分相效果变差,Ni2+的萃取率反而减小。综合工艺的经济可行性考虑,选择SSX萃取剂含量为20%较适宜。
2.1.3 萃取相比对Ni2+萃取率的影响
当萃取pH 2.0、SSX萃取剂含量 20%(w)、萃取时间10 min、1次萃取时,萃取相比对Ni2+萃取率的影响见图3。从理论上分析,在温度、pH、萃取剂含量等萃取参数不变的条件下,相比增大,Ni2+萃取率也应增大。由图3可见:当萃取相比为0.5时,Ni2+的萃取率仅为35.66%;当萃取相比为1.0时,Ni2+的萃取率增至74.56%;当萃取相比大于1.0以后,随萃取相比的进一步增大Ni2+的萃取率增加缓慢。考虑到工业实践中,若通过增大相比来提高Ni2+的萃取率,需增大有机相的存储量,导致经济成本增加,故选择萃取相比为1.0较适宜。

图3 萃取相比对Ni2+萃取率的影响
2.1.4 萃取时间对Ni2+萃取率的影响
当萃取pH 2.0、SSX萃取剂含量 20%(w)、萃取相比1.0、1次萃取时,萃取时间对Ni2+萃取率的影响见图4。
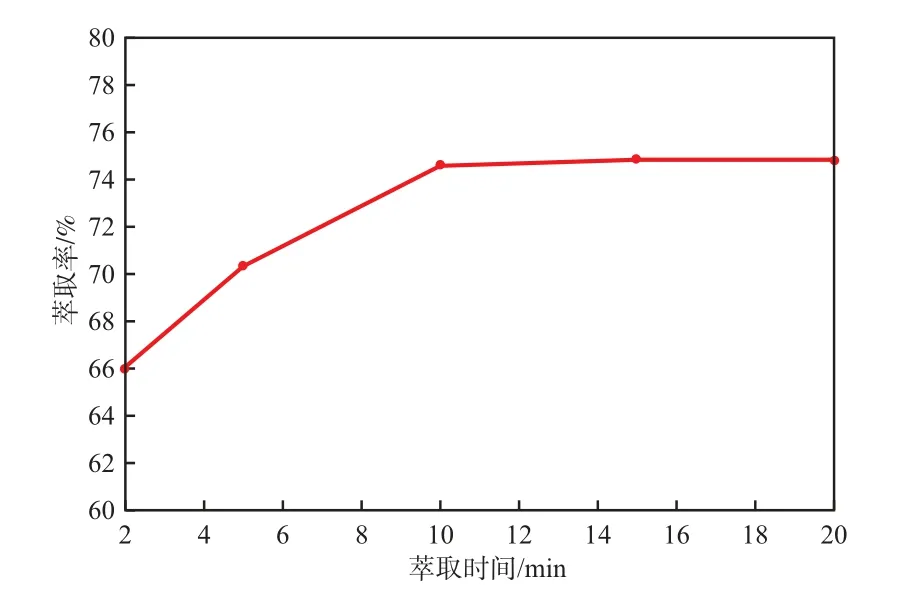
图4 萃取时间对Ni2+萃取率的影响
由图4可见:随萃取时间的延长,Ni2+萃取率逐渐增大;当萃取时间为10 min时,Ni2+的萃取率最大(为74.56%);而随萃取时间的进一步延长,由于体系中待分离的Ni2+减少,传质动力降低,因此Ni2+的萃取率基本趋于稳定,变化不明显。从萃取工艺效率角度考虑,选择萃取时间为10 min较适宜。
2.2 反萃工艺
2.2.1 HCl溶液浓度对Ni2+反萃率的影响
当反萃相比1.0、反萃时间10 min时,HCl溶液浓度对Ni2+反萃率的影响见图5。由图5可见,随HCl溶液浓度的增加,Ni2+的反萃率逐渐增大。这主要是因为在强酸性条件下,Ni2+亲水性较强,易从有机相脱离进入水相。但考虑到成本和HCl对设备的腐蚀,在实际生产中,可以通过延长反萃时间来提高反萃率。因此,选择HCl溶液浓度为6.0 mol/L较适宜。
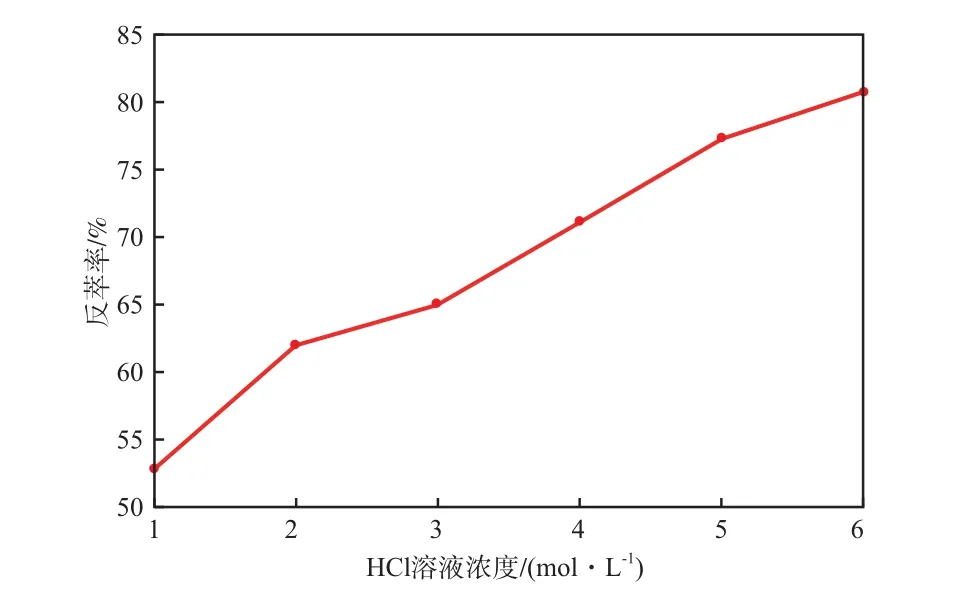
图5 HCl溶液浓度对Ni2+反萃率的影响
2.2.2 反萃时间对Ni2+反萃率的影响
当HCl浓度6.0 mol/L、反萃相比1.0时,反萃时间对Ni2+反萃率的影响见图6。由图6可见:随反萃时间的延长Ni2+反萃率增大;当反萃时间超过10 min时,Ni2+的反萃率增加缓慢并逐渐趋于稳定。因此,选择反萃时间为10 min较适宜。
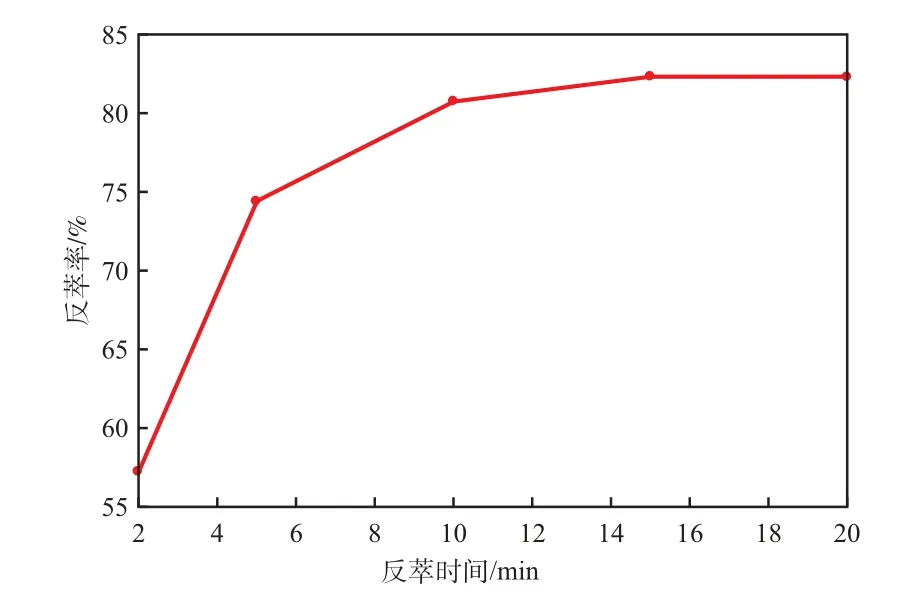
图6 反萃时间对Ni2+反萃率的影响
2.2.3 反萃相比对Ni2+反萃率的影响
当HCl浓度6.0 mol/L、反萃时间为10 min时,反萃相比对Ni2+反萃率的影响见图7。由图7可见,当反萃相比小于1.5时,反萃率随反萃相比的增加迅速增大;当反萃相比为1.5时,Ni2+的反萃率最高(为93.10%);当反萃相比继续增大时,Ni2+的反萃率趋于稳定。因此,选择反萃相比为1.5较适宜。
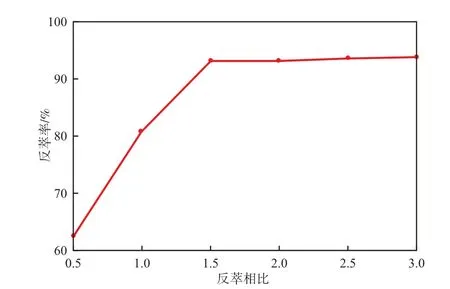
图7 反萃相比对Ni2+反萃率的影响
2.3 再生SSX萃取剂的重复使用
当SSX萃取剂含量20%(w)、萃取pH 2.0、萃取相比1.0、萃取时间10 min时,用再生后的SSX萃取剂对同一废液水样连续萃取5次,SSX萃取剂重复使用次数对Ni2+萃取率的影响见图8。由图8可见:SSX萃取剂重复使用3次后,Ni2+的累计萃取率达90.12%;重复使用4次后,Ni2+的累计萃取率趋于稳定,达91.00%,此时萃取液中Ni2+的质量浓度为14.94 g/L。这是因为,随SSX萃取剂重复使用次数的增加, SSX萃取剂对Ni2+的萃取量接近饱和,萃取液中的Ni2+含量趋向稳定,对Ni2+的后续萃取能力降低。因此,该萃取剂可重复使用4次,以提高萃取效果。
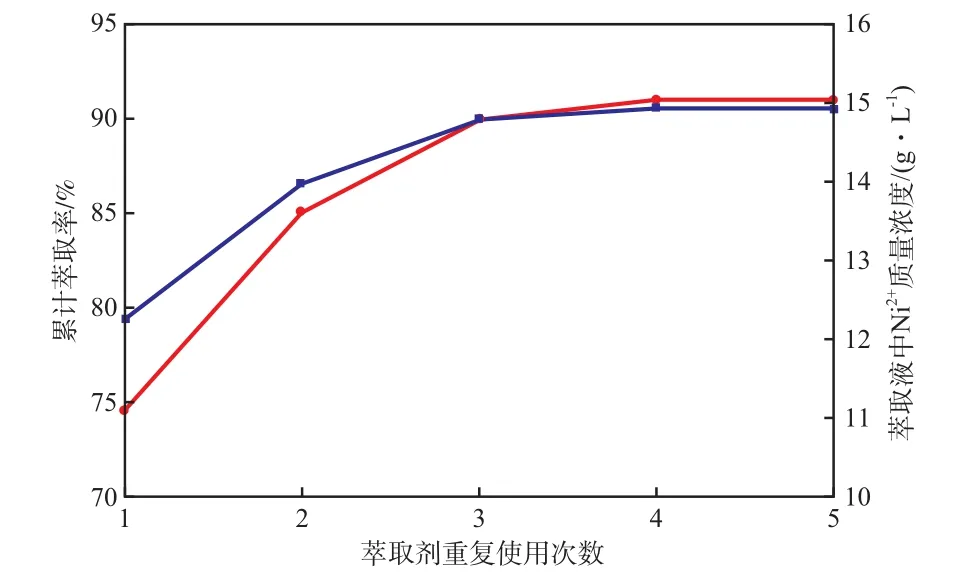
图8 SSX萃取剂重复使用次数对Ni2+萃取率的影响
2.4 工艺评述
负载Ni2+的有机相在最佳反萃工艺条件下用6.0 mol/L的HCl溶液反萃,得到NiCl2质量浓度为30.47 g/L的溶液。调整该溶液pH为2~3,于搪瓷反应釜中蒸发浓缩后自然结晶(结晶温度35 ℃,结晶时间 48 h),经离心分离母液后,可得到结晶完全的NiCl2·6H2O产品,经检测w(Ni)≥23.8%,w(Fe)≤0.002%,完全符合HG/T 2771—2009《电镀用氯化镍》规定的要求[17]。
与其他分离方法相比,本工艺在实现蚀刻废液处理的同时还可获得一定的经济效益,并具有平衡速率快、处理能力大、Ni2+回收率高、分离效果好等优点。
3 结论
a)以含量20%(w)的SSX为萃取剂,萃取废液中的Ni2+,当萃取pH2.0、萃取相比1.0、萃取时间10 min、1次萃取时,Ni2+的萃取率可达74.56%;以浓度为6.0 mol/L的HCl溶液为反萃剂,反萃富含Ni2+的有机相,当反萃相比1.5、反萃时间10 min时,Ni2+的反萃率可达93.10 %。
b)在实验优化的条件下,采用再生后的SSX萃取剂对废液连续萃取4次后,Ni2+的累计萃取率达91.00%,萃取液中Ni2+质量浓度为14.94 g/L。
c)反萃液经浓缩、结晶处理可制备电镀用NiCl2产品,产品质量符合HG/T 2771—2009《电镀用氯化镍》规定的要求。
[1] 周臻杭,吕德斌,周天明. 高纯度三氯化铁生产工艺:中国,103183390A[P]. 2013-07-03.
[2] 保积庆,徐劼,沈筱芳. 膜电解工艺处理碱性含铜蚀刻废液[J]. 环境工程学报,2013,7(5):1803 -1806.
[3] 赫东波,刘波,王莉. 利用氯化镍溶液制备氧化镍产品及回收盐酸的设备:中国,103086443A[P]. 2013-05-08.
[4] 王志刚,余静,杨迎春,等. 萃取净化电镀含镉废水[J]. 环境工程学报,2013,7(6):2245-2249.
[5] 张仪. 从氨溶液中萃取镍的试验研究[J]. 湿法冶金,2009,28(2):96-98.
[6] Gazda D B,Fritz J S,Porter M D. Determination of nickel(II) as the nickel dimethylglyoxime complex using colorimetric solid phase extraction[J]. Anal Chim Acta,2004,508(1):53-59.
[7] 闫雷,于秀娟,李淑琴,等. 硼氢化钠还原法处理化学镀镍废液[J]. 化工环保,2002,22(4):213-216.
[8] Wang Duodong,Chen Ailiang,Zhao Zhongwei,et al.Extraction of nickel from nickel alloy by carbonylation[J].Transition Met Chem,2009,34(3):313-316.
[9] 赵立新,印博林,张宁,等. 自催化还原法回收化学镀镍废液[J]. 电镀与精饰,2012,34(4):26-29.
[10] Nogueira C A,Oliveira P C,Pedrosa F M. Separation of cadmium,cobalt,and nickel by solvent extraction using the nickel salts of the extractants[J]. Solvent Extr Ion Exch,2009,27(2):35-54.
[11] 张利文,黄万抚. 综述乳状液膜法处理含镍废水的原理与研究现状[J]. 四川有色金属,2004(1):43-46.
[12] 刘娟,张振忠,赵芳霞,等. 硼氢化钠还原法从化学镀镍废液中回收镍[J]. 电镀与环保,2010,30(1):37-40.
[13] 张小娟,李鑫钢,曹宏斌. LK-C2萃取分离废线路板酸浸液中的铁和镍[J]. 化工进展,2009,28(4):703-707.
[14] 谭静进,吴开洪,张敏,等. LiCoxNiyMn1-x-yO2中镍、钴、锰的快速测定[J]. 电池,2012,42(1):50-53.
[15] 王磊. 重铬酸钾法测定矿石中铁元素方法的改进[J].科技资讯,2012(18):91.
[16] 原国家环保局《水和废水监测分析方法》编委会.水和废水监测分析方法[M]. 4版. 北京:中国环境科学出版社,2002:102.
[17] 中华人民共和国工业和信息化部. HG/T 2771—2009电镀用氯化镍[S]. 北京: 化学工业出版社,2010.
