代谢型谷氨酸受体调节剂在颅脑损伤后应用研究进展
2014-10-11昊综述戴双双许民辉审校第三军医大学大坪医院神经外科重庆40004第三军医大学基础部生物化学与分子生物学教研室重庆400038
王 昊综述,戴双双,许民辉审校(.第三军医大学大坪医院神经外科,重庆 40004 ;.第三军医大学基础部生物化学与分子生物学教研室,重庆 400038)
在全世界范围内,创伤性颅脑损伤(TBI)的高死残率在现代社会中严重威胁着人类生命及生活质量。颅脑创伤后可导致无数的代谢和生化过程,其机制复杂,兴奋性氨基酸的释放、炎性反应、氧自由基反应、脑缺血、Ca2+超载、缺血再灌注损害等病理性损害又进一步加重了脑损伤。多项药物治疗颅脑创伤的临床多中心随机双盲研究中包括激素、自由基清除剂、钙拮抗剂、谷氨酸(Glu)受体拮抗剂、生长激素/胰岛素样生长因子、缓激肽拮抗剂、抗癫痫药等,迄今为止还没有一种外源性药物被证实对TBI有确切的疗效[1]。随着对颅脑损伤的继发性损害机制及治疗认识的进一步加深,内源性神经保护机制成为治疗颅脑创伤关注的焦点[2]。
Glu作为神经系统主要的快速兴奋性神经递质,其兴奋毒性作用是引起神经功能损害的主要原因。以往对Glu的兴奋毒性作用被认为与一些慢性神经退行性变有关,如肌萎缩侧索硬化症、多发性硬化症、帕金森氏病、阿尔茨海默病、抑郁症、精神分裂症等[3-4]。近年来学者对中枢神经系统急性损伤后Glu失调进行大量研究,认为在中枢神经系统急性损伤后Glu的大量释放是造成一系列级联反应进而导致细胞死亡的主要原因。Glu的兴奋毒性作用是通过其受体(GluR)介导的,目前对于GluR功能的认识仍不完全。GluR家族的成员较多,这些受体广泛的在各种神经元及胶质细胞中表达,既可以是突触前受体,也可以是突触后受体,既可以介导兴奋性效应,也可以介导抑制性效应,并参与其他离子型受体的调节[5],虽然发现多种GluR调节剂,但仍无法有效阻断或减轻继发性脑神经元的损害。因此必须了解创伤后Glu受体的生理、生化、药理学变化特点才能有针对性地进行治疗,以起到神经保护和减轻损伤的目的。
1 Glu与兴奋毒性
Glu是中枢神经系统含量最多的氨基酸,Glu的兴奋毒性作用主要是通过GluR介导的,脑组织损伤后Glu浓度明显升高可使GluR激活,引起神经细胞下述变化:(1)GluR活化可引起短期内Glu摄取的抑制和刺激Glu进一步释放,使神经细胞外液中Glu浓度过度升高。Dai等[6]观察小鼠TBI后24h内其脑脊液Glu浓度的动态变化规律:TBI后15min,Glu浓度达到第一个相对高峰,然后逐渐回落,3h时相对水平较低;随后又呈现上升趋势,到12h时达到最高峰,然后逐渐降低,但仍高于基础水平。虽然文献报道TBI后Glu变化会因致伤方式、伤情轻重以及伤者不同而有所不同,但总体规律是相似的。(2)GluR的活化可引起神经细胞去极化,使神经细胞兴奋性增高,导致Na+、K+、Cl-、Ca2+等离子通道的通透性增加,使细胞内外离子分布异常,引起神经细胞的多种生理生化特性改变。神经细胞去极化后首先破坏细胞内外的Cl-平衡,使Cl-通道开放,细胞内Cl-增加,渗透压增高,导致细胞肿胀。此后Ca2+通道开放,大量的Ca2+进入细胞内,并使细胞内原贮存的Ca2+释放,造成细胞内Ca2+超载。而细胞内Ca2+超载一方面可引起神经细胞的脂质和蛋白质代谢紊乱,另一方面Ca2+进入脑血管壁,可通过钙调素或直接作用于内皮细胞,刺激胞饮转运增强,细胞收缩,使血脑屏障紧密连接扩大,通透性增高,最终导致脑组织水分增多、神经细胞肿胀、细胞膜损伤、蛋白质水解,引起不可逆性蛋白质变性而致神经细胞死亡。(3)GluR的活化还可引起神经细胞葡萄糖利用的增加,抑制某些蛋白质的合成,胶质细胞肿胀,巨噬细胞活化。
2 GluR
2.1 离子型GluR(iGluR) iGluR包括使君子酸受体(QAR)、海人藻酸受体(KAR)、N-甲基-D-天门冬氨酸受体(NMDAR)和α-氨基-3羟基-5甲基-4异恶唑受体(AMPAR)。NMDAR属配体门控的离子通道,在兴奋毒性作用中起较重要的作用,其可能是损伤后以持续性Ca2+内流为特征。AMPAR和KAR过度兴奋介导神经细胞急性渗透性肿胀,以Na+内流,随即Cl-和H2O被动内流为特征[7-8]。虽然抑制iGluR的释放在动物实验中证明对神经系统起到保护作用,然而在应用于人体时却令人失望,并且应用单一的iGluR拮抗剂会加剧神经细胞凋亡[9]。
2.2 代谢型GluR(mGluR) mGluR属于G蛋白耦联受体家族,可通过G蛋白介导直接与离子通道耦联,抑制K+和Ca2+通道开放,K+电导降低,引起缓慢的去极化,增加细胞的兴奋性[10]。mGluR还可以在突触前、后调节兴奋性和抑制性突触传递。目前已知的mGluR家族有8个成员(Glu1~8),根据氨基酸序列同源性、药理学特性、选择性激动剂及细胞内信号转导机制的不同分为3组(Ⅰ组、Ⅱ组、Ⅲ组),其分布具有差异和重叠性。Ⅰ组mGluRs包括mGluR1和mGluR5,主要分布于大脑皮质浅层、基底节、海马齿状回等处,与磷脂酶C(PLC)偶联,活化PLC后促使磷脂酰肌醇水解生成三磷酸肌醇和二酰基甘油,使细胞内Ca2+释放,并激活蛋白激酶C(PKC),PKC可以催化细胞膜钙通道磷酸化,促进Ca2+内流。mGluR1还可刺激cAMP的生成和AA的释放和降解。Ⅱ组mGluRs包括mGluR2和mGluR3,主要分布于大脑皮层和海马等处,与Gi/o耦联后被激活,抑制环磷腺苷的形成和电压敏感的Ca2+通道,激活K+通道。Ⅲ组mGluRs包括mGluR4、mGluR6、mGluR7和mGluR8,主要分布于大脑皮层、calleja岛、海马等处,也是与Gi/o耦联,激活后抑制腺苷酸环化酶的活性,Taylor等[11]报道选择性激动小胶质细胞上的Ⅲ组mGluRs能够抑制小胶质细胞活化,保护原代培养小脑神经元免受LPS及Aβ蛋白的损伤。Ⅱ、Ⅲ组mGluRs均与腺苷酸环化酶AC抑制相耦联,对cAMP生成具有强烈的抑制作用,并可抑制电位门控Ca2+通道活性。
mGluRs与中枢神经系统多种病理、生理过程有关,除参与学习、记忆、突触神经递质传递和可塑性调节以及疼痛反应等正常生理过程外,还与中枢神经系统损伤后NO产生、APPs表达、早基因(IEG)表达以及核糖体合成有关,并且与iGluRs具有相互调节作用,共同参与中枢神经系统损伤后继发性病理过程。一般认为mGluRs在神经膜上分布不同,第Ⅰ组mGluRs主要分布在突触后,调节iGluRs介导的兴奋及电流,兴奋后对神经细胞造成损伤[12];Ⅱ组及Ⅲ组mGluRs主要分布在突触前,调节Glu或其他神经递质的释放,激活时可对神经细胞产生保护作用。由此推断,激活Ⅰ组mGluRs可以加重脑组织损伤,抑制其作用可以减轻损伤,起到神经保护作用[13]。而Ⅱ、Ⅲ组mGluRs的活化可以减轻脑组织损伤,被抑制后则产生相反的作用[14-15]。现阶段mGluR作为潜在的治疗目标,针对其生理、病理的研究已受到很大重视。
3 mGluR的药理学及生理功能
在所有mGluR的激动剂及拮抗剂中,tACPD、L-AP4、LCCG-Ⅰ和L-CCGⅡ对mGluR的作用最强,其次是DCG-Ⅳ和L-SOP。其他一些能特异作用于mGluR的药物是苯甘氨酸的衍生物,如(+)MCPG、(S)3HPG、(S)4C3HPG、(S)3C4HPG和(S)4CPG。R型4CPG和3C4HPG则是AMPA和NMDA受体拮抗剂。Ⅰ组mGluR,激动剂的作用强度顺序为QA>Glu>Ⅰbo>L-CCG-Ⅰ>tACPD。苯甘氨酸的许多衍生物是mGluRⅠ的拮抗剂,例如4C3HPG和4CPG是Ⅰ组mGluRs的特异性强拮抗剂。Ⅱ组mGluR,激动剂的作用强度顺序为DCG-Ⅳ>L-CCG-Ⅰ>Glu>tACPD> Ⅰbo>QA,苯甘氨酸衍生物如4CPG、4C3HPG和3C4HPG对于mGluRⅠ是拮抗剂,而对mGluRⅡ却是激动剂。Ⅲ组mGluR对L-AP4非常敏感,对L-SOP较敏感,但对L-Glu的敏感性很低。mGluR4对Ⅰbo高度敏感,mGluR7对L-AP4和L-Glu亲和性很低,目前还未发现Ⅲ组mGluR特异性阻断剂。但鼠脊髓片的生理学研究提示α-甲基-LAP4可能是Ⅲ类mGluR的阻断剂。见表1。
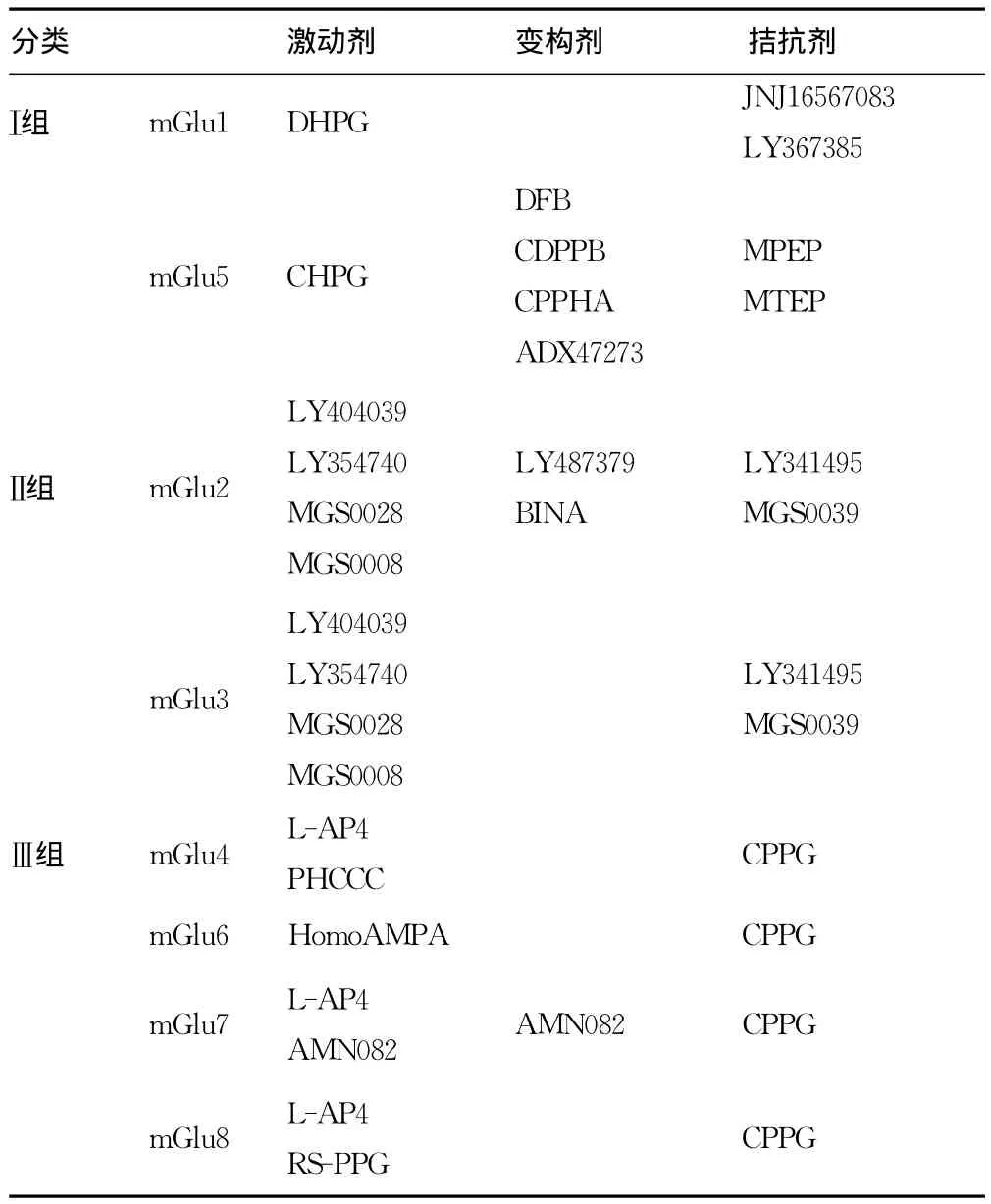
表1 mGluR分类及其调节剂
4 特异性mGluR激动剂或拮抗剂在脑损伤后的作用
脑损伤后应用Ⅰ组mGluRs激动剂,如QA(在AMPA受体拮抗剂存在下)、3HPG、DHPG等能增强NMDA的兴奋毒性作用,3HPG还可加速神经元由于缺氧和葡萄糖剥夺引起的损害作用[16],4CPG和4C3HPG则是最强的 mGluRⅠ拮抗剂,但同时对mGluRⅡ有激动作用,初步证实(S)-4C3HPG可通过抑制Glu释放及炎症介质产生,从而减轻颅脑创伤急性期的损伤[17]。DHPGR在转染细胞中只激活 mGluR5而对mGluR1无作用,是一种能区别mGluRⅠ亚型的激动剂[18],mGlu5激动剂CHPG刺激纹状体内Glu释放可能参与A2A受体神经保护作用[19]。CHPG激活mGluR5还可以通过减少NO合酶的表达,明显抑制小胶质细胞活性[20],实验证明,增强mGluR5的活性与选择性激动剂如CHPG可能对脑外伤治疗有一定作用[21]。Ⅰ组 mGluRs拮抗剂(RS)-1-aminoindan-1,5-dicarboxylic acid(AIDA)在脑损伤后的体内外实验中已得到证实,AIDA可以阻断在创伤诱导的mGluRs和磷脂酶C的活性,从而抑制星形胶质细胞IP3的高表达,减轻神经功能的缺失[22-24]。mGluR2/3的激动剂LY379268能使黑质6-OHDA损毁大鼠多巴胺更新增加,改善整体运动功能。实验证明,LY379268 可以明显减轻星形胶质细胞死亡,p53和BAX活性,和线粒体通透性,LY379268 通过拮抗mGluR3阻止了中枢神经系统损伤后因 NO失调产生的炎性反应[25]。(s)-alphaethylglutamic acid(EGLU)可以拮抗LY379268 的作用。LY354740 (100μM)可显著减少损伤2h后引起的Glu释放增加,同时神经元的死亡减少[26]。选择性激动神经胶质细胞上mGluRs可发挥神经保护作用。如脑内微注射Ⅱ组激动剂DCG-IV能够保护纹状体部位多巴胺神经元免受1-甲基-4-苯基-吡啶离子(Mpp+)的损伤,其机制与促进星形胶质细胞释放神经源性生长因子有关[27],实验表明应用DCG-Ⅳ可以减轻神经递质长时程抑制(LTD)作用。离体实验表明Ⅱ组激动剂DCG-Ⅳ及4C3HPG通过促进星形胶质细胞释放转化生长因子,而保护原代培养皮层神经元免受NMDA毒性损伤[28]。(2R,4R)-APDC(APDC)可以使从大鼠分离出的神经元和神经胶质细胞的GLAST和GLT-1蛋白水平增高,增强了对Glu的摄取,降低兴奋毒性,而起到脑保护作用[29]。Ⅲ组激动剂LAP4通过抑制胶质细胞化学趋化因子RanteS的产生,保护小脑神经元[30]。
综上所述,mGluRs不同亚单位的组合及突触前后分布差异对神经损害后的功能产生不同的影响,不同的mGluRs转导机理不同,因此mGluRs对Glu介导的突触传递可以是增强作用也可以表现为抑制效应,目前已经开发出这些受体的激动剂、拮抗剂、增效剂、减效剂,这些研究在生理学、药理学及在治疗中的应用具有重要意义。
5 展 望
Glu及其受体的变化所致的兴奋毒性在TBI后脑缺血缺氧时的机制极为复杂,涉及许多因素,并且各因素之间联系密切,其调节剂在创伤后往往起到双向作用,单一应用某种受体的调节剂都是片面的,因此mGluR对调节剂在TBI后的应用仍需进行深入的探索。mGluR家族成员众多,在中枢神经系统损伤中的作用也十分复杂,可能是由于不同亚单位组合及突触前后分布差异对功能产生影响,但其确切作用有待进一步研究。进一步认识TBI后Glu及其受体的变化、兴奋毒性作用机制,预防性阻断兴奋毒性可以改善脑损伤的预后。开发高选择性的mGluR调节剂,在颅脑损伤后有限的治疗时间窗内,配合或合用效果好、不良反应小的神经保护药,减少继发性损害带来的神经功能障碍,降低病死率,促进神经功能恢复等都具有重要的意义。
[1]Muir KW,Lees KR,Clinical experience with excitatory amino acid antagonist drugs[J].Stroke,1995,26(3):503-513.
[2]Caraci F,Battaglia G,Sortino MA,et al.Metabotropic glutamate receptors in neurodegeneration/neuroprotection:still a hot topic[J].Neurochem Int,2012,61(4):559-565.
[3]Araújo IM,Carreira BP,Carvalho CM,et al.Calpains and delayed Calcium deregulation in excitotoxicity[J].Neurochem Res,2010,35(12):1966-1969.
[4]Hugon J VJ,Dumas M.Role of glutamate and excitotoxicity in neurologic diseases[J].Rev Neurol(Paris),1996,152(4):239-248.
[5]Willard SS,Koochekpour S.Glutamate,glutamate receptors,and downstream signaling pathways[J].Int J Biol Sci,2013,9(9):948-959.
[6]Dai SS,Zhou YG,Li W,et al.Local glutamate level dictates adenosine A2Areceptor regulation of neuroinflammation and traumatic brain injury[J].J Neurosci,2010,30(16):5802-5810.
[7]Dogan A,Rao AM,Baskaya MK,et al.Contribution of polyamine oxidase to brain injury after trauma[J].J Neurosurg,1999,90(6):1078-1082.
[8]Madsen UST,Krogsgaard-Larsen P.Inhibitors of AMPA and kainate receptors[J].Curr Med Chem,2001,8(11):1291-1301.
[9]Ikonomidou C,Turski L.Why did NMDA receptor antagonists fail clinical trials for stroke and traumatic brain injury[J].Lancet Neurol,2002,1(6):383-386.
[10]Heuss C,Scanziani M,Gähwiler BH,et al.G-protein-independent signaling mediated by metabotropic glutamate receptors[J].Nat Neurosci,1999,2(12):1070-1077.
[11]Taylor DL,Jones F,Kubota ES,et al.Stimulation of microglial metabotropic glutamate receptor mGlu2triggers tumor necrosis factor alpha-induced neurotoxicity in concert with microglial-derived Fas ligand[J].J Neurosci,2005,25(11):2952-2964.
[12]Zieminska ESA,Lazarewicz JW.Role of group I metabotropic glutamate receptors and NMDA receptors in homocysteine-evoked acute neurodegeneration of cultured cerebellar granule neurones[J].Neurochem Int,2003,43(4/5):481-492.
[13]Ansah OB,Goncalves L,Almeida A,et al.Enhanced pronociception by amygdaloid group I metabotropic glutamate receptors in nerve-injured animals[J].Exp Neurol,2009,216(1):66-74.
[14]Maiese K,Vincent A,Lin SH,et al.Group I and group III metabotropic glutamate receptor subtypes provide enhanced neuroprotection[J].J Neurosci Res,2000,62(2):257-272.
[15]Neugebauer VCP,Willis WD.Groups II and III metabotropic glutamate receptors differentially modulate brief and prolonged nociception in Primate STT cells[J].J Neurophysiol,2000,84(6):2998-3009.
[16]Buisson A,Choi DW.The inhibitory mGluR agonist,S-4-carboxy-3-hydroxy-phenylglycine selectively attenuates NMDA neurotoxicity and oxygen-glucose deprivation-induced neuronal death[J].Neuropharmacology,1995,34(8):1081-1087.
[17]Yang N,Dai SS,Ning YL,et al.Effect of(S)-4C3HPG on brain damage in the acute stage of moderate traumatic brain injury model of mice and underlying mechanism[J].Sheng Li Xue Bao,2010,62(6):555-559.
[17]Le Duigou C and Kullmann DM,Group I mGluR Agonist-Evoked Long-Term Potentiation in Hippocampal Oriens Interneurons[J].J Neurosci,2011 31 (15):5777-5781.
[19]Pintor A,Pèzzola A,Reggio R,et al.The mGlu5receptor agonist CHPG stimulates striatal glutamate release:possible involvement of A2Areceptors[J].Neuroreport,2000,11(16):3611-3614.
[20]Loane DJ,Stoica BA,Pajoohesh-Ganji A,et al.Activation of metabotropic glutamate receptor 5modulates microglial reactivity and neurotoxicity by inhibiting NADPH oxidase[J].J Biol Chem,2009,284(23):15629-15639.
[21]Chen T,Zhang L,Qu Y,et al.The selective mGluR5agonist CHPG protects against traumatic brain injury in vitro and in vivo via ERK and Akt pathway[J].Int J Mol Med,2012,29(4):630-636.
[22]Chen T WK,Ellis EF.Group I metabotropic receptor antagonism blocks depletion of Calcium stores and reduces potentiated capacitative Calcium entry in strain-injured neurons and astrocytes[J].J Neurotrauma,2004,21(3):271-281.
[23]Lyeth BG,Gong QZ,Shields S,et al.Group I metabotropic glutamate antagonist reduces acute neuronal degeneration and behavioral deficits after traumatic brain injury in rats[J].Exp Neurol,2001,169(1):191-199.
[24]Faden AI,O'leary DM,Fan L,et al.Selective blockade of the mGluR1receptor reduces traumatic neuronal injury in vitro and improvesoOutcome after brain trauma[J].Exp Neurol,2001,167(2):435-444.
[25]Durand D,Caruso C,Carniglia L,et al.Metabotropic glutamate receptor 3activation prevents nitric oxide-induced death in cultured rat astrocytes[J].J Neurochem,2010,112(2):420-433.
[26]Movsesyan VA,Faden AI.Neuroprotective effects of selective group II mGluR activation in brain trauma and traumatic neuronal injury[J].J Neurotrauma,2006,23(2):117-127.
[27]Venero JL,Santiago M,Tomas-Camardiel M,et al.DCGIV but not other group-II metabotropic receptor agonists induces microglial BDNF mRNA expression in the rat striatum.Correlation with neuronal injury[J].Neuroscience,2002,113(4):857-869.
[28]Lucas SJ,Bortolotto ZA,Collingridge GL,et al.Selective activation of either mGlu2or mGlu3receptors can induce Ltd in the amygdala[J].Neuropharmacology,2013,66(7):196-201.
[29]Beller JA,Gurkoff GG,Berman RF,et al.Pharmacological enhancement of glutamate transport reduces excitotoxicity in vitro[J].Restor Neurol Neurosci,2011,29(5):331-346.
[30]Wenthur CJ,Morrison R,Felts AS,et al.Discovery of(R)-(2-fluoro-4-((-4-methoxyphenyl)ethynyl)phenyl)(3-hydroxypiperidin-1-yl)methanone(ML337),an mGlu3 selective and CNS penetrant negative allosteric modulator(NAM)[J].J Med Chem,2013,56(12):5208-5212.
