三阴性乳腺癌新辅助化疗前Ki-67表达与病理完全反应相关性的Meta分析*
2014-10-11龙行华武汉大学中南医院检验科武汉430071
张 莉,龙行华(武汉大学中南医院检验科,武汉 430071)
三阴性乳腺癌(TNBC)是指雌激素受体、孕激素受体和表皮生长因子受体2(Her-2)均为阴性的乳腺癌,因而对内分泌治疗和抗Her-2治疗无效。除了手术和放疗外,化疗尤其是新辅助化疗,已成为TNBC患者惟一的治疗方式。临床上常用病理完全反应(pCR)作为新辅助化疗疗效判定终点。结果表明,同其他亚型相比,TNBC患者有较高的pCR[1]。而相对未取得pCR,取得pCR的TNBC患者预后较好。Ki-67是一种存在于增殖细胞核基质内的抗原,常被视为细胞增殖的分子标记。对于Ki-67能否预测TNBC新辅助化疗疗效,研究者们一直没有统一观点。因此,本文运用询证医学的原理和方法,对国内外公开发表的有关Ki-67和TNBC患者新辅助化疗后pCR相关性的文章进行客观评价,以探讨化疗前Ki-67在预测TNBC新辅助化疗疗效中的价值。
1 资料与方法
1.1 检索策略 使用检索词检索中文期刊全文数据库(CNKI)、万方数据库及外文数据库PubMed。中文检索词是“乳腺癌”和“新辅助化疗”和“病理完全反应”和“Ki-67”。外文检索词是“breast cancer”and“neoadjuvant chemotherapy”and“pathological complete response”and“Ki-67”。同时手工检索纳入的参考文献,对于重复发表的文献,选择研究数据最全面的一篇。检索时间均为建库至2014年6月9日。
1.2 纳入标准 研究对象需涉及在TNBC新辅助化疗前Ki-67表达和pCR相关性的内容;需要有充分的原始数据能够计算出化疗前Ki-67表达与TNBC新辅助化疗后pCR相关性的风险比(RR);研究仅涉及人类乳腺癌。
1.3 排除标准 研究设计中只有Ki-67表达,而没有区分Ki-67高表达组和Ki-67低表达组与pCR的关系;文章是综述和英文文章中的信;缺乏相应数据而不能计算出RR。
1.4 文献筛选和资料提取 先阅读文献题目,按照纳入和排除标准筛选文献,并进行资料提取。提取资料的内容包括:纳入文献的第一作者名称、发表年限、国家来源、Ki-67的临界值及新辅助化疗药品等。
1.5 统计学处理 采用Cochrane国际协作网提供的RevMan 5.2软件进行统计分析。用χ2检验验证所纳入文献的异质性。若P异质性≥0.1,表明各文献间同质性,则采用固定效应模型;若P异质性<0.1,表明各文献间有异质性,则采用随机效应模型进行Meta分析。此外,当存在异质性时,χ2检验中的I2值可用于代表异质性的大小。若I2=0%~25%表明没有异质性;25%~50%表明有适度异质性;50%~75%表明有大的异质性;75%~100%表明有极端的异质性。采用漏斗图评价文献的出版偏倚,漏斗图的对称可认为没有出版偏倚。
2 结 果
2.1 文献检索的结果 按照纳入和排除标准,最终纳入文献10篇[2-11]。其中3篇为中文文献[2-4],7篇为英文文献[5-11],纳入文献基本特征见表1。其中有4篇文献[3,4,6,8]的 Ki-67临界值为50%,因此把这4篇文献作为一个亚组,对其进行分析,结果显示RR=4.7,95%CI=2.40-9.21(P<0.01)。有5个研究[2,4,6,7,9]使用了多西他赛,结果表明 RR=4.88,95%CI=2.60~9.16(P<0.01),有3个研究[3,8,10]使用了紫杉烷类,结果表明RR=3.06,95%CI=1.31~7.12(P=0.01)。
2.2 统计分析
2.2.1 异质性检验与效应合并结果 用χ2检验验证所纳入的10篇文献的异质性。结果显示P异质性=0.8且I2=0%,表明各文献间不存在异质性,因此采用固定效应模型计算合并RR=4.04,95%CI=2.66~6.15,差异有统计学意义(P<0.01),表明TNBC患者新辅助化疗前Ki-67高表达组获得pCR率大约是Ki-67低表达组的4倍。见图1。

表1 纳入文献基本特征
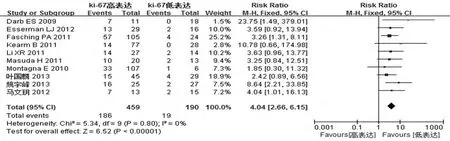
图1 森林图:评价三阴性乳腺癌新辅助化疗前Ki-67表达与pCR相关性
2.2.2 发表性偏倚 绘制的漏斗图显示,10篇文献分布形状基本对称,上窄下宽,呈倒置漏斗形,提示没有发表偏倚。
3 讨 论
新辅助化疗是指对非远处转移性肿瘤在局部治疗前,进行系统性、全身性的细胞毒性治疗[3]。与传统化疗相比,新辅助化疗可监控治疗期间患者的反应,以便在无效时改变或中断治疗,从而使患者避免无效化疗药品的不良反应[12]。因此,预测新辅助化疗疗效的指标对评价疗效及判断患者预后是至关重要的。一些研究证明,pCR是远期疗效的替代指标[12]。化疗后,与未获得pCR的患者相比,获得pCR的患者有更好的长期生存率[10]。在涉及乳腺癌亚型的多变量分析中,pCR能预测疾病无复发生存率[11]。Ki-67是一种存在于增殖细胞核基质内的抗原,除G0期外,Ki-67在其他细胞周期中都有表达。Ki-67的半衰期大约为1~1.5h,脱离细胞周期后迅速降解,故Ki-67可作为检测肿瘤细胞增殖活性的指标。有研究表明,Ki-67能进一步提高pCR在各种乳腺癌亚型的预测能力[11]。
本文运用询证原理和方法,评价TNBC新辅助化疗前Ki-67表达与pCR相关性。总共纳入10篇文献,其中2篇是前瞻性研究[3,6],8篇为回顾性研究[2,4,5,7-11]。结果显示 RR=4.04,95%CI=2.66~6.15。表明 TNBC新辅助化疗前,Ki-67高表达组获得pCR率大多是Ki-67低表达组的4倍,差异有统计学意义(P<0.01)。虽然纳入文献间不存在异质性(P异质性=0.8,I2=0%),但是 Ki-67在不同文献中的临界值不同。基于有4篇文献[3,4,6,8]的 Ki-67的临界值都是50%,因此把这4篇文献作为一个亚组,对其进行分析,结果显示RR=4.7,95%CI=2.40~9.21(P<0.01)。其 RR值高于全部纳入文献的RR值,这表明Ki-67临界值越高,化疗前Ki-67表达量越高,获得pCR率越大。同时表明,不同Ki-67临界值能造成不同的结果。Fasching等[5]的研究表明,若临界值为13%,TNBC新辅助化疗后pCR率是49%,差异无统计学意义(P>0.05);而TNBC亚组的临界值35%,pCR率是54%,差异有统计学意义(P<0.05)。因此,对于此文献,本研究选择纳入临界值为35%的数据。
除了判定Ki-67高表达的临界值不同,本文所纳入的研究在评定Ki-67整个过程中也不同,尽管都是用免疫组化方法测定Ki-67。Polley等[13]研究了 Ki-67在8个高级实验室内部和实验室间的测量结果重复性程度。结果表明,同一实验室内部的重复性高,而多个实验室间的重复性仅为中度。这种测量结果不一致性主要来源于肿瘤区域选择、计数方法、染色阳性的主观评定。在评定Ki-67表达过程中的不一致性,可能会导致Ki-67结果间存在差异,从而影响本文Meta分析的质量。
由于本文Meta分析纳入研究所用的新辅助化疗药不全相同,因此分亚组进行讨论。有5个研究[2,4,6,7,9]使用了多西他赛,结果表明RR=4.88,95%CI=2.60-9.16(P<0.01),有3个研究[3,8,10]使用了紫杉烷类,结果表明 RR=3.06,95%CI=1.31~7.12(P=0.01)。说明与紫杉烷治疗相比,Ki-67高表达组经多西他赛新辅助化疗后,更易获得pCR。但是由于有其他药物联合治疗及样本量较小,这种结论有待进一步研究证实。
有研究证实,获得pCR患者的长期生存率高于未获得pCR患者[10]。而本文Meta分析表明:化疗前Ki-67高表达的TNBC患者比低表达者更有可能获得pCR。因此,化疗前Ki-67高表达与生存时间是否存在一定的正相关关系?有研究证明,化疗前Ki-67高表达的TNBC患者,pCR率高,但是由于高复发率而预后不良[8]。此外,有研究证明新辅助化疗后Ki-67高表达提示预后不良,甚至在未获得pCR的化疗后Ki-67低表达者有良好的预后。Dowsett等[14]研究表明:在激素受体阳性的乳腺癌患者中,接受2周内分泌治疗后Ki-67高表达者有更低的无复发生存(DFS)时间。而Matsubara等[15]研究表明,新辅助化疗前后Ki-67表达改变量与DFS有关,而化疗前后Ki-67表达量与DFS无关。因此,化疗前Ki-67表达量,化疗后Ki-67表达量及前后Ki-67表达改变量与生存率间的关系有待进一步研究。
综上所述,TNBC患者新辅助化疗前Ki-67高表达预示更高的pCR率。为了进一步证实化疗前Ki-67对TNBC患者新辅助化疗疗效的预测能力,有关Ki-67预测pCR大规模的随机对照试验是必要的,这同时有助于探讨Ki-67预后能力。本Meta分析由于样本量不多(TNBC患者Ki-67高表达459例,Ki-67低表达190例);纳入文献缺乏统一评定Ki-67表达的标准和临界值;纳入文献大部分是回顾性研究,而只有2篇是前瞻性研究,所以其他研究还有待进一步扩大样本继续研究。
[1]Bernsdorf M,Ingvar C,Jorgensen L,et al.Effect of adding gefitinib to neoadjuvant chemotherapy in estrogen receptor negative early breast cancer in a randomized phase II trial[J].Breast Cancer Res Treat,2011,126(2):463-470.
[2]叶国麟,杨劼,古卫权,等.Ki-67表达对三阴性乳腺癌新辅助化疗疗效影响[J].河北医药,2013,19(6),832-834.
[3]马文玥.卡铂联合紫杉醇治疗局部晚期三阴性乳腺癌的II期临床研究[D].北京:中国医学科学院肿瘤医院肿瘤研究所,2012.
[4]姚宇锋,龚建平,唐金海,等.Ki-67预测三阴性乳腺癌新辅助化疗疗效的价值[J].肿瘤基础与临床,2013,26(5),403-405.
[5]Fasching PA,Heusinger K,Haeberle L,et al.Ki67,chemotherapy response,and prognosis in breast cancer patients receiving neoadjuvant treatment[J].BMC Cancer,2011,11(2):486-498.
[6]Li XR,Zhang YJ,Wang JD,et al.CK5/6,EGFR,Ki-67,cyclin D1,and nm23-H1protein expressions as predictors of pathological complete response to neoadjuvant chemotherapy in triple-negative breast cancer patients[J].Med Oncol,2011,28(Supll 1):129-134.
[7]Keam B,Lee KH,Han SW,et al.Ki-67can be used for further classification of triple negative breast cancer into two subtypes with different response and prognosis[J].Breast Cancer Research,2011,13(2):22.
[8]Masuda H,Masuda N,Kodama Y,et al.Predictive factors for the effectiveness of neoadjuvant chemotherapy and prognosis in triple-negative breast cancer patients [J].Cancer Chemother Pharmacol,2011,67(4):911-917.
[9]Darb ES,Loibl S,Roller M,et al.Identification of biologybased breast cancer types with distinct predictive and prognostic features:role of steroid hormone and HER2 receptor expression in patients treated with neoadjuvant anthracycline/taxane-based chemotherapy [J].Breast cancer research,2009,11(5),69-79.
[10]Montagna E,Bagnardi V,Rotmensz N,et al.Pathological complete response after preoperative systemic therapy and outcome:relevance of clinical and biologic baseline features[J].Breast Cancer Res Treat,2010,124(3):689-699.
[11]Esserman LJ,Berry DA,Carey L,et al.Pathologic Complete Response Predicts Recurrence-Free Survival More Effectively by Cancer Subset:ResultsFrom the I-SPY 1 TRIAL-CALGB 150007 /150012 ,ACRIN 6657[J].J Clin Oncol,2012,30(26):3242-3249.
[12]Gampenrieder SP,Rinnerthaler G,Greil R.Neoadjuvant Chemotherapy and Targeted Therapy in Breast Cancer:Past,Present,and Future[J].J Oncol,2013,2013(21):732047 .
[13]Polley MY,Leung SC,Mcshane LM,et al.An International Ki67Reproducibility Study [J].J Natl Cancer Inst,2013,105(24):1897-1906.
[14]Dowsett M,Smith IE,Ebbs SR,et al.Prognostic value of Ki67expression after short-term presurgical endocrine therapy for primary breast cancer[J].J Natl Cancer Inst,2007,99(2):167-170.
[15]Matsubara N,Mukai H,Fujii S,et al.Different prognostic significance of Ki-67change between pre-and post-neoadjuvant chemotherapy in various subtypes of breast cancer[J].Breast Cancer Res Treat,2013,137(1):203-212.
