不同剂量环孢菌素A制备免疫缺陷小鼠模型的研究
2014-10-10张予晋杨胜辉王泽亮欧小香王军文
张予晋 ,李 玲 ,杨胜辉 ,高 强 ,向 琴 ,娄 芳 ,王泽亮 ,郑 萌 ,欧小香 ,王军文 *
(1.湖南中医药大学第二附属医院,湖南 长沙 410005;2.湖南中医药大学,湖南 长沙 410208)
不同剂量环孢菌素A制备免疫缺陷小鼠模型的研究
张予晋1,李 玲2,杨胜辉2,高 强2,向 琴2,娄 芳2,王泽亮2,郑 萌2,欧小香2,王军文2*
(1.湖南中医药大学第二附属医院,湖南 长沙 410005;2.湖南中医药大学,湖南 长沙 410208)
目的研究不同剂量环孢菌素A(CsA)对小鼠免疫功能的影响,为细胞免疫缺陷型动物模型的建立奠定基础。方法实验设CsA高、中、低剂量组,溶液对照组和正常对照组。CsA高、中、低剂量组分别经腹腔注射CsA 40、25、10 mg/(kg·d),溶液对照组给予等容积的稀释液,正常对照组给予等容积生理盐水,隔天1次,共注射3次。观察以下指标:(1)CD4+T和CD8+T细胞亚群百分率;(2)小鼠脾脏、胸腺质量指数和病理变化;(3)小鼠肺组织的病理变化及小鼠死亡率。结果与正常对照组和溶液对照组比较:(1)高、中剂量CsA组CD4+T细胞亚群百分率明显下降 (P<0.05或P<0.01),高剂量组 CD8+T细胞亚群百分率明显升高(P<0.05);(2)CsA高、中剂量组胸腺指数明显下降(P<0.01),胸腺萎缩、脂肪变性、中间有淋巴小结样结构,脾脏指数各组间前后均无明显改变;高、中、低剂量组脾脏均有代偿性的白髓增大、脾小体增大、巨噬细胞增多;(3)高、中、低剂量CsA肺脏有局灶性炎症改变、间质增生、肺泡纤维度增生;高剂量组的小鼠死亡率显著升高,达60%。结论腹腔注射高、中剂量的CsA均可成功建立免疫缺陷型动物模型,但从效率和经济性考虑,中剂量CsA更适合用于模型的建立。
CsA;免疫缺陷;动物模型
艾滋病 (Acquired Immunodeficiency Syndrome,AIDS)是由人类免疫缺陷病毒(Human Immunodeficiency Virus,HIV)感染引起的获得性免疫缺陷综合征。其发病机制为艾滋病病毒破坏机体的免疫系统,尤其是破坏辅助性T淋巴细胞,导致CD4+T细胞进行性减少,细胞的免疫功能受损,并且逐渐发展一系列机会性感染及肿瘤,严重者可导致死亡[1]。由于目前尚无有效的治愈方法,AIDS已成为人类致死性传染病之一。通过中医药或者中西医结合的方法进行免疫重建,提高患者的生存质量、延长生存时间已经成为其防治重要的研究方向[2],而成功建立符合AIDS致病机制的免疫缺陷动物模型则是研究基础[3]。目前符合AIDS免疫缺陷的动物模型有很多种,但往往免疫缺陷机制和AIDS发病机制相差较大且死亡率过高,课题组为了寻找更加适合中医药AIDS免疫重建研究的免疫缺陷模型,在前期实验的基础上,以环孢菌素A(Cyclos-porin A,CsA)为造模药物,以小鼠为造模动物,分为高、中、低剂量组分别造模进行筛选合适剂量,成功造出符合AIDS发病机制的免疫缺陷动物模型,并找出性价比较高的造模剂量,以期为后续实验提供可靠模型,现报道如下。
1 材料
1.1 实验动物
昆明系小鼠,雄性,体质量20~24 g,6~8周龄,SPF级,购自湖南斯莱克景达实验动物有限公司,动物合格证号:SCXK(湘)2011-0003。
1.2 试剂
CsA由鼎国生物技术有限公司提供,产品批号K0077,规格:250 mg,4 ℃冰箱保存,用时以35%注射用乙醇稀释液稀释。Rat Anti-Mouse CD4+T FITC标记抗体 (批号:2013-12)和Rat Anti-Mouse CD8 PE标记抗体(批号:2014-07)由北京四正柏生物科技有限公司提供,4℃冰箱保存。免洗溶血素(批号:3074768)由美国BD公司提供。
1.3 主要仪器
BD FACSCcalibur TM流式细胞仪,由美国Becton-Dickinson公司提供;OLYMPUS BX43显微镜。
2 方法
2.1 模型制备
取小鼠 50 只, 随机分为高 40 mg/(kg·d)、中25 mg/(kg·d)、低剂量 10 mg/(kg·d)CsA 组、溶液组及正常对照组5组,每组10只。高、中、低剂量CsA组分别经腹腔注射给予CsA;溶液组给予相应稀释液;正常对照组给予相应生理盐水,隔天1次,共注射3次。末次注射后第2天,处死小鼠检测相应指标并评价效果。
2.2 指标检测
2.2.1 外周血T细胞亚群的检测 小鼠称质量、麻醉后打开胸腔,采用心脏采血法采血,用1 mL注射器在心尖搏动处抽取0.5 mL血液,立即放入EDTA抗凝管中,并充分混匀,取100 μL抗凝血加入10 μL CD4+T(FITC-A)单抗和 10 μL CD8(PE-A)单抗,充分混匀,室温下避光孵育20 min,加入500 μL免洗溶血素并充分混匀,室温下避光孵育20 min,上流式细胞仪进行分析。
2.2.2 脾脏、胸腺质量指数与病理变化 采血后处死小鼠分离胸腺和脾脏,用滤纸吸取表面残血,电子天平称质量,并计算器官质量指数。(器官质量指数=器官质量×1000/体质量)解剖取胸腺、脾脏、肺脏,用l0%甲醛固定、HE染色后光学显微镜下观察病理改变。
2.2.3 肺组织病理变化与小鼠死亡率 分离小鼠肺脏,用l0%甲醛固定、HE染色后光学显微镜下观察病理改变;实验全程观察小鼠死亡情况,计算死亡率。
2.3 统计学分析
3 结果
3.1 不同剂量CsA对小鼠外周血T细胞亚群百分率的影响
与正常对照组和溶液对照组比较,CsA高、中剂量组CD4+T细胞亚群百分率明显下降,差异显著(P<0.05或P<0.01);高剂量组CD8+T细胞亚群百分率明显上升,差异显著(P<0.05);高、中剂量组CD4+/CD8+T细胞明显下降,差异显著 (P<0.01)。结果表明:不同剂量CsA不同程度下调小鼠外周血CD4+T细胞亚群百分率和CD4+/CD8+T细胞,其中以中、高剂量组最为明显。结果见表1。
表1 不同剂量CsA对小鼠外周血T细胞亚群的影响 (±s)
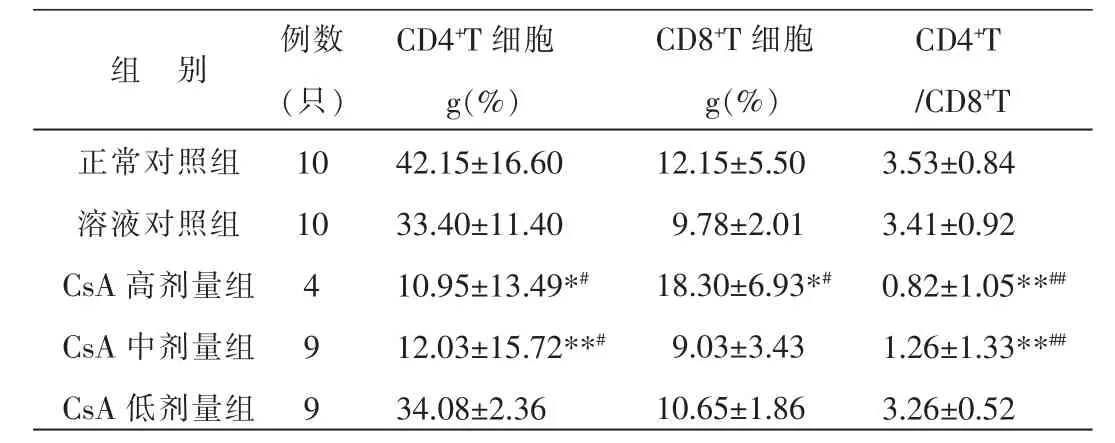
表1 不同剂量CsA对小鼠外周血T细胞亚群的影响 (±s)
注:与正常对照组比较*P<0.05,**P<0.01;与溶液对照组比较#P<0.05,##P<0.01。 下表同。
组 别正常对照组溶液对照组CsA高剂量组CsA中剂量组CsA低剂量组例数(只)10 10 4 9 9 CD4+T细胞g(%)42.15±16.60 33.40±11.40 10.95±13.49*#12.03±15.72**#34.08±2.36 CD8+T细胞g(%)12.15±5.50 9.78±2.01 18.30±6.93*#9.03±3.43 10.65±1.86 CD4+T/CD8+T 3.53±0.84 3.41±0.92 0.82±1.05**##1.26±1.33**##3.26±0.52
3.2 不同剂量CsA对小鼠脾脏、胸腺质量指数的影响
与正常对照组比较,CsA高、中、低剂量组胸腺指数明显下降(P<0.01或P<0.05);与溶液对照组比较,高中剂量组胸腺指数明显下降 (P<0.01或P<0.05)。表明:不同剂量CsA对小鼠免疫器官质量指数均有一定的抑制作用,以中、高剂量组最为明显。结果见表2。
表2不同剂量CsA对小鼠脾脏、胸腺质量指数的影响 (±s)
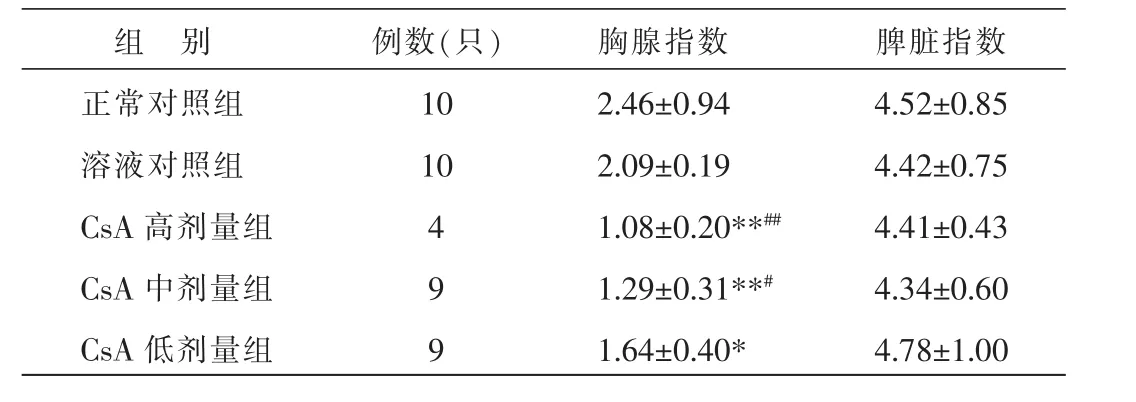
表2不同剂量CsA对小鼠脾脏、胸腺质量指数的影响 (±s)
组 别正常对照组溶液对照组CsA高剂量组CsA中剂量组CsA低剂量组例数(只)10 10 4 9 9胸腺指数2.46±0.94 2.09±0.19 1.08±0.20**##1.29±0.31**#1.64±0.40*脾脏指数4.52±0.85 4.42±0.75 4.41±0.43 4.34±0.60 4.78±1.00
3.3 不同剂量CsA对小鼠脾脏、胸腺病理变化的影响
由图1、图2可知:正常对照组和溶液对照组胸腺及脾脏无明显病理损伤,与正常对照组和溶液对照组比较,CsA高剂量组和中剂量组有明显胸腺萎缩、脂肪变性,中间可见淋巴小结样结构,低剂量组也可见胸腺萎缩。CsA高、中、低剂量组脾脏均有代偿性的白髓增大,脾小体增大,巨噬细胞增多。结果表明:不同剂量CsA对小鼠免疫器官脾脏和胸腺组织均有不同程度的损伤,严重破坏了小鼠免疫系统,影响其免疫调节功能。结果如图1、图2所示,见封三彩图。
3.4 不同剂量CsA对小鼠肺组织病理变化与小鼠死亡率的影响
由图3可知:正常对照组和溶液对照组肺脏无明显病理损伤,与正常对照组和溶液对照组比较,CsA高、中、低剂量组小鼠肺脏有局灶性炎症改变、间质增生、肺泡纤维度增生。结果表明:肺脏肺组织病理变化的改变可能与小鼠免疫功能低下,容易受到肺部感染有关。结果如图3所示,见封三彩图。
不同剂量环保菌素A对小鼠的死亡率有明显影响,低、中剂量组小鼠分别死亡1只,死亡率10%,但高剂量组小鼠死亡6只,死亡率达60%,不利于动物模型的建立。
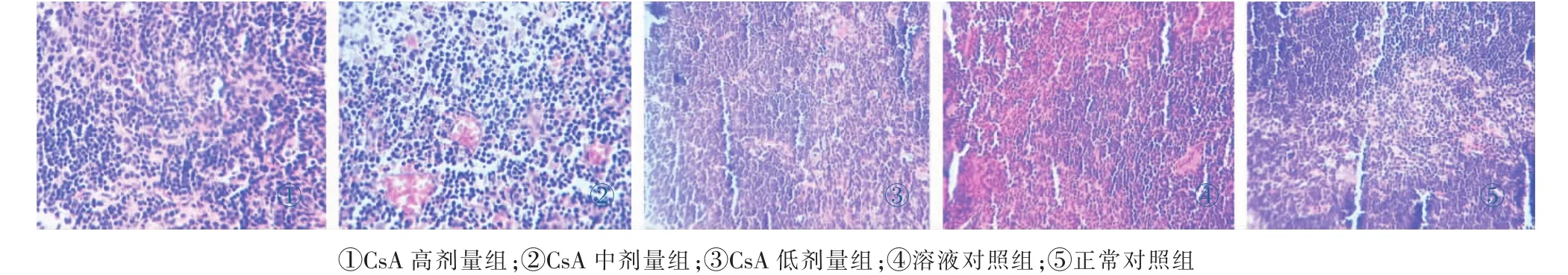
图1 各组小鼠胸腺的病理变化光镜图(HE×40)
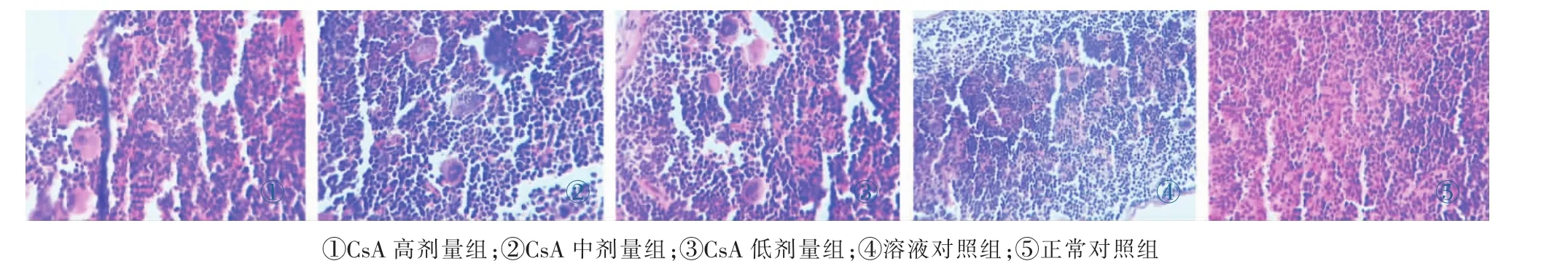
图2 各组小鼠脾脏组织的病理变化光镜图(HE×40)
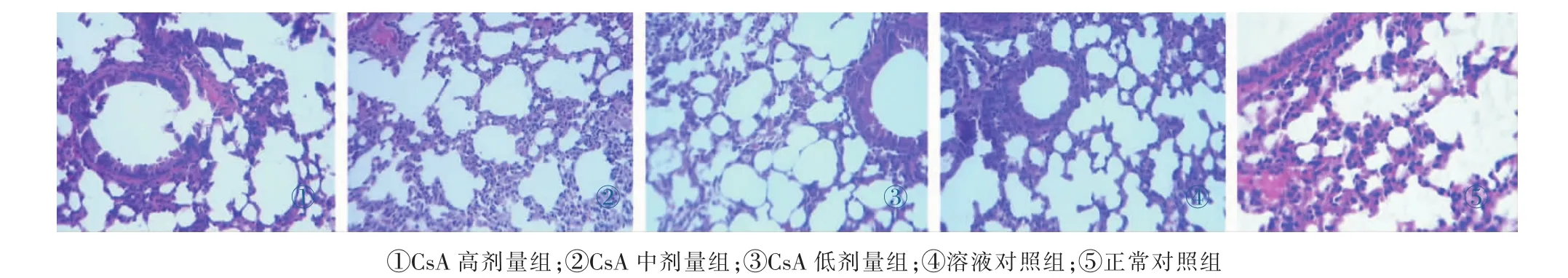
图3 各组小鼠肺脏组织的病理变化光镜图(HE×40)
4 讨论
CsA是从真菌中提取的一种免疫抑制剂,临床上常应用于器官移植后排斥反应和自身免疫性疾病的防治[4-5]。CsA对细胞免疫和胸腺依赖性抗原的体液免疫有较强的选择性抑制作用,主要选择性抑制T淋巴细胞,尤其对Th细胞产生白细胞介素-2等各种因子有明显的抑制作用,而对巨噬细胞以及B淋巴细胞的抑制作用较弱[6]。此外,CsA还可能直接影响T细胞表面结构和识别功能,阻止T细胞活化[7],是用于细胞免疫缺陷型动物模型的建立理想制剂[4]。
AIDS的发病机制是HIV选择性破坏辅助性T淋巴细胞,导致CD4+T细胞进行性减少,CD8+T细胞进行性上升,细胞的的免疫功能受损。T淋巴细胞是机体免疫系统内功能最重要的一群淋巴细胞,主要CD4+T细胞/CD8+T细胞亚群组成,因此,CD4+T细胞/CD8+T细胞百分率以及CD4+T细胞/CD8+T细胞比值可以作为衡量免疫缺陷程度的重要指标[8],更是模型免疫缺陷是否符合AIDS发病机制的重要指标。胸腺和脾脏是重要的免疫器官,胸腺的主要功能是产生T淋巴细胞和分泌胸腺素,主要参与细胞免疫;脾脏中有丰富的淋巴细胞和巨噬细胞,但B淋巴细胞比例较大,因此与体液免疫关系更为密切。
本研究结果显示:高、中、低剂量的CsA对小鼠免疫功能均有一定的抑制作用,其中以高、中剂量对小鼠免疫功能的影响最为明显。与正常对照组和溶液对照组比较,高、中剂量组CD4+T细胞百分率、胸腺指数明显下降(P<0.05或P<0.01),并伴有明显的胸腺及脾脏病理变化。由于艾滋病的发病机制是HIV选择性破坏辅助性T淋巴细胞,导致CD4+T细胞进行性减少,细胞的免疫功能受损。因此,我们认为:高、中剂量的CsA所建立的的免疫缺陷动物模型与AIDS CD4+T减少主要病理特征相吻合。但高剂量组死亡率明显高于中剂量组,从模型建立的稳定性、效率以及经济上考虑,中剂量组更适合于AIDS免疫缺陷型动物模型的建立。
[1]张学军.皮肤性病学[M].北京:人民卫生出版社,2011:236.
[2]刘 震,刘 明,李 勇,等.艾滋病免疫重建干预方法的研究进展[J].中国中药杂志,2013,38(15):2 519-2 525.
[3]杨传波,徐兴然,蔡家利.人类艾滋病动物模型研究进展[J].动物医学进展,2005,26(3):46-50.
[4]杜美蓉,李大金.环孢酶素A的临床应用机制研究进展[J].中国临床药理学杂志,2003,19(6):454-457.
[5]Yings Khan LN,Weng Q,et a1.Cyclosporin A,apoptosiaof BAL T-cells and expression of Bcl-2 in asthmatics[J].Eur Respir J,2003,22(2):207-212.
[6]王丽华.环孢素A药物作用及机制与临床应用[J].中外健康文摘,2013(39):41.
[7]王 维,臻银燕,陈 耀.环孢菌素A的作用机制及临床应用[J].海峡药学,2007,19(10):103-105.
[8]覃绍坚.艾滋病的T淋巴细胞免疫学的研究进展[J].右江民族医学院学报,2007,29(1):98-100.
(本文编辑 杨 瑛)
Study on Different Doses of Cyclosporin A for Preparing Immunodeficiency Mice Models
ZHANG Yujin1,LI Ling2,YANG Shenghui2,GAO Qiang2,XIANG Qin2,LOU Fang2,WANG Zeliang2,ZHENG Meng2,OU Xiaoxiang2,WANG Junwen2*
(1.The Second Affliated Hospital of Hunan University of Chinese Medicine,Changsha,Hunan 410007,China;2.Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
ObjectiveTo study different doses of cyclosporin A(CSA)on the effect of immune function in mice and to lay the foundation for cellular immune deficient animal model.MethodsThe experiment is divided into high dose group,middle dose group,and low dose group,which were intraperitoneal injected with CSA:40 mg/(kg·d),25 mg/(kg·d)and 10 mg/(kg·d),respectively.Wealsosetsolution controlgroup which weregiven the samedose of diluent,and normal control group which were given equal saline,injecting one times every other day for total three times.The following indicators were observed:(1) The percentage of CD4+T and CD8+T lymphocyte subsets; (2) The weight index and pathological changes of the spleen and thymus; (3)Pathological changes of the lung and mortality rate in mice.ResultsCompared with normal control group and solution control: (1) high and middle dose group of the percentage of CD4+T cells decreased apparently(P<0.05/P<0.01).The percentage of CD8+T cells increased significantly only in the high dose group(P<0.05). (2) High and middle dose group of the weight index of thymusdecreased apparently (P<0.05),thymusatrophy associated with fatty degeneration,lymphoid nodule sample structure in the middle;spleen white medullary and splenic corpuscle in the high,middle and low dose group enlarged and macrophages increased; (3) The lungs in the high,middle and low dose groups had focal inflammation,pulmonary interstitial hyperplasia and alveolar fiber hyperplasia;The mortality in high dose group of significantly increased(P<0.05).ConclusionThe immune deficiency mice models could be successfully established by intraperitoneal injection of high or middle dose CSA.While considering from efficiency and economy,middle dose CSA is more suitable for building models.
cyclosporine A;immunodeficiency;animal models
R965.1
A
10.3969/j.issn.1674-070X.2014.11.004.014.04
2014-05-08
湖南省科技厅资助项目(2013SK3097);湖南省高校科技创新团队《感染性疾病中医药防治研究》资助项目(No.15);湖南中医药大学重点学科《基础医学》、《病原生物学》资助项目(No.1);湖南省中医药科研项目(201470)。
张予晋,男,医师,主要从事中医皮肤病治疗临床工作。
* 王军文,男,教授,E-mail:wangjunwen_1963@126.com。
·中药栽培与加工·
