妊娠期ToRCH筛查指南
2014-10-08全军计划生育优生优育专业委员会
全军计划生育优生优育专业委员会
妊娠期ToRCH筛查中的“ToRCH”一词最早是由美国埃默里大学(Emory University)免疫学家Andre Nahmia于1971年提出。Nahmia将复杂的围产期感染综合后称之为ToRCH,弓形虫(To)、风疹(R)、巨细胞病毒(C)、单纯疱疹病毒1型或2型(H)。从ToRCH概念的提出至今已近半个世纪,妊娠期4种病原微生物抗体筛查实验应不应该做?怎样做?至今医学界仍在争议中。
上个世纪末国外很多专家反对ToRCH这种打包的筛查方式,主张按孕妇的具体情况选择筛查项目。2011年中华医学会妇产科学会产科学组:《孕前和孕期保健指南》第1版将ToRCH筛查列为孕前3个月首选备查项目。
近年来随着产前诊断技术进步,特别是胎儿超声诊断技术的提高和核磁共振技术的引进,发现愈来愈多的胎儿先天畸形与ToRCH感染有关。自2008年以来欧洲和北美一些国家先后由政府和妇产科协会批准颁布了妊娠期巨细胞病毒、风疹病毒、单纯疱疹病毒、弓形虫筛查诊断指南。
为了满足优生优育、妇幼保健工作的需要,全军计划生育优生优育专业委员会决定编撰适合中国国情的ToRCH筛查指南。由于国内检测手段不规范,研究资料有限,特别缺乏大样本随机对照实验(RCT)的研究证据,本指南以近年来颁布的欧洲和加拿大指南为蓝本,遵循“立足国情,循证为本,求实求新,资源共享”的原则,结合优生工作的现状编撰了本指南。指南中推荐的许多观点只是初步认识,还需要更多、更有力的证据支持。本指南仿效了《妊娠和产后甲状腺疾病诊治指南》,以问答方式结合推荐证据级别(表1),向检验和临床工作人员推荐了39条建议(表2)。简单明了的使临床医生迅速的掌握妊娠期ToRCH筛查结果的解读(图1),力争使临床医生能够看懂并灵活应用,使ToRCH筛查能够正确地进行。我们将根据国内外研究成果和指南更新,修改本指南。

表1 证据说明要点和建议分级法(采用加拿大专家组关于预防性医疗保健的分级标准)

表2 推荐条款

2-3:血清反应阴性(IgG阴性)的健康保健人员和保育员应该在妊娠期进行血清学监测。对于有可能接触婴幼儿尿液和唾液的孕妇(IgG阴性)也应进行血清学监测。Ⅲ-B 2-4:妊娠期初次母体巨细胞感染的诊断应该基于孕妇血清中病毒特异性IgG抗体的新出现(这些孕妇之前的血清反应为阴性),或者发现特异性的IgM抗体并伴随IgG抗体亲和力的降低。II-2A 2-5:复发感染的诊断应该基于孕妇之前检测IgG抗体阳性,本次IgG抗体滴度的显著升高(定量检测上升4倍),伴有或者不伴有IgM抗体的出现,以及IgG的高亲和力(≤16周);唾液或咽拭子标本或人体其他组织培养巨细胞病毒阳性;或者从尿液,唾液或咽拭子标本或人体其他组织定量PCR检测巨细胞病毒高拷贝数。Ⅲ-C 2-6:对初次感染孕妇,应告知夫妻双方其宫内垂直传播和胎儿感染风险为30%~40%,如胎儿被感染,其生后出现后遗症的风险为20%~25%。II-2A 2-7:对复发感染的孕妇,也应告知夫妻双方其宫内垂直传播和胎儿感染的风险为1%,如果胎儿被感染,其生后出现后遗症的风险为20%~25%。II-2A 2-8:胎儿巨细胞病毒感染的产前诊断应该基于羊膜腔穿刺术。羊膜腔穿刺术应该在妊娠21周后,并且在推测母体感染至少7周后进行。这个时间间隔非常重要,因为胎儿感染后病毒在肾脏的复制需要5~7周的时间,分泌到羊水中的病毒量才可以被检出。II-2A 2-9:孕妇复发巨细胞病毒感染时,可以考虑采取羊膜腔穿刺,但由于垂直传播率低,相应的风险收益比并不高。 Ⅲ-C 2-10:一旦诊断胎儿巨细胞病毒感染,孕妇应该每隔2~4周进行系列超声检查以便发现超声声像异常。这种声像异常有助于我们推测胎儿的预后,但我们应认识到超声声像没有异常并不能确保胎儿正常。II-2B 2-11:羊水中巨细胞病毒-DNA的定量测定可以帮助预测胎儿结局。II-3B三、风疹病毒筛查3-1:准备怀孕妇女最好进行咨询,测定抗体状态,必要时接种风疹疫苗。I-A 3-2:由于先天性风疹综合征风险随感染时孕周变化,所以必须知道准确孕周,这对咨询很关键。 II-3A 3-3:原发性母体感染应该通过血清学试验诊断。 Ⅱ-2A 3-4:暴露于风疹或有症状的孕妇,应该做血清学试验确定免疫状态和先天性风疹综合征的风险。 Ⅲ-A 3-5:怀孕时不应该接种风疹疫苗,但产后是安全的。 Ⅲ-B 3-6:孕早期不小心接种疫苗或接种后立即怀孕,孕妇是安全的,因为尚无该种情况下患先天性风疹综合征病例报道。 Ⅲ-B 3-7:妊娠期筛查风疹病毒应该IgG、IgM抗体同时检测。 II-2B四、弓形体筛查4-1:所有妊娠或计划妊娠的妇女,应在妊娠期间详细了解预防妊娠期感染弓形体的知识。 Ⅲ-C 4-2:不应在低风险孕妇中进行常规普遍筛查。血清学筛查应该提供给被认为处在初次感染弓形体高风险孕妇。 II-3E 4-3:妊娠妇女疑似近期感染,在介入诊断前应该在参比实验室进行检测,检测必须尽可能准确反映感染情况,并能做出解释。 II-2B 4-4:为确认弓形体感染,下列情况应该使用PCR技术检测羊水中弓形体DNA: II-2B(1)孕妇诊断为初次感染;(2)血清学测定不能确认或排除急性感染;(3)出现异常超声结果(颅内钙化、小头畸形、脑积水、腹水、肝脾肿大、或严重的胎儿宫内生长受限)。4-5:羊膜穿刺时间应>18周,而且在母亲疑似感染4周后,以降低假阴性结果的发生。II-2D 4-6:疑似孕妇弓形体感染,应该用超声筛查,看超声结果是否与ToRCH(弓形体、风疹、巨细胞病毒、疱疹病毒和其他)结果一致。包括但不限于颅内钙化,小头畸形,脑积水,腹水,肝脾肿大或严重的胎儿宫内生长受限。II-2B 4-7:如果怀疑有急性感染,重复测试应在2~3周内进行,并考虑到乙酰螺旋霉素立即开始治疗,无需等待重复的测试结果。 II-2B 4-8:如果产妇感染已得到证实,但目前还不知道胎儿是否被感染,应给予乙酰螺旋霉素对胎儿进行预防(防止垂直传播)。 I-B 4-9:已确诊或高度怀疑胎儿感染的孕妇(羊水PCR阳性),应联合使用乙胺嘧啶,磺胺嘧啶,甲酰四氢叶酸给予治疗。 I-B 4-10:曾经感染过弓形体已获得免疫的孕妇,不需要做抗弓形体治疗。 I-E 4-11:每个疑似弓形体感染的病例,都应与专家讨论。 Ⅲ-B 4-12:免疫抑制或HIV阳性的妇女应接受筛检,因为有弓形体激活和患弓形体脑炎的风险。 I-A 4-13:被确诊为急性弓形体感染未孕妇女,要等待6个月后再怀孕,每个病例应该咨询专家。 Ⅲ-B五、单纯疱疹病毒筛查5-1:妊娠期妇女应尽早检查生殖器疱疹(HSV)感染情况。Ⅲ-A 5-2:妇女出现单纯HSV的反复发作时,应被告知分娩期间病毒可能传染给新生儿的危险性。 Ⅲ-A 5-3:妊娠晚期妇女患有原发性HSV时,新生儿获得HSV传染的概率非常高,临床医师应建议孕妇采取剖宫产减低感染风险。 II-3B 5-4:孕妇分娩期间复发HSV感染,对于有前驱症状或怀疑已存在的功能损害与HSV有关时,应给予剖宫产。 II-2A 5-5:对于妊娠期复发的HSV,应在第36周给予阿昔洛韦和伐昔洛韦抑制病毒复制,降低病变发生概率,减少病毒传播,同时降低实施剖宫产率。I-A 5-6:准备怀孕或怀孕妇女无HSV感染病史,但配偶患有生殖器HSV感染时,应在怀孕前或在妊娠期间尽早进行血清学检查,确诊是否感染HSV,并在妊娠第32~34周期间复查。Ⅲ-B

图1 妊娠前(准备近期怀孕者)或妊娠期ToRCH筛查
一、ToRCH筛查的认识误区
问题1:ToRCH筛查能诊断出生缺陷吗?
不能。ToRCH筛查是对孕妇感染的诊断,由此对胎儿有否感染及发育缺陷提供关注。筛查是在人群(孕妇)中筛选出某种疾病(病毒)的高危个体(感染者),对后者进行诊断(胎儿感染的诊断),对患者(胎儿)或疾病(病毒)携带者(孕妇)进行干预,达到预防和治疗目的。
问题2:ToRCH感染的共同特征是什么?
1.母婴传播,T1期胎儿危险,T3期新生儿危险。
2.孕妇无症状或症状很轻。
3.病毒可通过胎盘引起宫内感染,可引起早产、流产、死胎或畸胎等。
4.病毒通过产道或母乳感染新生儿引起新生儿多系统、器官损害,智力障碍。
5.孕妇感染,胎儿不一定感染,胎儿感染不一定造成出生缺陷。
问题3:ToRCH感染差异性?
机体感染后,弓形虫、风疹病毒、巨细胞病毒和单纯疱疹病毒血清学变化各有不同(图2),抗体变化也不同,需要定量检测抗体的变化程度才能做出正确的判断。

图2 各病原微生物血清学变化趋势图
问题4:ToRCH感染检测指标的临床意义有什么不同?
1.直接指标(病毒抗原、病毒DNA、病毒RNA病毒培养)检测的是病毒本身,与病毒的复制规律和潜伏位置等特性有关,适合于诊断。
2.间接指标(IgG、IgM)检测的是病毒刺激机体后机体产生的免疫反应,与个体的免疫功能有关,适合于筛查和免疫状态评估。
问题5:妊娠期感染分为几种?
妊娠期感染分为初次(原发)感染、既往感染、复发感染、再感染,其概念不能混淆。
1.初次感染(primary infection)又称原发感染:妊娠妇女血清第1次出现病毒特异性抗体IgG阳性,而先前血清学试验是阴性称为初次感染。只有先前做过筛查,结果是阴性并存档(或保存孕妇血清标本),这样做才能判定初次感染。IgG抗体亲和力测定在IgG阳性情况下,有助于区分出是急性初次感染,还是既往感染或复发感染,并对初次感染的时间做出估计,即若检测结果为高亲和力情况下,可以断定初次感染时间是在3个月前。
2.既往感染(past infection):曾经感染过该病毒,机体产生了抗体或病毒休眠以潜伏状态存在。
3.复发感染(recurrent infections/secondary infection):宿主免疫功能存在下的病毒间歇性排泄,是潜伏状态内源性病毒再激活。
4.再感染(reinfections):已经被免疫的个体接触到一个外源性新病毒,发生再感染。目前不能通过血清学方法区分复发感染和再感染,只能通过病毒分离和分子生物学方法。
5.先天性感染(congenital infections):病毒经胎盘传播的结果。母亲的初次或复发感染都可将病毒传播给胎儿,造成胎儿先天性感染[1]。
问题6:为什么筛查实验IgG、IgM应同时做?
筛查实验IgG、IgM应同时做,单做IgM往往给出错误的结果。
IgM阳性不能充分证明近期感染,部分人群感染后IgM可连续存在数年,单纯IgM阳性不能诊断[2]。如以风疹非急性感染的IgM为例,究其原因可分为以下两种情况:
1.IgM真阳性:这是由于有部分人发生感染后体内持续多年IgM表达,往往IgM水平保持较低的稳定水平,常伴有IgG阳性且亦保持稳定水平。此时试剂盒检测得到的IgM结果是正确的,但并不表示个体正发生急性感染,此时若单独只检测IgM则会造成误判。
2.IgM假阳性:这主要是由于类风湿因子(RF)、交叉反应或者多克隆刺激等因素的影响导致试剂盒检测结果的错误,这是由于免疫学检测手段本身固有的限制所导致的,无法完全避免。
以上两种情况导致的非急性感染IgM阳性结果,则会给临床诊断带来困惑,因为这些个体并未正发生急性感染。但这一问题却可通过同时检测IgG且采用定量检测试剂而得到满意的纠正。在“2”的情况下,若初次检测结果为IgM阳性/IgG阴性,15天~1个月后的第2次检测,则个体会依然保持此种情况或IgM转阴,即IgG不会发生血清学转换;若初次检测结果为IgM阳性或/IgG阳性,则15天~1个月后的第2次检测此两项指标数值方面往往不会发生较大变化,尤其是IgG会保持稳定,因为个体并未发生真正的复发感染。
问题7:为什么妊娠期ToRCH筛查具有时效性?
不同的病毒筛查目标不同,对筛查孕周的要求也不同[3],没有孕周,筛查结果往往没有意义。有些病毒在孕早期筛查有意义,有些在孕晚期筛查有意义。
推荐 1-1[4]。
问题8:为什么抗体筛查没有绝对的参考值?
人体对病毒感染免疫反应不同,抗体水平存在很大个体差异。ToRCH病毒感染是一个母-胎动态过程,每个时间段没有截然标准,IgG/IgM浓度切割值是感染指标,但具有局限性,个体浓度梯度变化才更有临床意义,例如当IgG上升4倍时常作为病毒复发或再感染的指标[4]。
问题9:为什么定量分析是ToRCH筛查的进步和最佳选择?
1.妊娠期发生初次感染或复发感染,体内产生IgG或IgM是一个急剧变化的过程,只有通过定量分析浓度变化才能检测到[5]。
2.定量分析有助于发现假阳性或假阴性结果。
3.对于那些孕前未做过基础免疫状况评估的孕妇,选择两个时间点(T1,T2)检测IgG或IgM浓度(C1,C2),计算单位时间内浓度变化梯度,能有效地发现机体受到病毒攻击而发生的特异性免疫反应,但目前还没有参考值,较常用的是C2/C1>4倍。所有这些必须以定量检测为前提。
推荐 1-2[6-7]。
二、巨细胞病毒(CMV)筛查
问题10:妊娠期为什么要做CMV筛查?
CMV是宫内感染最常见的原因,在活产儿中发病率为0.2%~2.2%。感染是感音神经性听觉丧失和精神发育迟滞的常见原因之一[8]。
对孕妇进行筛查可以帮助医生了解孕妇的免疫状态,对IgG阴性的孕妇进行预防妊娠期感染的健康教育,并进行动态监测和观察,防止发生初次感染。对IgG阳性的孕妇在孕早期和孕晚期进行病毒DNA复制监测,防止复发感染通过胎盘造成先天感染,通过产道或乳汁造成新生儿感染。
尽管母亲有免疫力(IgG阳性),婴儿也可能患先天性CMV感染。母亲初次感染和复发感染都可导致胎儿有症状的CMV感染。某些有免疫力的母亲其婴儿先天CMV感染导致中枢神经系统损伤[9]。
对孕妇进行筛查可以帮助医生对孕妇感染类型做出诊断,以便选择在有效时间对胎儿进行产前诊断。做到早发现、早干预。
推荐 2-1[9];推荐 2-2[1];推荐 2-3[1]。
问题11:如何诊断妊娠期CMV初次和复发感染?
人体初次感染CMV后,病毒进入休眠期并潜伏在人体内。这种病毒可以在人体内被重新激活,称为复发(继发)感染[10]。此外,具有免疫力的个体暴露于外源性新的病毒株可出现再感染。因此,复发或再感染被定义为宿主免疫状态下病毒的间歇性分泌。这可能是由于内源性病毒的重新活化或宿主暴露于外源性新病毒株。复发感染和再感染不能通过血清学检测加以区分,只能通过病毒分离和分子生物学方法检测进行区分。美国CMV IgG阳性的健康女性3年内有1/3会再次感染CMV新病毒株[11]。
推荐 2-4[1]。
妊娠期血清学方法诊断CMV初次感染:
1.IgM阳性 +IgG定量检测上升,15天后转为阳性,发生血清转化=初次感染。
2.IgM阳性+IgG低亲和力(≤16周)=初次感染。
如果孕前的免疫状态未知,初次感染的诊断应基于特异性IgM抗体的检出。然而,10%的复发感染病例中也可检出IgM抗体[12],并初次感染数月后血清中也可检出IgM抗体[13]。因此,IgM抗体阳性的人群可能包括孕前初次感染和复发感染两种情况,还有IgM抗体阳性长期持有造成的假阳性[14]。IgG抗体亲和力分析可帮助了解是否在3个月内发生CMV感染,即若检测结果为高亲和力,可断定初次感染是在3个月前发生,往往提示为既往感染;若检测结果为低亲和力,则CMV初次感染在3个月内的可能性很大,往往提示为急性初次感染。病毒DNA的检测可帮助我们发现病毒复制,但不能区别是复发感染还是初次感染,只有IgG抗体阳性者,才能出现复发感染[15-16]。
通常亲和力指数<30%,则高度提示近期的初次感染(3个月内)[16]。因此,妊娠期初次感染的血清学诊断主要依据血清转化现象(之前血清反应阴性的孕妇出现特异性IgG抗体),或检出病毒特异性IgM抗体并伴随低亲和力IgG抗体。
孕妇如在孕前血清中检出IgG抗体而没有IgM抗体,而妊娠期出现IgG抗体滴度的显著升高及高IgG亲和力(伴有或不伴有特异性IgM抗体的出现)可被认为是出现复发感染[17]。
推荐 2-5[1,18]。
妊娠期非初次感染(复发和再次感染)的诊断:
1.IgM阳性+IgG阳性+高亲和力(≤16周)=非初次感染的可能性增加。
2.IgG阳性且IgM阳性/阴性+高亲和力(≤16周)+尿/分泌物/血液中检出CMV(分离病毒或PCR)=非初次感染。
3.CMV特异性IgG上升4倍=非初次感染
问题12:什么是CMV先天性感染?先天性CMV感染有哪些后果?
先天性感染是由于CMV经胎盘垂直传播。孕妇初次或者继发感染都可能垂直传播给胎儿。初次感染后,妊娠期宫内垂直传播的概率为30%~40%,而复发感染后这种概率仅为1%[19]。但是2009年美国CDC发表的关于胎儿先天性缺陷的统计分析结果显示,妊娠期复发CMV感染率为75%,CMV感染导致的先天性缺陷占第1位。其中妊娠期复发CMV感染占主要因素[20],对孕前感染率高达95%[21]的中国孕妇更是如此。
10%~15%的先天性感染的婴儿会在出生时出现症状,包括宫内生长迟缓、小头畸形、肝脾肿大、淤斑、黄疸、脉络膜视网膜炎、血小板减少症和贫血。这些婴儿中20%~30%会死亡,这主要是由于弥漫性血管内凝血、肝功异常或细菌重复感染[22-26]。大多数先天性CMV感染的婴儿(85%~90%)在出生时不会出现症状或体征,但这些婴儿中5%~15%会出现后遗症,如感音神经性听觉丧失、精神运动发育迟缓和视觉障碍[21,27]。
推荐 2-6[1];推荐 2-7[1]。
问题13:怎样进行胎儿CMV感染的产前诊断?
胎儿CMV感染的诊断应该基于羊水样本的培养和PCR检测。当孕妇被诊断为初次CMV感染时,应该在母体感染7周后并且在妊娠20~21周后进行羊膜腔穿刺术采集羊水进行实时定量PCR检测病毒DNA载量,因为只有胎儿感染5~7周后,经过肾脏病毒复制,分泌到羊水中的病毒量才可以达到检测限[27-28]。根据以往很多文献报道,进行产前诊断操作的时间如果距离母体感染时间过近,其出现假阴性结果的风险不容忽视[29-30]。
对于复发感染的病例(胎儿感染的风险较低)是否采取羊水病毒检测尚未达成一致意见。然而,根据文献报道,一些复发感染的病例也会出现严重的后遗症。因此,即使对于复发感染的病例,我们也可以考虑通过羊膜腔穿刺术对胎儿CMV感染进行产前诊断。
推荐 2-8[1];推荐 2-9[1]。
问题14:为什么不推荐通过检测胎儿血IgM抗体或DNA对于胎儿感染进行诊断?
不仅是由于脐带穿刺风险较高,还由于许多CMV感染的胎儿只有在妊娠晚期才会出现特异性IgM抗体,这使得脐带穿刺检测的敏感性很低[30-32]。妊娠20~21周,胎儿血IgM灵敏度为50%~80%,胎儿血DNA灵敏度度40%~90%,而羊水DNA特异性和准确性可达到100%[33]。
问题15:为什么不推荐用孕妇血CMV-DNA检测初次感染?
因为检测初次感染孕妇血液中的CMV-DNA的阳性率为33.3%,而IgG阳性健康妇女的血液中的CMV-DNA的阳性率也为33.3%[34]。所以用孕妇血液中CMV-DNA进行感染的诊断是不可靠的[35]。
问题16:胎儿诊断为CMV感染后如何处理?
由于CMV感染产前诊断局限于羊水检测(如病毒分离和PCR),不能预测胎儿出生时是否会出现症状。所以一旦胎儿感染得到诊断,孕妇应每隔2~4周进行系列超声检查,以便发现CMV感染的征象,如宫内生长迟缓、脑室扩张、小头畸形、颅内钙化灶、腹水或胸腔积液、胎儿水肿、羊水过少或过多、肠管回声增强,这些发现可能有助于预测胎儿的预后。这种系统超声检查应在具有资质的产前诊断中心进行。胎儿高分辨率磁共振成像检查可能有助于预后的评估,特别是当超声发现有颅脑异常时。然而,磁共振成像检查是否能为我们提供胎儿CMV感染的有效信息,还有待进一步确定[36-37]。
已有一些研究对于羊水中病毒载量作为一个预后指标的临床意义进行了报道,研究表明在有症状的胎儿中,羊水样本中CMV-DNA载量值要明显高于无症状的胎儿[38]。然而,这两种群体中的载量值有很大部分的重叠。因此,羊水中CMVDNA的定量测定能否作为CMV感染的预后指标还有待于进一步证实[39-40]。
推荐 2-10[1];推荐 2-11[1]。
三、风疹病毒(RV)筛查
问题17:为什么希望怀孕的妇女在孕前接受抗体检测?
风疹,也称德国麻疹,属儿童期疾病。未妊娠时通常表现为轻微自限性疾病。然而怀孕时病毒对发育胎儿可能有破坏性影响,与不可预知的流产和严重先天畸形有直接关系。孕前接受抗体检测可了解机体对RV是否有免疫力,如果没有免疫力(IgG阴性),可接种疫苗并于产生抗体后再怀孕。接种疫苗或自然获得的免疫一般可保护胎儿免受宫内感染。
推荐 3-1[4]。
问题18:什么是先天性风疹综合征(CRS)?最常见的先天性缺陷和迟发的症状?
CRS代表出生前感染RV的新生儿症状,胎儿为多器官系统受累。RV通过胎盘垂直感染对发育胎儿有很大危害,导致自然流产、胎儿感染、死产、胎儿发育迟缓。多数CRS患儿表现为持续性的神经运动缺陷,以后还可出现肺炎、糖尿病、甲状腺功能障碍、进行性全脑炎[41-42]。最常见的先天性缺陷和后来出现的症状见表3[4]。

表3 风疹病毒感染出生时症状和迟发临床表现
问题19:CRS畸形风险与母体感染时孕周有关?
RV感染胎盘后,通过正在发育胎儿的血管系统扩散,引起血管细胞病变和发育器官局部缺血。胎儿感染率和出生缺陷率与母体感染时孕周有关,见表4[4]。
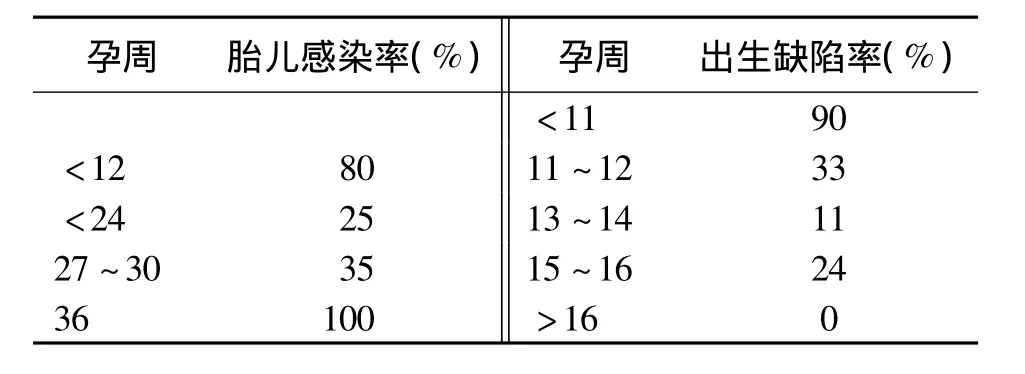
表4 孕期风疹病毒感染与胎儿感染和出生缺陷的关系
当母体感染/暴露发生在孕早期,胎儿感染率约80%,晚中期降至25%,后期又增加,从孕27~30周感染率为35%,至孕36周后感染率几乎100%。孕11周前感染先天缺陷率为90%,孕11~12周为33%,孕13~14周为11%,孕15~16周为24%,孕16周后为0[43]。所以,母体感染后发生先天缺陷风险局限在妊娠16周前,孕20周后感染引起CRS的风险很小,孕后期感染唯一的后遗症可能是胎儿发育迟缓(FGR)[43-49]。受精前后母体感染也不增加 CRS风险[50]。所以有关胎儿风险和处理的咨询必须个体化。
接种疫苗或自然获得的母体免疫一般可保护胎儿免受宫内感染,然而也有母体再次感染患CRS的报道[51-52]。所以,有先天性感染临床症状的胎儿或新生儿应考虑CRS的可能[51]。孕12周后母体再感染时无CRS病例报道。
推荐 3-2[4]。
问题20:如何诊断母体RV感染?
准确诊断妊娠期原发性RV是必须的,需要血清学试验,因为很多病例是亚临床表现。通过血清学方法测定RV特异性IgG、IgM是一种简便、敏感、准确的方法,诊断如下:
1.急性和恢复期血清样本RV IgG抗体滴度增加4倍。
2.RV特异性IgM抗体阳性。孕妇血IgM阳性同时还要有血清学转换指标,即出现IgG由阴性转变成阳性。或者孕妇血IgM(+)同时还要出现IgG抗体连续双份血清出现4倍增高(15天~1个月间)[53]。
3.RV培养阳性(患者临床样本的病毒分离培养)。血清学试验最好在皮疹出现的7~15天内检测,2~3周后重复检测一次[54-55]。
推荐 3-3[4]。
问题21:可以诊断胎儿RV感染吗?
目前还没有成熟稳定的诊断方法。有少量报道RV特异性PCR检测CVS样本用于宫内RV的产前诊断[56-57]。该报道证实绒毛样本优于羊水样本,因为绒毛可在孕早期10~12周取材,而羊水需要在孕18~20周取材,脐血需要在孕28周取材,此时检测胎儿感染已没有太大意义了。
超声诊断CRS极其困难,生物测量有助于诊断FGR,但不是诊断CRS的好工具,因为RV引起的畸形性质不同,表现出生长迟缓的胎儿应该考虑是否有先天性病毒感染,包括RV[58]。
问题22:孕妇出现风疹样疾病的迹象或症状,最近接触到RV怎么办?
孕妇RV暴露时必须依据暴露时孕周、免疫状态进行个体化处理。确诊孕妇急性RV感染经常是很难的,临床诊断不可靠,大量病例是亚临床表现,并且临床特征与其他疾病非常相似。图3显示对暴露孕妇或与风疹相似症状的孕妇的处理指南[4]。如果孕妇有与风疹类似症状或近期暴露于RV,应该确定孕周和免疫状态。
对暴露于RV 5周后或出现皮疹4周后就诊的孕妇,诊断很困难。如IgG抗体阴性,那么患者对RV敏感。因此,没有近期感染的证据。如果IgG抗体阳性,说明以前有感染,这时抗体水平低,提示是远期感染,但确定感染时间和胎儿感染风险很难,建议测定IgM或重复测定IgG抗体,了解是否有显著的升高或下降。
推荐 3-4[4]。

图3 暴露孕妇或与风疹相似症状的孕妇处理指南
问题23:怀孕时能否接种疫苗?孕早期不小心接种疫苗或接种后立即怀孕了需要终止妊娠吗?
风疹疫苗接种禁忌证有发热、免疫缺陷、新霉素过敏和怀孕。风疹疫苗病毒可能通过胎盘感染胎儿。但是,对孕早期不小心接种风疹疫苗的孕妇其子代患有CRS的病例还未见报道[59-61]。所以对这样孕妇不建议终止妊娠[62]。根据疫苗对胎儿的潜在风险,建议妇女接种后28天再怀孕[63]。
推荐 3-5[4];推荐 3-6[4]。
问题24:为什么妊娠期只筛查RV IgM抗体会得出错误的结果?
因为会出现非急性感染阳性,其原因主要有两方面[6]:
1.真阳性:患者持续多年IgM表达,往往IgM水平保持较低的稳定水平,常伴有IgG阳性。
2.假阳性:检测方法的特异性受限[64]。RV IgM抗体参考值范围的确定由已知阴、阳性标本确定的。如图4所示,红线下方区域是交叉重叠区,是不能用参考方法解释的区域,大约有3%~5%的会出现IgM假阳性问题,如果不用定量的方法我们不能区分真假阳性。造成这种情况的原因主要是RF干扰、交叉反应、多克隆刺激等。

图4 风疹病毒IgM抗体阴、阳性重叠灰区示意图
推荐3-7。
问题25:妊娠期风疹病毒筛查时出现IgM抗体阳性应如何处理?
妊娠期风疹病毒筛查IgM抗体阳性可按图5流程处理。
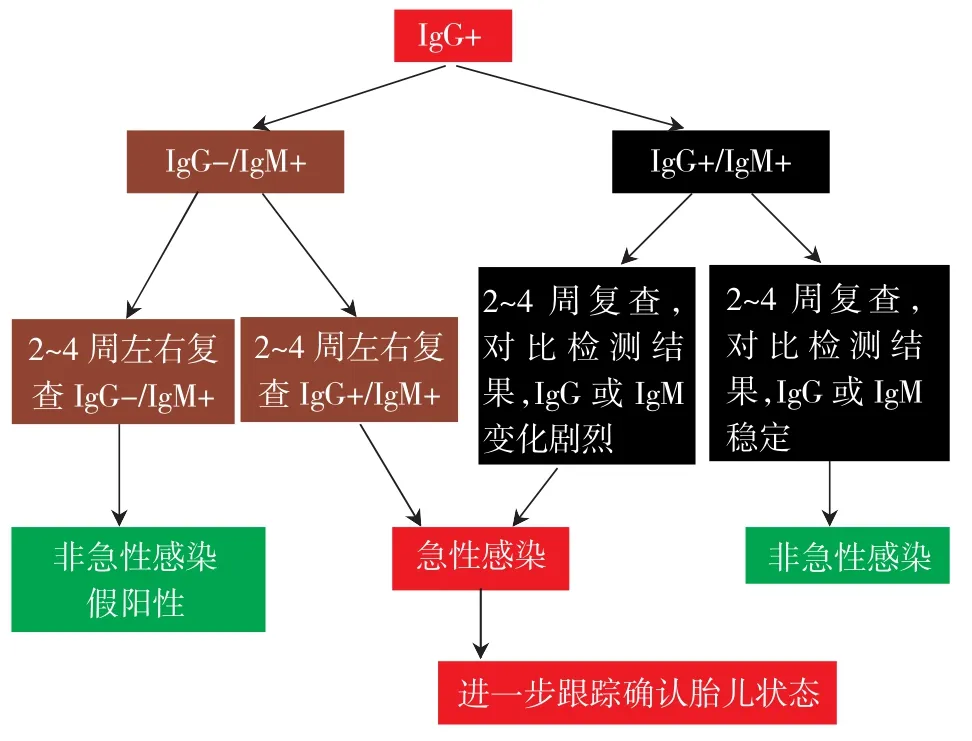
图5 妊娠期风疹病毒筛查时出现IgM抗体阳性处理流程
问题26:为什么说预防是避免CRS的最好策略?
孕妇RV感染对发育胎儿有破坏性影响,预防的关键是所有婴儿普遍接种疫苗,并对孕前筛查妇女中高危人群给予免疫接种。尽可能诊断出感染病例。妊娠早、中期,包括IgG阳性孕妇尽可能避免接触RV。对发生在16周之前的原发感染,应该向孕妇提供咨询,告知垂直传播的风险和提供终止妊娠的建议。但是,对于感染的胎儿没有宫内治疗方法。因此,预防仍然是避免CRS的最好策略[4]。
四、弓形体筛查
问题27:为什么孕妇要进行弓形体感染筛查?
1.在妊娠期间弓形体的急性感染可严重影响胎儿和新生儿健康。如果摄取了污染的没有煮熟的肉类或食用了污染的食物和水[65],可导致弓形体急性感染的发生。
2.胎儿感染弓形体几乎都是通过孕妇的原发感染所致,可导致胎儿视觉和听觉丧失,智力和精神运动能力发育阻滞,癫痫发作,血液系统异常,肝脾肿大,甚至死亡[66]。
3.弓形体传染给胎儿常发生于孕妇在妊娠期间无任何病史、未吃过未煮熟的肉食、未接触过猫的情况[9]。因此,确定是否对孕妇进行血清学检测不能仅依靠临床(如出现或未出现症状)或流行病学情况(如是否与弓形体有接触)[65-67]。
对孕妇进行系统的教育和血清学检查,是预防感染及诊断和早期治疗胎儿感染行之有效的方法,原因为弓形体感染通常是隐匿的。实践证实对胎儿和1岁以内婴儿的治疗,对于改善临床症状最有效。所有的孕妇应尽早(妊娠前3个月最为理想)进行弓形体的IgG和IgM抗体血清学检查[66]。
推荐 4-1[68]。
问题28:胎儿感染弓形体是孕妇初次感染还是复发感染造成的?
发生胎儿感染主要是因为孕妇在怀妊娠期间初次感染了弓形体[66]。少数情况下是因为孕妇有慢性感染,由于自身免疫缺陷(如艾滋病患者或应用皮质激素治疗的患者)的原因,出现弓形体激活[69-71],造成先天性感染。
问题29:胎儿和新生儿感染与母体感染有何关系?
随着孕周的增加,垂直传播的可能性也增加[65,72],见表5。孕早期感染的孕妇,其感染的新生儿的临床症状更加严重,见表5。

表5 母体血清学转化的孕周与子女3岁前弓形体先天性感染(传播)的风险和临床症状的发生情况
问题30:哪些孕妇是弓形体感染高风险群体?怎样确定?
孕前和妊娠期检测弓形体IgG阴性或IgM阴性,显示该妇女还没有被弓形体感染为发生妊娠期初次感染的高风险群体,在怀妊娠期间有获得初次感染和传染给胎儿的危险。因此,支持对高风险妇女在怀妊娠期间进行IgG和IgM抗体血清学检查。对于血清学检查阴性的妇女,最好在孕早期每个月检查一次[66],以后每3个月检查一次。
确定高风险的筛查应在妊娠早期,越早越好,对临床提供的帮助就越大。在孕中期得到的检测结果经常不能确定在孕早期是否有感染[65]。
推荐 4-2[68]。
问题31:妊娠期弓形体感染筛查处理流程及临床解释?
1.关于弓形体的处置,在妊娠期间可向专家咨询。
2.考虑将样品送到参比实验室[73]。
3.用乙酰螺旋霉素或乙胺嘧啶、磺胺嘧啶、甲酰四氢叶酸进行治疗。
4.羊水PCR检测应在孕18周(不能提前)或18周之后。当孕周>18周时,应慎重权衡检测风险和对胎儿感染诊断的好处。
5.妊娠期弓形体感染筛查和处理流程见图6,临床解释见表6。在美国可使IgM阳性孕妇减少50%的不必要流产[74]。

图6 妊娠期弓形体筛查流程

表6 临床(非参比)实验室弓形体血清学试验结果的解释
问题32:不论是在妊娠前还是在妊娠中期,IgM抗体阳性都不能认为就是近期感染?
IgM抗体结果阳性不能认为就是近期感染[73,75-76]。急性期感染的IgM抗体可存在1年以上,多数查出IgM抗体阳性的孕妇其感染发生于很久之前,已经超出了对胎儿有影响的时期。这些患者是慢性感染。Jose连续检测了100例其他实验室检测IgM抗体阳性而送到PAMF-TSL参比实验室的血清样品,PAMF-TSL参比实验室的确证实验证实62%的这些血清样品IgM抗体是阴性的。附加实验证实这些感染是远期感染而不是近期感染。IgM抗体阳性的检测结果最大的价值在于它强调了近期感染的可能性,因此需要在参比实验室进一步确证。
推荐 4-3[68]。
问题33:参比实验室弓形体抗体检测结果的最终解释有几种可能性?
参比实验室血清学试验结果的最终解释有3种可能性[66]:
1.试验结果符合近期感染,提示该患者怀孕后获得感染,但也不能排除即将受孕时感染。
2.试验结果符合受孕前的远期感染。
3.试验结果不确定,需要进一步血清学试验平行检测。
问题34:弓形体IgG亲和力试验有何临床意义?
弓形体IgG亲和力实验一般在参比实验室应用。感染后高亲和力的IgG抗体至少在孕12~16周才出现(具体时间依赖应用的实验方法)。出现高亲和力抗体提示感染至少出现在16周以前[77-79]。因此,妊娠第1个月的孕妇,不管IgM抗体试验的结果,高亲和力的IgG试验结果提示胎儿基本上不会感染先天性弓形体。对于妊娠>16周的孕妇,高亲和力实验结果对于确定感染至少在妊娠早期12~16周之前是非常有用的,在这种情况下,与妊娠晚期感染相比,弓形体传染给胎儿的比例是很低的[72],但对胎儿的致命损伤的可能性是很大,见表 5[72],羊水 PCR 的阴性预测值会很高,见表 7[80]。

表7 母亲感染的孕周与胎儿感染和羊水PCR的关系
需特别注意的是初次感染之后,低亲和力或不确定的试验结果可能存在几个月或者1年多,由于这个原因,不能单独使用弓形体IgG亲和力实验来确定是否是近期感染[78,81]。实际上,如果血清样品中,具有低亲和力或者临界值亲和力抗体,IgM抗体试验结果阴性,提示远期感染。如果单独使用,IgG亲和力试验是没有用的,甚至可能造成误导[82]。
问题35:妊娠期怀疑弓形体初次感染,怎样进行胎儿感染诊断?
孕18周(最适时间)或稍晚阶段的羊水弓形体DNA的PCR扩增已被成功应用于先天性弓形体病的产前诊断[80,83-84]。在妊娠早期进行羊水检查对胎儿有较高风险,而且也无必要。数据显示,在孕17~21周检测具有最高的灵敏度和最好的阴性预测值(不管怀孕几周,阳性预测值都为100%)[79]。
超声主要应用于孕妇被怀疑或诊断为孕前短时间(3个月)内急性感染。超声能显示胎儿畸形,包括脑水肿,大脑或肝脏钙化,脾大和腹水等[65]。
推荐 4-4[68];推荐 4-5[68];推荐 4-6[68]。
问题36:乙酰螺旋霉素治疗妊娠期弓形体感染何时开始?
一旦怀疑有急性感染,而感染发生在孕18周之内或怀孕前短时间内,要阻止寄生虫的垂直传播,美国和欧洲的一些学者认为乙酰螺旋霉素是首选药物[66]。
推荐 4-7[68];推荐 4-8(I-B)[68]。
问题37:何时联合使用乙胺嘧啶、磺胺嘧啶、甲酰四氢叶酸治疗弓形体感染?
如果羊水PCR的阳性结果证实胎儿感染,在孕18周或在此之后,推荐使用乙胺嘧啶,磺胺嘧啶,甲酰四氢叶酸等(如果患者已经应用了乙酰螺旋霉素,则推荐改为联合用药)。乙胺嘧啶有致畸作用,因此不能在孕18周之前联合用药(在欧洲的一些中心,联合用药可以早到孕14~16周)[85]。
由于孕18周以后垂直传播的比例很高,如果孕18周以后感染弓形体,也推荐使用乙胺嘧啶、磺胺嘧啶、甲酰四氢叶酸,以阻止胎儿感染的发生。如果垂直传播已经发生,则准备对胎儿进行治疗。这时乙胺嘧啶不能早期应用,因为该药有潜在的致畸作用。
乙酰螺旋霉素这种大环内酯类抗生素能降低垂直传播的概率[84,86-89]。然而,还没有进行设计周密的研究。已经报道这种保护对于孕早期感染比较有效[86-87,89]。该研究参照历史对照,先天性感染的概率被降低了60%左右[86-87,89]。乙酰螺旋霉素不能迅速地通过胎盘,因此对胎儿感染的治疗效果不会很好。没有证据显示乙酰螺旋霉素有致畸作用,见表8。
因为在理论上,孕妇孕早期的感染可以在孕晚期传染给胎儿,因此,即使羊水PCR结果为阴性,乙酰螺旋霉素也应该一直用到分娩[89]。对胎儿有很高感染风险的孕妇,或者胎儿的感染已得到证实,孕18周以后单纯应用乙酰螺旋霉素治疗的方案应转变为乙胺嘧啶、磺胺嘧啶、甲酰四氢叶酸联合用药。用药必须在医学专家指导下应用。

表8 妊娠期间被怀疑或被确定弓形体感染的孕妇的用药[68]
推荐 4-9[68]。
问题38:孕前感染过弓形体(IgG抗体阳性)还需做产前诊断和抗弓形体治疗吗?
孕前明确感染弓形体或血清学检测显示很久之前(孕前)感染过弓形体,孩子患先天性弓形体病的概率很小(接近于0),因此应用乙酰螺旋霉素或乙胺嘧啶、磺胺嘧啶、甲酰四氢叶酸治疗,以及进行胎儿是否感染的产前诊断都是没有必要的,除非母亲免疫功能有缺陷[68]。
推荐4-10。
问题39:每个疑似弓形体感染病例(育龄妇女、孕妇及基层医生)与专家咨询讨论可获得哪些信息?
1.弓形体检测方法的选择。
2.检测结果的正确解释。
3.对孕妇和胎儿进行产前诊断。
4.给出个体化的治疗方案。
推荐 4-11[67]。
问题40:具有免疫缺陷的患者孕前感染过弓形体怎样处置?
合并感染HIV和弓形体的孕妇有弓形体再激活和发展为弓形体病,如弓形体脑炎、肺炎等和(或)将寄生虫传递给后代的风险[65,69]。
HIV感染的孕妇不适于进行羊水PCR的检测,因为在羊水穿刺的过程中有可能将HIV传递给胎儿。非HIV感染有免疫缺陷的弓形体慢性感染(也可以是妊娠期间感染)的孕妇可考虑行羊水PCR检测。对于所有的弓形体慢性感染又有免疫缺陷的孕妇,每个月都要做一次超声检查[68]。
推荐 4-12(I-A)[67]。
问题41:近期感染了弓形体,什么时间怀孕安全?
育龄妇女明确感染弓形体之后,考虑到有传递给后代的风险,经常会问她们什么时间怀孕安全。关于这个问题目前还没有确切的资料。保守的建议是这样的妇女等6个月(从急性感染被确诊或记录开始算起)以后再怀孕。每个患者最好都要进行专家咨询[68]。
推荐 4-13[68]。
五、单纯疱疹病毒(HSV)筛查
问题42:妊娠前和妊娠期单纯疱疹病毒(HSV)筛查的目的是什么?
妊娠期HSV血清学筛查可以明确孕妇是否感染病毒。而妊娠前和妊娠期HSV对比筛查是为了确定初次感染还是复发感染,以便提供治疗和干预的依据,目的是预防新生儿感染[90]。妊娠期实验室检查后的处理流程[91],见图7。
推荐 5-1[91]。
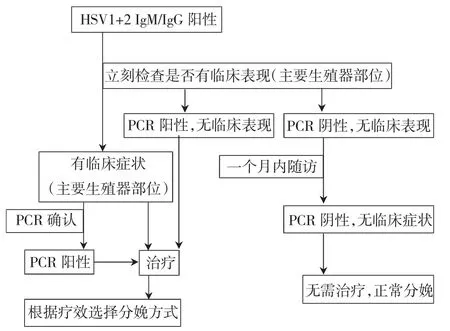
图7 妊娠期HSV实验室检查后的处理流程示意图
问题43:妊娠期HSV感染特点[92]?
1.一经感染终身携带,病毒潜伏在神经节,是一种嗜神经疱疹病毒。
2.孕早、中期发生初次感染造成胎儿感染的概率极低,孕早期筛查意义不大[93]。HSV经血-胎盘导致胎儿畸形罕见,表现为头小畸形症,肝脾肿大,胎死宫内(IUFD),胎儿宫内发育迟缓(IUGR)。
3.HSV感染主要是通过产道感染新生儿。
4.妊娠期HSV感染主要是初次感染。先前IgG阳性对新生儿感染HSV保护作用很弱。
5.新生儿感染率:孕妇初次感染>复发感染。
6.婴儿在娩出过程中感染HSV,其中60%~80%之前并无生殖器疱疹感染史或性伴无生殖器疱疹史。
7.70 %的母亲直到发现新生儿被感染后才知道自己被感染了。
8.无论HSV-1还是HSV-2型都可导致生殖器疱疹感染(高达50%的生殖器疱疹初次感染是由HSV-1造成的,但是复发和亚临床感染的病毒脱落主要是HSV-2导致的)[90,94-97]。妊娠晚期无论初次感染了 HSV-1还是 HSV-2,对新生儿的感染风险都是30%~50%。
问题44:新生儿HSV感染?先天性HSV?
新生儿HSV感染是指在临近分娩或分娩时,新生儿通过接触产妇生殖道病毒获得感染。在极少数情况下,也可能发生医源性感染或者产后经过婴儿口腔或破损的皮肤感染病毒[50],HSV感染明确诊断需要在分娩结束48小时以后,这对于鉴别新生儿与先天性HSV感染十分重要。
先天性HSV感染罕见,在宫内HSV通过胎盘感染胎儿。
问题45:生殖器疱疹感染分几种?
初次感染,患者首次暴露于HSV-1型或者HSV-2型病毒,之前未接触过任意一种或两种病毒,没有免疫性(无HSV-1或HSV-2 抗体)[97]。
非初次感染首次发作,患者首次临床确诊HSV感染发作,但在之前患者感染HSV-1或者HSV-2型病毒过程中体内已产生相应抗体[97]。
症状复发,指有明显的临床表现,确诊患者感染HSV病毒并产生抗体,之后再次发作[97]。
推荐 5-2[97]。
问题46:HSV血清学检测应注意哪些问题?
进行血清学检测应注意如下问题[92]:
1.建议对所有怀疑有HSV感染的孕妇使用直接检测病毒的方法(I-A)。但是,对有复发感染史或非典型生殖道疾病史者直接检测病毒方法结果可以为阴性(Ⅲ,B)。
2.HSV-2抗体可诊断生殖器疱疹;HSV-1抗体不能区分是生殖道还是口咽感染。
3.HSV-2型IgG阴性,HSV-1型IgG阳性,应考虑是一种不常见的复发性生殖道感染。
4.首发生殖器疱疹,应区分初次感染和既往感染 (Ⅲ,B)[96]。症状出现时,由于还没有产生针对该病毒的HSV的IgG(与生殖器病变检测到的类型是一致的),应在随访时找到原发性感染的血清转换的证据。
5.初次感染型特异性HSV抗体可在症状出现2周~3个月后检测到。凡有临床症状,应随访取样测定证实血清学转换(IIa-B)[92]。
6.由于早期感染患者缺乏IgG抗体,所以检测单纯疱疹病毒IgM抗体能提高早期感染检出率(Ⅱb-B)[92]。但是由于HSV IgM在复发感染时可以出现阳性,在初次感染时可能出现阴性,它是非病毒型特异抗体。因此,HSV IgM抗体检测在常规临床诊断中可用性有限,不被推荐在临床常规使用。
7.目前尚无FDA认可的HSV IgM分型试剂盒,而用于鉴别急性HSV感染的真正可信的分型检测方法应为PCR技术的分子生物学方法。
问题47:妊娠晚期发生HSV原发感染如何处置?
在妊娠晚期,孕妇原发感染HSV,对新生儿的影响最为严重。在这种情况下,由于产妇不能在分娩前产生足够的IgG抗体,婴儿缺乏来自母体IgG的被动免疫保护。此时,有30%~50% 的新生儿会感染 HSV[93,98]。
推荐 5-3[97]。
问题48:孕妇分娩期间复发HSV感染如何处置?
当分娩期间发现HSV复发感染,有前驱症状或病变,医师应推荐产妇选择剖宫产,即使病变的位置远离外阴(比如臀部或大腿),因为宫颈和阴道均可能排泌病毒[99-100]。理想的状态下,为了预防感染,剖宫产应在破膜4小时内进行[101]。如果分娩已经发动,选择剖宫产很可能对降低感染率没有任何帮助。另外一种情况下,在阴道HSV复制活跃合并胎膜破裂延迟时,剖宫产的保护作用也未被证实。
推荐 5-4[97]。
问题49:妊娠期HSV血清学分型有临床意义吗?
无论HSV-1还是HSV-2型都可产生生殖器部位的疱疹,都可造成新生儿感染。目前临床治疗策略上不会因为分型而有所不同,也不会因HSV感染的部位不同或根据组织器官不同而做相应的治疗改变,而且就生殖器部位的疱疹,HSV-1型所占比例也很高,可达1/3[102]。所以分型检测不是必需的,当然分型检测可提供一定的参考信息,但应采用PCR技术的分型,才最为可靠。
问题50:妊娠期复发的HSV感染如何处置?
当妊娠时间<36周孕妇发生HSV复发感染,即使临床症状严重也不应使用抗病毒治疗。而临床症状十分严重,抗病毒治疗无法避免时,治疗也应考虑个体化方案。
当妊娠时间>36周后使用抗病毒治疗可以降低其传染性,缓解临床症状,降低剖宫产率[103]。在缺乏大量临床安全研究数据的情况下,怀孕妇女只有出现抗病毒治疗指征时,才可使用阿昔洛韦和伐昔洛韦。
推荐 5-5[97]。
问题51:妇女无HSV感染病史也要进行血清学检查吗?
婴儿在娩出过程中感染HSV,其中60%~80%之前并无HSV感染史或性伴侣无生殖器疱疹史。70%的母亲直到发现新生儿被感染后才知道被感染了[91]。
推荐 5-6[97]。
问题52:妊娠期首发生殖器疱疹产后新生儿怎样处置?
妊娠期首发生殖器疱疹的孕妇产后新生儿应该按如下方法处置[92]:
1.首先应该通知儿科医生。
2.为了早期发现新生儿感染应该做尿、便、口咽、眼和皮肤的HSV培养。
3.在培养结果未出来时,应权衡利弊,研究是否启动阿昔洛韦治疗。
4.如果不立即启动阿昔洛韦治疗,应密切监测新生儿有无嗜睡、发热、拒食或病变的迹象。
问题53:妊娠期复发生殖器疱疹产后新生儿怎样处置?
虽然有些医师认为,妊娠期复发生殖器疱疹的孕妇产后应该取一组标本进行病毒培养,有助于早期发现新生儿感染,但没有任何证据支持这一做法。然而,应建议医生和家长如果婴儿有皮肤、眼睛或黏膜的任何病变,特别是在出生2周内,应考虑HSV感染的鉴别诊断[92]。
[1] Yinon Y,Farine D,Yudin M H,et al.Cytomegalovirus infection in pregnancy[J].J Obstet Gynaecol Can,2010,32(4):348-354.
[2] Liesenfeld O,Press C,Montoya J G,et al.False-positive results in immunoglobulin M(IgM)toxoplasma antibody tests and importance of confirmatory testing:the Platelia Toxo IgM test[J].J Clin Microbiol,1997,35(1):174-178.
[3] J Ueda K,Nishida Y,Oshima K,et al.Congenital rubella syndrome:correlation of gestational age at time of maternal rubella with type of defect[J].Pediatrics,1979,94(5):763-765.
[4] Dontigny L,Arsenault M Y,Martel M J,et al.Rubella in pregnancy[J].J Obstet Gynaecol Can,2008,30(2):152-168.
[5] Dollard S C,Staras S A,Amin M M,et al.National prevalence estimates for cytomegalovirus IgM and IgG avidity and association between high IgM antibody titer and low IgG avidity[J].Clin Vaccine Immunol,2011,18(11):1895-1899.
[6] Calderaro A,Piccolo G,Peruzzi S,et al.Evaluation of Toxoplasma gondii immunoglobulin G(IgG)and IgM assays incorporating the newVidia analyzer system[J].Clin Vaccine Immunol,2008,15(7):1076-1079.
[7] Medici M C,Martinelli M,Albonetti V,et al.Evaluation of rubella virus immunoglobulin G(IgG)and IgM assays with the new Vidia instrument[J].J Clin Microbiol,2008,46(5):1847-1849.
[8] Pultoo A,Jankee H,Meetoo G,et al.Detection of cytomegalovirus in urine of hearing-impaired and mentally retarded children by PCR and cell culture[J].J Commun Dis,2000,32(2):101-108.
[9] Arora N,Novak Z,Fowler K B,et al.Cytomegalovirus viruria and DNAemia in healthy seropositive women[J].J Infect Dis,2010,202(12):1800-1803.
[10] Alford C A,Stagno S,Pass R F,et al.Congenital and perinatal cytomegalovirus infections[J].Rev Infect Dis,1990,12(Suppl 7):s745-s753.
[11] Ross S A,Arora N,Novak Z,et al.Cytomegalovirus reinfections in healthy seroimmune women[J].J Infect Dis,2010,201(3):386-389.
[12] Griffiths PD,Stagno S,Pass R F,et al.Infection with cytomegalovirus during pregnancy:specific IgM antibodies as a marker of recent primary infection[J].J Infect Dis,1982,145:647-653.
[13] Drew W L.Diagnosis of cytomegalovirus infection[J].Rev Infect Dis,1988,10(Suppl 3):s468-s476.
[14] Liesnard C,Donner C,Brancart F,et al.Prenatal diagnosis of congenital cytomegalovirus infection:prospective study of 237 pregnancies at risk[J].Obstet Gynecol,2000,95(6 Pt 1):881-888.
[15] Revello M G,Gerna G.Diagnosis and management of human cytomegalovirus infection in the mother,fetus,and newborn infant[J].Clin Microbiol Rev,2002,15(4):680-715.
[16] Grangeot Keros L,Mayaux M J,Lebon P,et al.Value of cytomegalovirus(CMV)IgG avidity index for the diagnosis of primary CMV infection in pregnant women[J].J Infect Dis,1997,175(4):944-946.
[17] Yinon Y,Yagel S,Tepperberg Dikawa M,et al.Prenatal diagnosis and outcome of congenital cytomegalovirus infection in twin pregnancies[J].BJOG,2006,113(3):295-300.
[18] Sonoyama A,Ebina Y,Morioka I,et al.Low IgG avidity and ultrasound fetal abnormality predict congenital cytomegalovirus infection[J].J Med Virol,2012,84(12):1928-1933.
[19] Grangeot Keros L,Mayaux M J,Lebon P,et al.Value of cytomegalovirus(CMV)IgG avidity index for the diagnosis of primary CMV infection in pregnant women[J].J Infect Dis,1997,175(4):944-946.
[20] Cannon M J.Congenital cytomegalovirus(CMV)epidemiology and awareness[J].J Clin Virol,2009,46(Suppl 4):s6-s10.
[21] 龚波,张昕明,李俊,等.妇女风疹病毒、弓形体、巨细胞病毒感染调查分析[J].中国实验诊断学,2011,15(3):468-472.
[22] Raynor B D.Cytomegalovirus infection in pregnancy[J].Semin Perinatol,1993,17(6):394-402.
[23] Nigro G,Mazzocco M,Anceschi M M,et al.Prenatal diagnosis of fetal cytomegalovirus infection after primary or recurrent maternal infection[J].Obstet Gynecol,1999,94(6):909-914.
[24] Pass R F.Cytomegalovirus infection[J].Pediatr Rev,2002,23(5):163-170.
[25] Boppana S B,Pass R F,Britt W J,et al.Symptomatic congenital cytomegalovirus infection:neonatal morbidity and mortality[J].Pediatr Infect Dis J,1992,11(2):93-99.
[26] Adler S P,Nigro G.Prevention of maternal-fetal transmission of cytomegalovirus[J].Clin Infect Dis,2013,57(4):s189-s192.
[27] Liesnard C,Donner C,Brancart F,et al.Prenatal diagnosis of congenital cytomegalovirus infection:prospective study of 237 pregnancies at risk[J].Obstet Gynecol,2000,95:881-888.
[28] Revello M G,Gerna G.Pathogenesis and prenatal diagnosis of human cytomegalovirus infection[J].J Clin Virol,2004,29(2):71-83.
[29] Bodeus M,Hubinont C,Bernard P,et al.Prenatal diagnosis of human cytomegalovirus by culture and polymerase chain reaction:98 pregnancies leading to congenital infection[J].Prenat Diagn,1999,19(4):314-317.
[30] Lipitz S,Yagel S,Shalev E,et al.Prenatal diagnosis of fetal primary cytomegalovirus infection[J].Obstet Gynecol,1997,89(5 Pt 1):763-767.
[31] Nicolini U,Kustermann A,Tassis B,et al.Prenatal diagnosis of congenital human cytomegalovirus infection[J].Prenat Diagn,1994,14(10):903-906.
[32] Daniel Y,Gull I,Peyser M R,et al.Congenital cytomegalovirus infection[J].Eur J Obstet Gynecol Reprod Biol,1995,63(1):7-16.
[33] Barkai G,Barzilai A,Mendelson E,et al.Newborn screening for congenital cytomegalovirus using real-time polymerase chain reaction in umbilical cord blood[J].Isr Med Assoc J,2013,15(6):279-283.
[34] Lazzarotto T,Gabrielli L,Lanari M,et al.Congenital cytomegalovirus infection:recent advances in the diagnosis of maternal infection[J].Hum Immunol,2004,65(5):410-415.
[35] Arora N,Novak Z,Fowler K B,et al.Cytomegalovirus viruria and DNAemia in healthy seropositive women[J].J Infect Dis,2010,202(12):1800-1803.
[36] Picone O,Simon I,Benachi A,et al.Comparison between ultrasound and magnetic resonance imaging in assessment of fetal cytomegalovirus infection[J].Prenat Diagn,2008,28(8):753-758.
[37] Benoist G,Salomon L J,Mohlo M,et al.Cytomegalovirusrelated fetal brain lesions:comparison between targeted ultrasound examination and magnetic resonance imaging[J].Ultrasound Obstet Gynecol,2008,32(7):900-905.
[38] Nigro G,Adler S P,La Torre R,et al.Passive immunization during pregnancy for congenital cytomegalovirus infection[J].N Engl J Med,2005,353(13):1350-1362.
[39] Adler S P,Finney J W,Manganello A M,et al.Prevention of child-to-mother transmission of cytomegalovirus by changing behaviors:a randomized controlled trial[J].Pediatr Infect Dis J,1996,15(3):240-246.
[40] Adler S P,Finney J W,Manganello A M,et al.Prevention of child-to-mother transmission of cytomegalovirus among pregnant women[J].J Pediatr,2004,145(4):485-491.
[41] Cooper L Z,Preblub S R,Alford C A.Rubella[M]//Remington J S,Klein J O.Infectious diseases of the fetus and newborn.4th ed.Philadelphia:WB Saunders,1995:268.
[42] Weil M L,Itabashi H,Cremer N E,et al.Chronic progressive panencephalitis due to rubella virus simulating subacute sclerosing panencephalitis[J].N Engl J Med,1975,292(19):994-998.
[43] Gabbe S G,Niebyl J R,Simpson J L.Obstetrics-normal and problem pregnancies[M].4th ed.New York:Churchill Livingstone,2002:1328-1330.
[44] Johnson R E,Hall A P.Rubella arthritis[J].N Engl J Med,1958,258:743-745.
[45] Bayer W L,Sherman F E,Michaels R H,et al.Purpura in congenital and acquired rubella[J].N Engl J Med,1965,273(25):1362-1366.
[46] Miller E,Cradock Watson J E,Pollock T M.Consequences of confirmed maternal rubella at successive stages of pregnancy[J].Lancet,1982,2(8302):781-784.
[47] Gregg N M.Congenital cataract following German measles in the mother[J].Trans Am Ophthalmol Soc,1941,3:35.
[48] Webster W S.Teratogen update:congenital rubella[J].Teratology,1998,58(1):13-23.
[49] Peckham C S.Clinical and laboratory study of children exposed in utero to maternal rubella[J].Arch Dis Child,1972,47(254):571-577.
[50] Enders G,Nickerl Pacher U,Miller E,et al.Outcome of confirmed periconceptional maternal rubella[J].Lancet,1988,1(8600):1445-1447.
[51] Bullens D,Smets K,Vanhaesebrouck P.Congenital rubella syndrome after maternal reinfection[J].Clin Pediatr(Phila),2000,39(2):113-116.
[52] Aboudy Y,Fogel A,Barnea B,et al.Subclinical rubella reinfection during pregnancy followed by transmission of virus to the fetus[J].J Infect,1997,34(3):273-276.
[53] Mendelson E,Aboudy Y,Smetana Z,et al.Laboratory assessment and diagnosis of congenital viral infections:Rubella, cytomegalovirus(CMV), varicella-zostervirus(VZV),herpes simplex virus(HSV),parvovirus B19 and human immunodeficiency virus(HIV)[J].Reprod Uctive Toxicol,2006,21(4):350-382.
[54] Centers for Disease Control.Control and prevention of rubella:evaluation and management of suspected outbreaks,rubella in pregnant women,and surveillance for congenital rubella syndrome[J].MMWR Recomm Rep,2001,50(RR-12):1-23.
[55] Frey T K,Abernathy E S.Identification of strain-specific nucleotide sequences in the RA 27/3 rubella vaccine[J].J Infect Dis,1993,168(4):854-864.
[56] Bosma T J,Corbett K M,Eckstein M B,et al.Use of PCR for prenatal and postnatal diagnosis of congenital rubella[J].J Clin Microbiol,1995,33(11):2881-2887.
[57] Ho Terry L,Terry G M,Londesborough P.Diagnosis of foetal rubella virus infection by polymerase chain reaction[J].J Gen Virol,1990,71(Pt 7):1607-1611.
[58] Ozsoylu S,Kanra G,Savas G.Thrombocytopenic purpura related to rubella infection[J].Pediatrics,1978,62(4):567-569.
[59] Reef S E,Plotkin S,Cordero J F,et al.Preparing for Congenital syndrone elimination:summary of the workshop on Congenital Rubella Syndrome(CRS)Elimination in the United States[J].Clin Infect Dis,2000,31(1):85-95.
[60] Bart S W,Stetler H C,Preblud S R,et al.Fetal risk associated with rubella vaccine:an update[J].Rev Infect Dis,1985,7(Suppl 1):S95-S102.
[61] Centers for Disease Control.Rubella vaccination during pregnancy-United States,1971-1988[J].MMWR Morb Mortal Wkly Rep,1989,38(17):289-293.
[62] Immunization during pregnancy.American College of Obstetricians and Gynecologists Technical Bulletin,No.160,October 1991.In:Compendium of selected publications:528-37.
[63] Centers for Disease Control.Notice to readers.Revised ACIP recommendations for avoiding pregnancy after receiving a rubella-containing vaccine[J].MMWR Morb Mortal Wkly Rep,2001,50(49):1117.
[64] Canepa P,Valle L,Cristina E,et al.Role of congenital rubella reference laboratory:21-months-surveillance in Liguria,Italy[J].J Prev Med Hyg,2009,50(4):221-226.
[65] Remington J S,McLeod R,Thuilliez P,et al.Toxoplasmosis[M]//Remington J S,Klein J O,Wilson C B,et al.Infectious diseases of the fetus and newborn infant.6th ed.Philadelphia:Elsevier Saunders,2006:947-1091.
[66] Montoya J G,Remington J S.Management of Toxoplasma gondii infection during pregnancy[J].Clin Infect Dis,2008,47(4):554-566.
[67] Boyer K M,Holfels E,Roizen N,et al.Risk factors for Toxoplasma gondii infection in mothers of infants with congenital toxoplasmosis:Implications for prenatal management and screening[J].Am J Obstet Gynecol,2005,192(2):564-571.
[68] Paquet C,Yudin M H.Toxoplasmosis in pregnancy:prevention,screening,and treatment[J].J Obstet Gynaecol Can,2013,35(1):78-79.
[69] Mitchell C D,Erlich S S,Mastrucci M T,et al.Congenital toxoplasmosis occurring in infants perinatally infected with human immunodeficiency virus 1[J].Pediatr Infect Dis J,1990,9(7):512-518.
[70] Remington J S,McLeod R,Desmonts G.Toxoplasmosis[M]//Remington J S,Klein J O.Infectious diseases of the fetus and newborn infant.4th ed.Philadelphia:W.B.Saunders,1995:140-267.
[71] Wechsler B,Le Thi Huong D,Vignes B,et al.Toxoplasmose et lupus:Revue de la litterature a propos de 4 observations[J].Ann Med Interne(Paris),1986,137(4):324-330.
[72] Dunn D,Wallon M,Peyron F,et al.Mother-to-child transmission of toxoplasmosis:risk estimates for clinical counselling[J].Lancet,1999,353(9167):1829-1833.
[73] Public Health Service,Department of Health and Human Services;US Food and Drug Administration.FDA public health advisory:limitations of toxoplasma IgM commercial test kits.Rockville,MD:Department of Health and Human Services;US Food and Drug Administration,1997:3.
[74] Liesenfeld O,Montoya J G,Tathineni N J,et al.Confirmatory serologic testing for acute toxoplasmosis and rate of induced abortions among women reported to have positive Toxoplasma immunoglobulin M antibody titers[J].Am J Obstet Gynecol,2001,184(2):140-145.
[75] Liesenfeld O,Press C,Montoya J G,et al.False-positive results in immunoglobulin M(IgM)toxoplasma antibody tests and importance of confirmatory testing:the Platelia Toxo IgM test[J].J Clin Microbiol,1997,35(1):174-178.
[76] Wilson M,Remington J S,Clavet C,et al.Evaluation of six commercial kits for detection of human immunoglobulin M antibodies to Toxoplasma gondii[J].J Clin Microbiol,1997,35(12):3112-3115.
[77] Hedman K,Lappalainen M,Seppaia I,et al.Recent primary Toxoplasma infection indicated by a low avidity of specific IgG[J].J Infect Dis,1989,159(4):736-740.
[78] Lappalainen M,Koskela P,Koskiniemi M,et al.Toxoplasmosis acquired during pregnancy:improved serodiagnosis based on avidity of IgG[J].J Infect Dis,1993,167(3):691-697.
[79] Pelloux H,Brun E,Vernet G,et al.Determination of anti-Toxoplasma gondii immunoglobulin G avidity:adaptation to the Vidas system(bioMe-rieux)[J].Diagn Microbiol Infect Dis,1998,32(2):69-73.
[80] Romand S,Wallon M,Franck J,et al.Prenatal diagnosis using polymerase chain reaction on amniotic fluid for congenital toxoplasmosis[J].Obstet Gynecol,2001,97(2):296-300.
[81] Montoya J G,Huffman H B,Remington J S.Evaluation of the immunoglobulin G avidity test for diagnosis of toxoplasmic lymphadenopathy[J].J Clin Microbiol,2004,42(10):4627-4631.
[82] Montoya J G,Liesenfeld O,Kinney S,et al.Remington J S.VIDAS test for avidity of Toxoplasma-specific immunoglobulin G for confirmatory testing of pregnant women[J].J Clin Microbiol,2002,40(7):2504-2508.
[83] Grover C M,Thulliez P,Remington J S,et al.Rapid prenatal diagnosis of congenital Toxoplasma infection by using polymerase chain reaction and amniotic fluid[J].J Clin Microbiol,1990,28(10):2297-2301.
[84] Hohlfeld P,Daffos F,Costa J M,et al.Prenatal diagnosis of congenital toxoplasmosis with a polymerase-chain-reaction test on amniotic fluid[J].N Engl J Med,1994,331(11):695-699.
[85] Gilbert R,Gras L.Effect of timing and type of treatment on the risk of mother to child transmission of Toxoplasma gondii[J].BJOG,2003,110(2):112-120.
[86] Desmonts G,Couvreur J.Congenital toxoplasmosis:a prospective study of the offspring of 542 women who acquired toxoplasmosis during pregnancy[M]//Thalhammer O,Pollak A,Baumgarten K.Perinatal medicine:proceedings of the 6th European Congress,Vienna.Stuttgart,Germany:Georg Thieme Publishers,1979:51-60.
[87] Forestier F,Daffos F,Hohlfeld P,et al.Les foetopathies infectieuses.Prevention,diagnostic prenatal,attitude pratique[J].Presse Med,1991,20(30):1448-1454.
[88] Hohlfeld P,Daffos F,Thulliez P,et al.Fetal toxoplasmosis:outcome of pregnancy and infant follow-up after in utero treatment[J].J Pediatr,1989,115(5 Pt 1):765-769.
[89] Couvreur J,Desmonts G,Thulliez P.Prophylaxis of congenital toxoplasmosis.Effects of spiramycin on placental infection[J].J Antimicrob Chemother,1988,22(Suppl B):193-200.
[90] Anzivino E,Fioriti D,Mischitelli M,et al.Herpes simplex virus infection in pregnancy and in neonate:status of art of epidemiology,diagnosis,therapy and prevention[J].Virol J,2009,6:40.
[91] Engelberg R,Carrell D,Krantz E,et al.Natural history of genital herpes simplex virus type 1 infection[J].Sex Transm Dis,2003,30(2):174-177.
[92] Patel R,Alderson S,Geretti A,et al.European guideline for the management of genital herpes,2010[J].Int J STD AIDS,2011,22(1):1-10.
[93] Brown Z A,Selke S,Zeh J,et al.The acquisition of herpes simplex virus during pregnancy[J].N Engl J Med,1997,337(8):509-515.
[94] Roberts C M,Pfister J R,Spear S J.Increasing proportion of herpes simplex virus type 1 as a cause of genital herpes infection in college students[J].Sex Transm Dis,2003,30(10):797-800.
[95] Benedetti J,Corey L,Ashley R.Recurrence rates in genital herpes after symptomatic first-episode infection[J].Ann Intern Med,1994,121(11):847-854.
[96] Domeika M,Bashmakova M,Savicheva A,et al.Guidelines for the laboratory diagnosis of genital herpes in eastern European countries[J].Euro Surveill,2010,15(44).
[97] Deborah Money M D,Vancouver B C,Marc Steben,M D,et al.Guidelines for the management of herpes simplex virus in pregnancy[J].Sogc Cli Practice Guideline,2008,208:167-170.
[98] Scott L L,Sanchez P J,Jackson G L,et al.Acyclovir suppression to prevent cesarean delivery after first-episode genital herpes[J].Obstet Gynecol,1996,87(1):69-73.
[99] Garland S M,Lee T N,Sacks S.Do antepartum herpes simplex virus cultures predict intrapartum shedding for pregnant women with recurrent disease?[J].Infect Dis Obstet Gynecol,1999,7(5):230-236.
[100] Wittek A E,Yeager A S,Au D S,et al.Asymptomatic shedding of herpes simplex virus from the cervix and lesion site during pregnancy[J].Am J Dis Child,1984,138(5):439-442.
[101] Gibbs R S,Amstey M S,Sweet R L,et al.Management of genital herpes infection in pregnancy[J].Obstet Gynecol,1988,71(5):779-780.
[102] Kriebs J M.Understanding herpes simplex virus:transmission,diagnosis,and considerations in pregnancy management[J].J Midwifery Womens Health,2008,53(3):202-208.
[103] Brock B V,Selke S,Benedetti J,et al.Frequency of asymptomatic shedding of herpes simplex virus in women with genital herpes[J].JAMA,1990,263(3):418-420.
