热疗对胃癌细胞株化疗敏感性的影响
2014-10-02李芳孔凡志李旭忠周联明张光军黄忠明何以丰张学利
李芳 孔凡志 李旭忠 周联明 张光军 黄忠明 何以丰 张学利
(1.苏州大学研究生院,江苏苏州 215006;2.上海市奉贤区中心医院普外科,上海 201400;3.上海交通大学医学院附属仁济医院妇产科,上海 200127)
化疗是晚期胃癌的治疗手段之一,然而,多药耐药常导致化疗疗效降低甚至失败。为了克服化疗耐药的问题,抗肿瘤药物常与其他治疗方法(如热疗)联合应用。据报道,热疗在晚期癌症患者中反应良好,热疗可以增加肿瘤对放疗和化疗的敏感性,降低肿瘤细胞的耐药性[1]。目前,国内外关于热疗影响化疗敏感性的机制尚有争议。本研究旨在从细胞水平上观察热疗作用下胃癌细胞株对紫杉醇的敏感性变化。
1 资料与方法
1.1 细胞来源及试剂 胃癌细胞株MKN-45由复旦大学生命科学院遗传开放实验室提供。DMEM/F12培养基购自加拿大Wisent公司;胎牛血清、胰酶购自美国Gibco公司;CCK-8(cell counting kit-8)试剂盒购自上海生博医学生物工程科技公司,逆转录试剂盒购自美国Promega公司;RIPA裂解液Ⅰ购自上海生工生物工程有限公司;多药耐药相关基因(multi-drug resistance gene,MDR1)及 β-actin 引物由美国Invitrogen公司合成。
1.2 主要仪器 聚合酶链反应(polymerase chain reaction,PCR)扩增仪购自浙江省杭州朗基科学仪器有限公司;酶联免疫检测仪购自美国Bio-Tek公司(型号:ELx800);实时荧光定量 PCR(real-time PCR,RT-PCR)仪购自美国 Applied Biosystems公司。
1.3 方法
1.3.1 引物的合成及 siRNA的设计和合成用Primer Premier 5.0软件设计引物,β-actin上游引物为 5'-GGCCTCGCTGTCCACCTTCC-3',下游引物为 5'-TCACCTTCACCGTTCCAGTTTTTA-3',扩增片段长度为255 bp;MDR1基因上游引物为 5'-TGCCATAGCTCGTGCCCTTGTTAG-3',下游引物为 5'-TGCGTGCCATGCTCCTTGACTCT-3',扩增片段长度为 219 bp。
siRNA由上海吉玛药物有限公司设计并合成。针对MDR1基因选择3个靶点,设计3条siRNAs,序列如下:Si-1上游引物为 5'-CACCCAGGCAAUGAUGUAUTT-3 ',下游引物为5'-AUACAUCAUUGCCUGGGUGTT-3 ';Si-2 上游引物为 5'-GCGAAGCAGUGGUUCAGGUTT-3 ',下游引物为 5'-ACCUGAACCACUGCUUCGCTT-3';Si-3上游引物为5'-CUUUGGCUGCCAUCAUCCATT-3 ',下游引物为 5'-UGGAUGAUGGCAGCCAAAGTT-3 ',实验中用作siRNA的阴性对照命名为 siRNA-nc,阳性对照为siRNA-β-actin。
1.3.2 胃癌细胞株的培养及siRNA转染 对紫杉醇敏感的胃癌细胞株MKN-45用含10% 胎牛血清、100 U/mL 青霉素、100 μg/mL 链霉素、100 μg/mL两性霉素的 DMEM/F12培养基,在37℃、CO2体积分数为5%的温箱中培养,用0.25%胰蛋白酶消化传代。取对数生长期MKN-45细胞接种至含紫杉醇的完全培养液中,紫杉醇浓度为10 μg/mL,作用48 h后弃去含药培养液,加入新鲜培养液继续培养,待恢复正常生长状态时消化传代,再用10 μg/mL紫杉醇处理48 h,如此反复换液、传代,逐步提高紫杉醇浓度,间歇诱导,最终获得1株能耐受 300 μg/mL紫杉醇的细胞系,并将其维持培养在含0.1 μg/mL紫杉醇的完全培养液中,培养8个月后建立紫杉醇耐药细胞株,命名为MKN-45/TAX。将细胞加入6孔板,细胞浓度为2×106个/mL,将细胞分为2组:转染siRNA-MDR1的MKN-45/TAX组,转染 siRNA-MDR1的 MKN-45组,在 37℃、CO2体积分数为5%的条件下孵育。按siRNA说明书进行转染操作,以正常未作处理的MKN-45/TAX及MKN-45细胞作为对照。培养48 h后收获细胞并进行检测。
1.3.3 MDR1 mRNA水平的检测 采用 RT-PCR法。用Trizol试剂提取细胞的总RNA,将总RNA反转录成 cDNA。RT-PCR反应体系:Primer11 μL、Primer21 μL、cDNA 1 μL、Mg2+3 μL、10 × Buffer 3 μL、dNTP 1 μL、Taq 酶0.5 μL、无菌水 19.5 μL。在PCR扩增仪中反应,条件为:94℃预变性5 min;94℃变性30 s,50℃退火45 s,72℃延伸45 s,共35个循环。以β-actin管家基因作为内参。在PCR产物中加入6 μL 6 × Loading Buffer混匀后,各取 10μL混合物进行1.2%琼脂糖凝胶电泳,并在凝胶成像系统中观察。
1.3.4 P 糖蛋白(P-glycoprotein,P-gp)检测 采用蛋白质印迹(Western blotting)法。实验分4组,分别为37℃ 1 h培养细胞、42℃ 1 h培养细胞、42℃1 h+siRNA-MDR1培养细胞和42℃ 1 h+siRNA-βactin培养细胞;每组分别有 MKN-45及 MKN-45/TAX两种细胞。取各组细胞1×107个,按RIPA裂解液Ⅰ试剂说明书提取蛋白质,采用BCA法进行蛋白定量,与等体积的2×SDS上样缓冲液混合后,每泳道蛋白上样量为20 μL,进行十二烷基磺酸钠–聚丙烯酰胺凝胶电泳(8%分离胶,4%浓缩胶),然后电转移至聚偏氟乙烯膜,5%脱脂奶粉封闭2 h,加MDR1单克隆抗体(工作浓度为1∶100)和β-actin单克隆抗体(工作浓度为1∶1000)后4℃孵育过夜,加辣根过氧化物酶标记的二抗(工作浓度为1∶5000)后室温温育2 h,电化学发光法检测,曝光,显影。
1.3.5 免疫细胞化学染色法检测细胞中MDR1的表达 取5×103个细胞,接种至24孔板中,37℃、CO2体积分数为5%的温箱中培养48 h,然后磷酸盐缓冲液(PBS)洗3遍;用70%乙醇固定15 min,PBS洗3遍;加MDR1单克隆抗体后于4℃孵育1 h,PBS洗5 min,重复3次;加辣根过氧化物酶标记的二抗孵育1 h,PBS洗5 min,重复3次;二氨基联苯胺(3,3'-diaminobenzidine,DAB)显色 10 min;自来水充分冲洗后,苏木素复染,显微镜下观察。
1.3.6 CCK-8法检测不同温度下siRNA干扰前后的MKN-45/TAX与MKN-45细胞在化疗药物环境中的活力
将siRNA干扰前后的胃癌细胞株MKN-45/TAX与MKN-45分别接种至96孔板中,每孔细胞数为1×104个,培养2 d后每组各选18个孔,加入0.1、0.25、0.5 mg/mL 紫杉醇,在所有孔中加入 100 μL培养基;以不加化疗药物而种有细胞的18孔为对照组,再设3个只加100 μL培养基的空白对照组(不含细胞和化疗药物)。一块板于37℃、CO2体积分数为5%的培养箱中培养1 h,另一块板于42℃、CO2体积分数为5%的培养箱中培养1 h。每孔加入10 μL的CCK-8试剂孵育4 h后,放入酶联免疫检测仪中,于波长450 nm处测定吸光度值。将各组细胞与对照组进行比较,计算各组细胞增殖抑制率。
1.4 统计学处理 采用SPSS 19.0软件进行统计学处理,计量资料以表示,采用t检验比较各组间差异,以P<0.05为差异有统计学意义。
2 结 果
2.1 CCK-8法检测不同温度下和不同浓度紫杉醇处理后各组细胞增殖抑制率 与37℃时相比,42℃时紫杉醇对MKN-45/TAX细胞的增殖抑制率明显降低,对MKN-45的增殖抑制率明显升高,见图1。这说明升高温度可提高MKN-45细胞对紫杉醇的敏感性,而显著降低MKN-45/TAX对紫杉醇的敏感性,高温培养对两者的作用正好相反。

图1 不同温度下紫杉醇对胃癌细胞株的增殖抑制率
2.2 Western blotting检测各组细胞P-gp表达的变化 37℃时MKN-45细胞中P-gp表达水平低于MKN-45/TAX细胞;2种细胞经42℃培养1 h后,细胞内P-gp的表达量都较升温前显著增加,且MKN-45/TAX细胞中P-gp的表达升高幅度更大。见图2。MDR1的高表达可能是MKN-45/TAX细胞株在高温培养下出现反常行为的主要原因。
2.3 免疫细胞化学染色法检测各组细胞中P-gp的表达 MKN-45/TAX细胞胞浆染色明显比MKN-45细胞深,表明前者的P-gp基础表达量高于后者,见图3。42℃培养后2种细胞内P-gp的表达量都较升温前显著增加,且MKN-45/TAX细胞中P-gp的表达量升高幅度更大,这与Western blotting检测结果一致。
2.4 MDR1特异性siRNA可下调MKN-45/TAX细胞中 MDR1的表达 与对照组比较,转染靶向MDR1的3条 siRNAs后48 h时,MKN-45细胞和MKN-45/TAX细胞中MDR1 mRNA的表达均下调,其中MDR1 siRNA-2干扰效果最佳,见图4。因此,我们采用siRNA-2进行后续实验。转染MDR1的siRNA-2后,各组细胞P-gp蛋白的表达量较相应的对照细胞明显减少,差异有统计学意义(P<0.05),见图5。

图2 Western blotting检测不同温度时胃癌细胞株中P-gp蛋白的表达
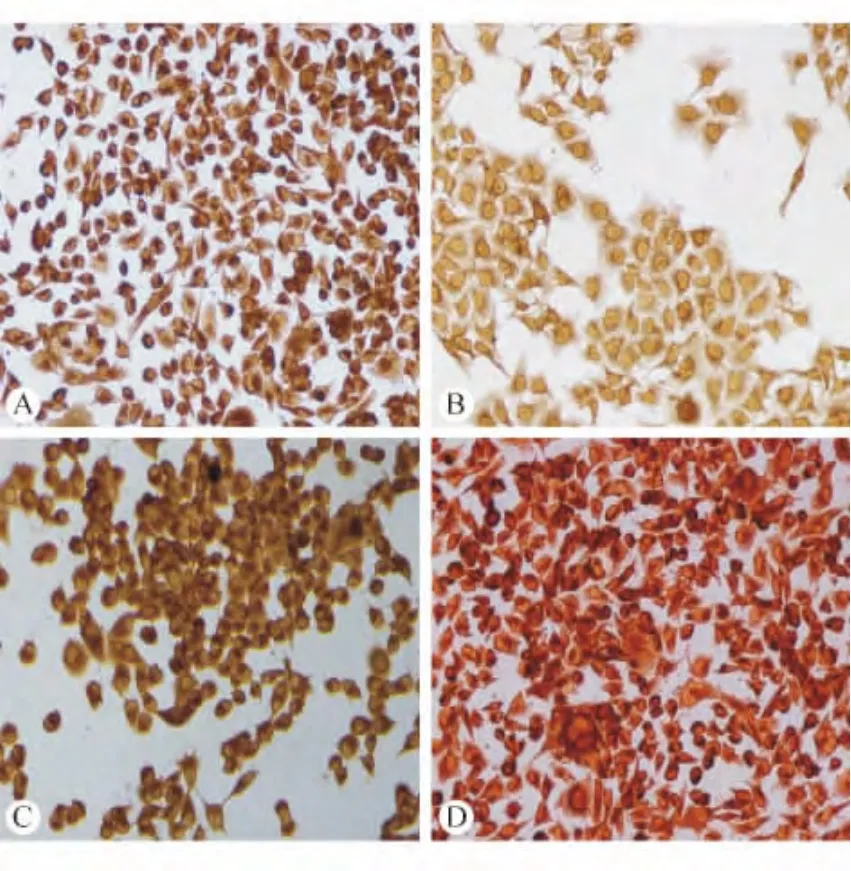
图3 免疫组化检测胃癌细胞株P-gp表达
2.5 转染siRNA-2后高温对各组细胞增殖抑制率的影响 将siRNA-2干扰后的两组细胞株经42℃培养并用CCK-8法检测紫杉醇对其的增殖抑制率,siRNA-2干扰后2种细胞株对紫杉醇的敏感性均增加,并趋于一致。见图6。
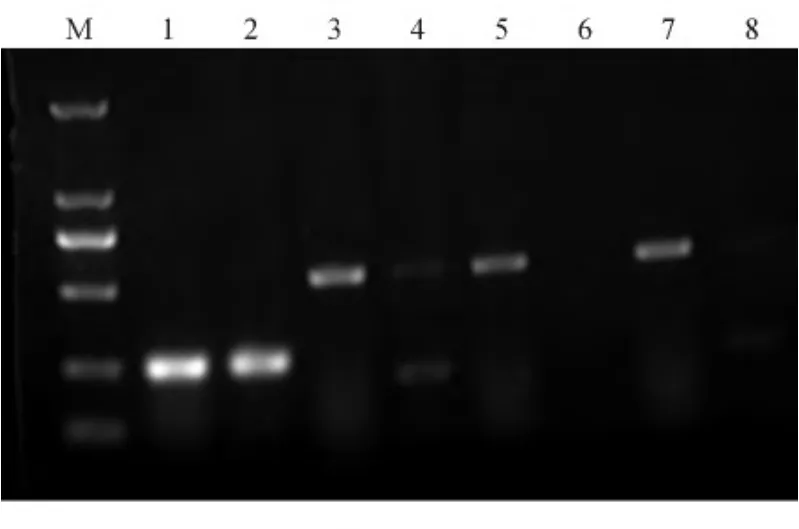
图4 MDR1 mRNA的表达水平

图5 Western blotting检测MDR1 siRNA沉默前后胃癌细胞株中P-gp蛋白的表达水平
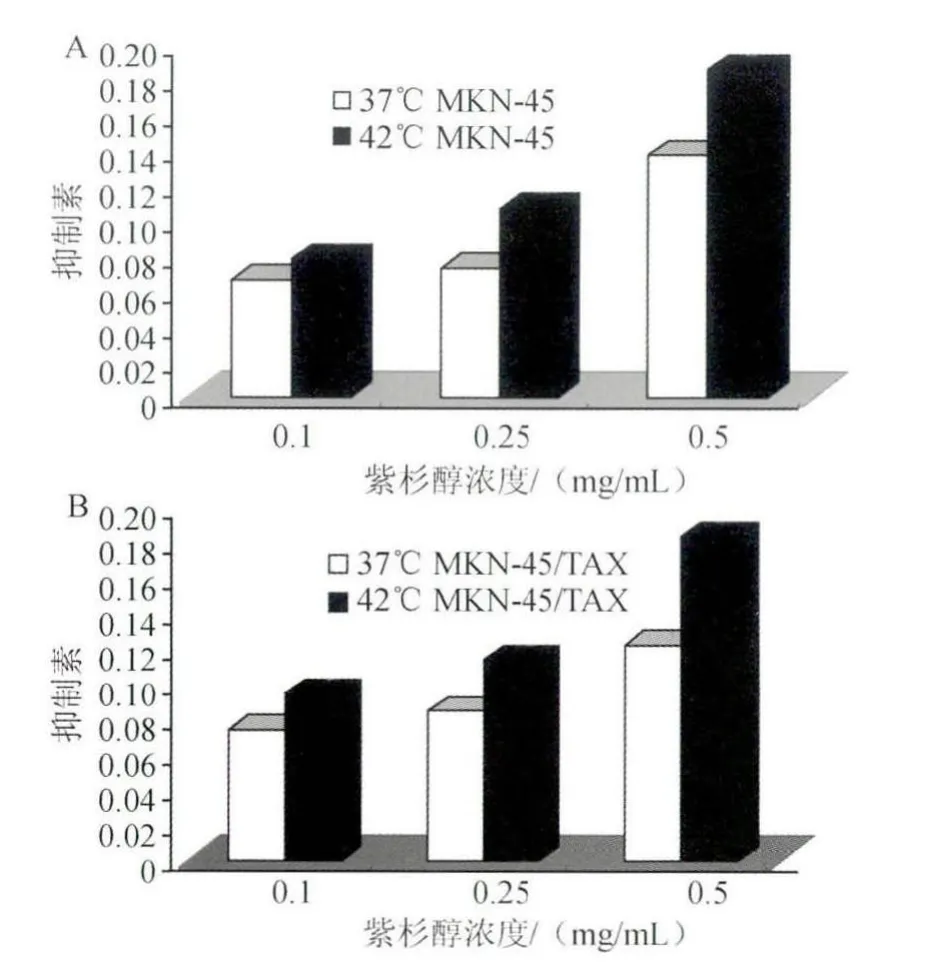
图6 高温时siRNA-2干扰后MKN-45及MKN-45/TAX对紫杉醇的敏感性的变化
3 讨 论
热疗对细胞的杀伤作用主要取决于热疗的温度及时间。研究[2]表明,胃癌细胞在40~43℃时凋亡最明显,但该研究是在对化疗药物敏感的细胞和病例中进行的,目前缺乏对已发生化疗耐药的细胞和病例的实验数据,且国内外关于热疗影响化疗敏感性的机制尚存争议[3-4]。为此,本实验筛选了对紫杉醇耐药的MKN-45/TAX胃癌细胞,并就热疗对化疗的增敏效果进行了研究。
本研究发现,P-gp在MKN-45及MKN-45/TAX中均有表达,但MKN-45/TAX中P-gp表达量较高。升温处理后,P-gp在MKN-45及MKN-45/TAX中表达均增加,说明升温促进了P-gp表达。但是,升温虽然增加MKN-45对紫杉醇的敏感性,但却增加了MKN-45/TAX对紫杉醇的耐药性。同时发现,升温培养后,P-gp表达量在MKN-45/TAX中上升幅度显著高于MKN-45。由此可以推测,升温致耐药细胞更耐药的原因与MDR1高表达有关。为了验证这一假设,本研究引入了特异性 siRNA,使细胞中MDR1基因沉默,然后对2种细胞进行升温处理,结果发现,升温后2种细胞对紫杉醇的敏感性趋于一致,这说明P-gp高表达是MKN-45/TAX细胞在高温培养下出现反常行为的主要原因,因此,对于耐药细胞的这种反常行为来说,实施MDR-1干扰是一种有效的逆转手段。
热疗能否逆转多药耐药,令人关注,以往研究[5]表明,热疗联合化疗可降低肿瘤细胞耐药性,促进癌细胞凋亡。其机制主要有以下几方面:(1)轻度高温可破坏细胞骨架成分,改变细胞膜的通透性,并抑制肿瘤细胞的生长[4];(2)高温可增加药物与DNA的交联,降低DNA的修复能力,还可使某些蛋白质变性,因此可能会逆转肿瘤细胞对化疗药物的多药耐药;(3)高温减少细胞新陈代谢,使药物转运活化,提高细胞的药物浓度,同时能降低癌中组织间隙液压,增加癌组织对抗癌药物的渗透性,直接渗透深度可达5 mm[6];(4)富氧细胞对化疗的敏感性高于乏氧细胞,乏氧细胞对热疗的敏感性高于富氧细胞,化疗配合热疗可既杀灭富氧细胞,又杀灭乏氧细胞。然而,本研究发现,高温可上调耐药细胞中MDR1基因的表达量,加强其耐药性。
本研究结果证明,升温不一定增强癌细胞对化疗药物的敏感性,相反,在某些条件下,如细胞耐药情况下,热疗还进一步增强细胞对化疗药物的耐受能力。
[1]张峰,刘国平,刘畅,等.进展期胃癌患者术后腹腔持续温热灌注化疗联合静脉化疗的疗效观察[J].中国临床医学,2011,18(3):338-340.
[2]Tao Y,Guo Y,Liu W,et al.AKT inhibitor suppresses hyperthermia-induced Ndrg2 phosphorylation in gastric cancer cells[J].Braz J Med Biol Res,2013,46(4):394-404.
[3]Lv F,Yu Y,Zhang B,et al.Inhibitory effects of mild hyperthermia plus docetaxel therapy on ER(+/-)breast cancer cells and action mechanisms[J].J Huazhong Univ Sci Technolog Med Sci,2013,33(6):870-876.
[4]Walther W,Arlt F,Fichtner I,et al.Heat-inducible in vivo gene therapy of colon carcinoma by human mdr1 promoter-regulated tumor necrosis factor-alpha expression[J].Mol Cancer Ther,2007,6(1):236-243.
[5]Stein U,Jüerchott K,Walther W,et al.Hyperthermia-induced nuclear translocation of transcription factor YB-1 leads to enhanced expression of multidrug resistance-related ABC transporters[J].J Biol Chem,2001,276(30):28562-28569.
[6]El-Kareh AW,Secomb TW.A theoretical model for intraperitoneal delivery of cisplatin and the effect of hyperthermia on drug penetration distance[J].Neoplasia,2004,6(2):117-127.
