慢病毒载体构建稳定的maspin表达敲减食管癌细胞株
2014-09-28陈静,周园,郑磊,王前,蔡贞
陈 静,周 园,郑 磊,王 前,蔡 贞
0 引 言
Maspin广泛表达于人体组织,是丝氨酸蛋白酶抑制剂超家族中clade B亚家族的一员,但结构特点提示其可能并不具有蛋白酶抑制功能[1]。1994年Zou等[2]首次报道了maspin具有肿瘤抑制基因的功能,并发现其在正常乳腺上皮细胞中高表达,而在具有侵袭和转移能力的乳腺癌细胞中表达下调;用maspin转染MDA-MB-435乳腺癌细胞株后,可降低癌细胞在裸鼠体内的成瘤能力,减弱其穿透基底膜及转移能力。随后,maspin被相继报道在多种恶性肿瘤中表达下调或缺失,包括前列腺癌、结肠癌、胃癌、肺癌、口腔鳞状上皮癌等,并与肿瘤分期、肿瘤大小、患者对治疗的反应性及预后、肿瘤的复发及转移有相关性[3-5]。
前期的研究我们发现maspin在食管癌组织中的表达较正常食管上皮组织明显减低;在用食管癌转移淋巴结构建的异体移植肿瘤中maspin的表达进一步下调甚至缺失,这一结果得到证实[6]。后续研究中发现稳定转染maspin的EC109食道癌细胞未出现EGF诱导的上皮间质样转化现象,并且稳定转染细胞的恶性表型也发生了逆转[7]。为进一步研究maspin的作用机制,本研究拟采用慢病毒介导的短发夹RNA(short hairpin RNA,shRNA)技术构建maspin表达敲减的食管癌细胞株,作为后续研究maspin功能及其影响食道癌发生发展的分子机制的细胞模型。
1 材料与方法
1.1 材料和试剂 慢病毒载体质粒pLL3.7由香港大学李嘉诚医学院生化系金冬雁教授赠送;逆转录试剂盒、qPCR试剂盒购自TaKaRa公司;T4 DNA连接酶及XbaⅠ/XhoⅠ限制性内切酶购自New England Biolabs公司;质粒抽提、凝胶回收与纯化试剂盒购自Qiagen公司;DNA转染试剂Lipofectamine 2000购自Life Technologies;鼠抗人maspin单克隆抗体及β-actin单克隆抗体(AC-15)分别购自BD Biosciences及Sigma公司;嘌呤霉素及其他化学试剂购自 Sigma公司;U6-XbaⅠ-F,shMaspin-1和shMaspin-2寡核苷酸序列由Sigma公司合成;所有溶液均用MilliQ级超纯水配制。
1.2 细胞培养 人ESCC HKESC-2细胞来源于1名香港女性患者[8];用于慢病毒包装的人胚肾细胞(293FT)由香港大学李嘉诚医学院生化系金冬雁教授赠送。HKESC-2和293FT细胞常规培养于含10%FBS的高糖DMEM培养基中,于37℃、5%CO2条件下培养。所有细胞培养所需试剂购自Life Technologies公司。
1.3 构建shMaspin慢病毒表达载体 以人maspin编码序列(NM_002639.4)为模板,按照 RNAi序列设计原则,利用Darmacon siDESIGN Center软件设计特异的siRNA序列。最终确定2个序列合成shRNA寡核苷酸序列(GCACAAGGATGAATTGAAT和 GCTTAGAAATAACTGAAGA),并于 5'端加入XhoⅠ酶切位点,以此序列作为后续PCR扩增的下游引物,合成序列如图1。以pLL3.7载体为模板,带有XbaⅠ位点的U6-XbaⅠ-F寡核苷酸序列作为上游引物(5'-CCCGCTCTAGAAGGTCGGGCAGGAAGAGGG-3'),U6-XhoⅠ-R1(shMaspin1)及 U6-XhoⅠ-R2(shMaspin2)为下游引物进行PCR扩增。扩增条件为95℃ 5min,1个循环;95℃ 30s,55℃ 30 s,72℃ 30 s 30个循环,72℃ 10 min。PCR产物回收纯化后经XbaⅠ/XhoⅠ双酶切,用T4 DNA连接酶将shMaspin PCR产物连接至同步经XbaⅠ/XhoⅠ消化的带有U6启动子的pLL3.7慢病毒载体中,室温连接2 h后转化至DH5α感受态细胞,次日挑选阳性克隆进行酶切分析及DNA序列测定。
1.4 病毒包装 病毒包装步骤参照文献[9]。将293FT细胞传代至6孔细胞培养板中至细胞密度生长至70%左右,实验前2 h每孔更换为1 mL无血清DMEM培养基待用。取3个微量离心管,每管加入无血清DMEM培养基500 μL,分别加入慢病毒表达质粒 shMas1/pLL3.7、shMas2/pLL3.7 和 pLL3.7 空质粒0.8 μg,然后在离心管中加入1.2 μg病毒包装质粒混合物(pLP1/gag pol、pLP2/REV及pLP/VSVG)和6 μL Lipofectamine 2000,轻轻混匀。静置20 min后分别加入293FT细胞中,培养24 h后更换含10%FBS的DMEM完全培养基,继续培养24h,收集培养液上清,5000 r/min离心5 min去除细胞碎片,上清以0.22 μm过滤后置-80℃冰箱保存待用。
1.5 HKESC-2细胞感染及筛选 感染前24 h,将HKESC-2细胞以5×104/孔接种于6孔培养板,至次日生长至密度为70%左右时进行感染。在不同孔内分别加入重组病毒感染细胞24h后,更换培养基继续培养24 h。加入嘌呤霉素筛选感染细胞。不同细胞株对嘌呤霉素的耐受性不同,将未经感染的对照组细胞悬浮死亡的最低浓度作为最佳的筛选浓度。测定3、2、1、0.5 μg/mL 的嘌呤霉素浓度对 HKESC-2 细胞生长的影响,最终确定以1 μg/mL为筛选浓度,筛选后获得的稳定细胞株分别命名为shMas1/HK2、shMas2/HK2,空病毒载体感染细胞株作为阴性对照。

图1 shMas 1和shMas 2寡核苷酸序列设计Figure 1 Oligonucleotide primer design of shMas 1 and shMas 2
1.6 荧光定量 PCR 收集 shMas1/HK2、shMas2/HK2、野生型HKESC-2及阴性对照(空病毒载体感染细胞)对数生长期细胞,Trizol提取细胞总RNA,逆转录合成cDNA并进行qPCR分析。maspin正向引物:5'-ATCAAGCTTCGGATGCCCCTGCAACTAGCAAATTC-3',反向引物,3'-GGGATTGAATTCTTAAGGAGAACAFAATTTGCC-5';内参基因 β-actin正向引物:5'-CTTCTACAATGAGCTGCGTG-3',反向引物5'-TCATGAGGTAGTCAGTCAGG-3'。采用 2-△△CT法计算原始CT值数据。
1.7 Western blot分析 等量蛋白用12%SDSPAGE凝胶进行分离。电泳后利用电转法将蛋白质转印至PVDF膜。5%脱脂奶粉孵育PVDF膜2 h后,加入特异性抗体在室温下孵育2 h,再以过氧化物酶偶联的二抗孵育,最后用ECL检测免疫印迹。
1.8 细胞生长计数分析 将shMas1/HK2、shMas2/HK2、空载体株阴性对照(Negative control,NC)及野生型HKESC-2细胞以0.5×104/mL的密度分别铺种于24孔细胞培养板中,37℃、5%CO2条件培养,每24 h各细胞株取3孔进行常规计数,余孔定期换液维持培养。连续计数8 d。以3孔的平均值作为各组在该时间点的细胞数。
1.9 统计学分析 采用SPSS 13.0软件进行统计分析,结果以均数±标准差()表示,用双侧t检验进行统计学分析,以P≤0.05为差异有统计学意义。
2 结 果
2.1 shMaspin慢病毒表达载体鉴定 PCR扩增shMaspin片段和pLL3.7慢病毒载体经XbaⅠ/XhoⅠ充分酶解消化,再经低浓度琼脂凝胶回收纯化后,用T4 DNA连接酶于室温连接2 h后转化DH5α感受态宿主,挑选阳性克隆进行鉴定。重组阳性克隆的产物为287bp,表示shRNA已经定向连接入pLL3.7载体。选取连接成功的克隆进行测序分析,测序结果表明插入序列正确,见图2。
2.2 HKESC-2细胞中maspin基因敲减效率的检测 Maspin shRNA慢病毒颗粒感染HKESC-2细胞获得稳定细胞株后,以荧光定量PCR检测maspin基因mRNA表达水平的改变。3次独立实验数据表明,与野生型HKESC-2及空载体感染 NC细胞相比,shMas1/HK2及 shMas2/HK2中 maspin mRNA的水平均明显降低,差异有统计学意义(P<0.05),下调率即敲减效率分别为37.8%及58.2%。Western blot检测蛋白水平的改变时也得到了相近的结果,通过对显影后蛋白质条带做密度分析,并以β-actin校正后,计算得shMas1/HK2和shMas2/HK2细胞maspin蛋白质水平表达的相对抑制率分别为49%和53%。见图3。
2.3 shMaspin稳定表达对HKESC-2细胞生长的影响 利用重组慢病毒感染HKESC-2细胞并筛选出稳定细胞株shMas1/HK2、shMas2/HK2及空载体株阴性对照,细胞稳定传代5次后,观察各细胞形态无明显变化。以常规细胞计数法计数细胞生长,maspin敲减组(shMas1/HK2、shMas2/HK2)及对照组(野生型HKESC-2、空载体转染株阴性对照NC)细胞生长速率相比无明显改变,差异无统计学意义(P>0.05)。见图4。但至细胞生长至第7天,细胞密度大于2 ×105个/mL后,第8 天shMas1/HK2、shMas2/HK2较HKESC-2、NC细胞生长明显增快(均值分别为3.33 × 105/mL、3.75 × 105/mL、2.31 × 105/mL 和2.39×105/mL)。单纯比较第8天,2组细胞计数差异有统计学意义(P=0.014),但组间差异无统计学意义(P>0.05),提示maspin表达降低可能对细胞在高密度状态下生长有一定影响。
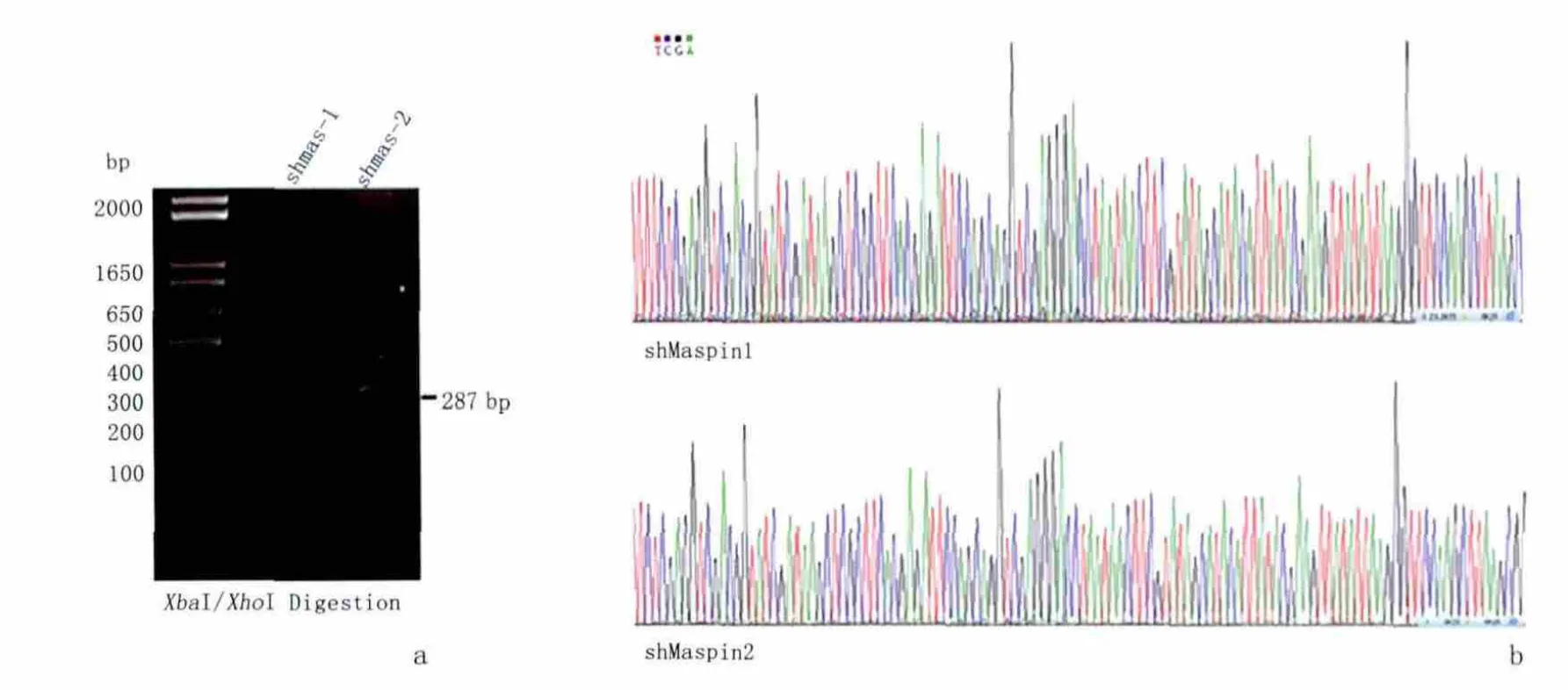
图2 shMaspin慢病毒表达载体的鉴定Figure 2 Identification of shMaspin recombinant slow-virus carrier by enzyme cleavage of PCR products and sequencing
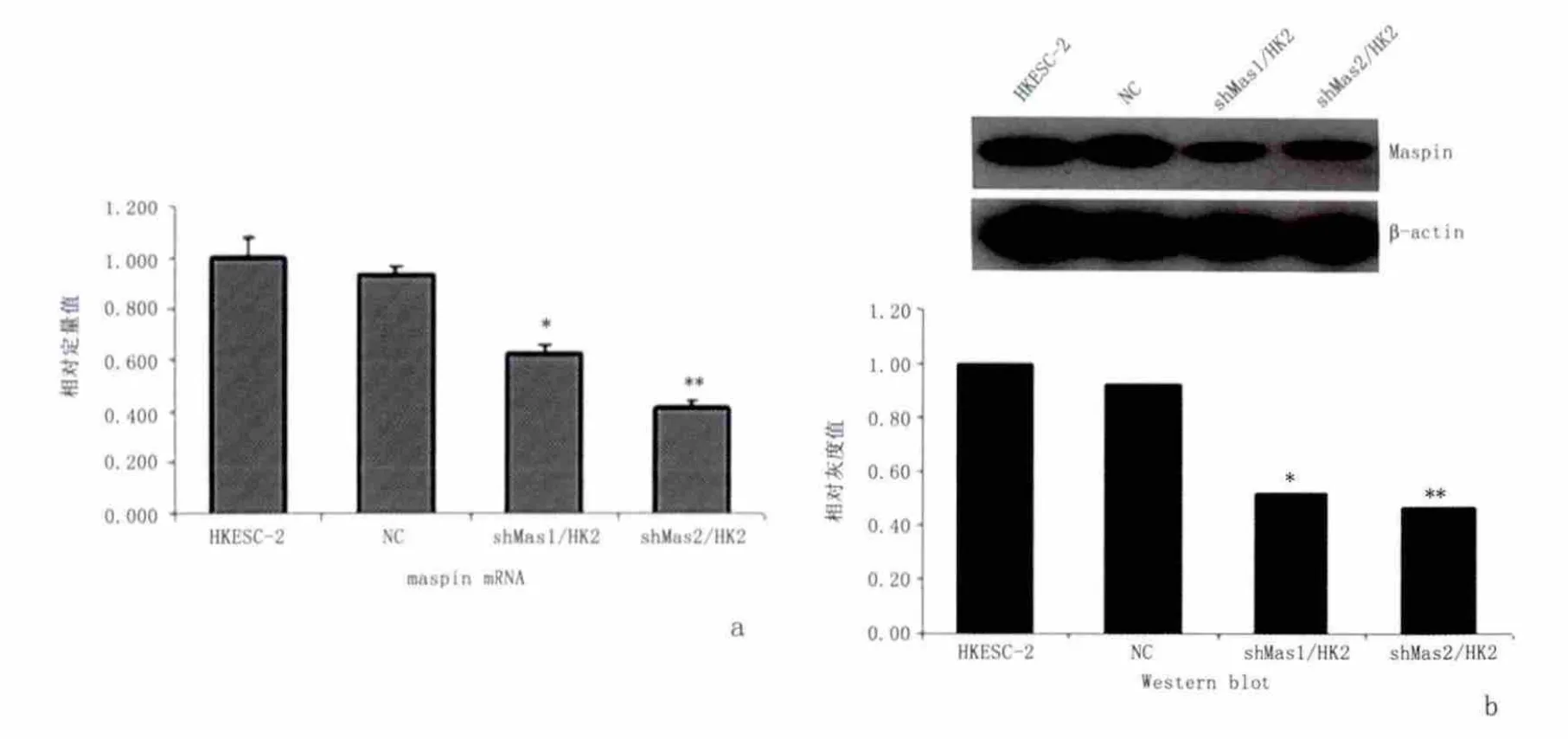
图3 Maspin基因敲减效率检测Figure 3 Maspin knockdown effection was detected by quantitative real-time PCR and Western blot

图4 Maspin基因敲减对HKESC-2细胞生长特性的影响Figure 4 The effect of maspin knockdown on cell morphologyand cell growth
3 讨 论
RNA干扰(RNAinterference,RNAi)是指在生物进化过程中高度保守的、由双链RNA诱发的靶mRNA高效特异性降解,从而导致靶基因表达降低或沉默的现象。这种基因沉默可以作用于多个环节,广泛应用于生命科学领域的研究中[10]。慢病毒介导的shRNA技术是RNAi的主流方法之一,携带shRNA的慢病毒载体能将外源基因整合到宿主染色体上,稳定地转录生成shRNA并加工生成siRNA,进而特异性的抑制靶基因的表达[11]。慢病毒载体具有宿主范围广、产生病毒滴度高、感染效率高、安全性好、作用持久等优点,且允许实现多个shRNA同时作用于不同靶基因,用于多个感兴趣基因的研究中能极大地简化实验过程[12]。在构建重组蛋白、靶基因的过度表达及敲减、基因治疗及诱导性多能干细胞的产生等方面有广泛地应用[13]。
本研究利用pLL3.7慢病毒载体系统,将特异性针对maspin的shRNA转入食管癌细胞株HKESC-2中,成功构建了maspin表达敲减细胞株(shMas1/HK2和shMas2/HK2)。在目的shRNA序列正确插入pLL3.7慢病毒表达载体的基础上,重组慢病毒质粒能够将shRNA片段整合到HKESC-2细胞的染色体上。随细胞分裂增殖,感染细胞将持续表达 maspin特异性 shRNA,经加工后生成siRNA干扰maspin的表达,以此产生稳定的maspin低表达细胞株。本研究中获得的2个稳定感染株中,Maspin在mRNA水平和蛋白质水平的表达均明显减少,达到了较好的干扰效果。
获得稳定感染的maspin表达敲减细胞株后,观察细胞生长情况发现,细胞形态较野生型HKESC-2和空病毒载体感染细胞并无明显变化;在细胞密度较低的情况下,对细胞生长速率也无明显影响。但当细胞计数至第8天,细胞密度较高时,maspin敲减细胞系shMas1/HK2和shMas2/HK2生长速率明显高于其亲代细胞HKESC-2及空载体对照NC细胞,提示maspin表达降低可能对细胞在高密度或能量供给缺乏状态下的细胞生长有一定影响。肿瘤细胞,尤其是具有高侵袭能力的肿瘤细胞常常失去接触抑制特性,并且更适合在酸性微环境中生长和存活[14]。我们前期的实验发现,在无血清培养条件下,maspin稳定转染细胞的增殖速度比其亲代细胞EC109(无maspin表达)慢得多[7],且伴随糖酵解表型的转变,提示maspin重新表达可能促使EC109细胞恶性表型发生了转变,致使其生物学行为更类似于良性表型细胞[7]。本研究中在细胞生长曲线测定后期(第7~8天),由于细胞密度很高,细胞生长环境pH减低,maspin敲减细胞株表现出更强的生长能力。这和之前实验的现象均表明maspin的表达水平有可能对细胞的恶性表型有一定程度的影响,但其具体机制仍需进一步探讨。另有很多研究表明,Maspin在某些肿瘤发展中可发挥抗细胞增殖和促进凋亡的作用。有研究对胃癌细胞株进行maspin表达干扰实验后分析细胞增殖情况和细胞周期的变化,发现转染后G0/G1细胞比率明显降低,而S期细胞比率显著增加[15]。Maspin可参与细胞内重要的转录因子E2F1介导的细胞周期调控通路,通过抑制周期依赖性激酶1所活化的周期蛋白B(CDC25C)的形成减慢胃癌细胞的增殖速度。然而,由于细胞的增殖和凋亡的调控机制十分复杂,同时maspin的功能及与E2F1的作用关系可能具有肿瘤和组织特异性。因此,将食管癌细胞HKESC-2的maspin表达敲减后,其影响细胞增殖和凋亡的机制尚有待进一步的研究证实。
本实验成功构建了2株maspin表达敲减的稳定感染食道癌上皮细胞株(shMas1/HK2和shMas2/HK2),有助于研究maspin在食管癌的进展和转移过程中的功能,为进一步阐明其作用机制和信号通路以及后续进行细胞和动物研究打下了良好的基础。
[1]Khalkhali-Ellis Z.Maspin:the new frontier[J].Clin Cancer Res,2006,12(24):7279-7283.
[2]Zou Z,Anisowicz A,Hendrix MJ,et al.Maspin,a serpin with tumor-suppressing activity in human mammary epithelial cells[J].Science,1994,263(5146):526-529.
[3]Sheng S.The promise and challenge toward the clinical application of maspin in cancer[J].Front Biosci,2004,9:2733-2745.
[4]Berardi R,Morgese F,Onofri A,et al.Role of maspin in cancer[J].Clin Transl Med,2013,2(1):8.
[5]Wang Y,Sheng S,Zhang J,et al.Elevated maspin expression is associated with better overall survival in esophageal squamous cell carcinoma(ESCC)[J].PloS one,2013,8(5):e63581.
[6]蔡 贞,周 园,熊石龙,等.与食道鳞状上皮细胞癌发生相关的细胞骨架及相关蛋白的筛选鉴定[J].热带医学杂志,2012,12(12):1424-1429.
[7]Cai Z,Zhou Y,Lei T,et al.Mammary serine protease inhibitor inhibits epithelial growth factor-induced epithelial-mesenchymal transition of esophageal carcinoma cells[J].Cancer,2009,115(1):36-48.
[8]Hu YC,Lam KY,Law SY,et al.Establishment,characterization,karyotyping,and comparative genomic hybridization analysis of HKESC-2 and HKESC-3:two newly established human esophageal squamous cell carcinoma cell lines[J].Cancer Genet Cytogenet,2002,135(2):120-127.
[9]陈 伟,曹 罡,董 震,等.人Notch4基因RNAi慢病毒载体的构建及鉴定[J].医学研究生学报,2013,26(2):116-121.
[10]Hannon GJ.RNA interference[J].Nature,2002,418(6894):244-251.
[11]李 丽,王长山,吴玉斌.PAX2小干扰RNA在UUO大鼠体内的筛选与鉴定[J].医学研究生学报,2012,25(7):678-684.
[12]Manjunath N,Wu H,Subramanya S,et al.Lentiviral delivery of short hairpin RNAs[J].Adv Drug Deliv Rev,2009,61(9):732-745.
[13]Picanco-Castro V,de Sousa Russo-Carbolante EM,Tadeu Covas D.Advances in lentiviral vectors:a patent review[J].Recent Pat DNA Gene Seq,2012,6(2):82-90.
[14]Hanahan D,Weinberg RA.The hallmarks of cancer[J].Cell,2000,100(1):57-70.
[15]Kim M,Ju H,Lim B,et al.Maspin genetically and functionally associates with gastric cancer by regulating cell cycle progression[J].Carcinogenesis,2012,33(12):2344-2350.
