蕨麻正丁醇部位对大鼠海马神经元缺氧致钙超载的抑制作用
2014-09-28张永亮李灵芝龚海英李建宇
卜 婧,张永亮,李灵芝,龚海英,李建宇
0 引 言
近年关于钙超载在脑缺血所致脑损伤中的作用越来越受到重视,被认为是诱发神经元变性和死亡的关键因素[1]。研究显示当脑缺血发生时,神经元细胞缺氧、缺糖导致能量不足,破坏了维持细胞内钙离子浓度的平衡机制,使缺氧细胞细胞内游离钙离子浓度([Ca2+]i)大幅度增加,触发钙依赖的下游级联反应,引起一系列病理损伤,造成脑功能缺失[2]。因此,抑制细胞内钙超载成为新药研发的重要靶点。实验室前期研究证实蕨麻正丁醇部位(n-butanol extract of Potentilla anserina L,NP)对因缺氧导致的机体损伤具有保护作用,是其抗缺氧的活性部位[3-4]。研究发现其具有抗大鼠海马神经元缺氧所致的凋亡、坏死作用[5]。本研究通过建立体外培养大鼠海马神经元缺氧所致钙超载模型,模拟急性脑缺血缺氧造成的神经元钙超载,进一步探讨蕨麻正丁醇部位对大鼠海马神经元缺氧所致钙超载的抑制作用。
1 材料与方法
1.1 材料
1.1.1 主要药品及试剂 蕨麻购自青海玉树,由沈阳药科大学中药学院孙启时教授鉴定为蔷薇科委陵菜属植物鹅绒委陵菜的块根。以70%乙醇提取浓缩后以水分散,依次以石油醚、氯仿、正丁醇萃取,减压浓缩,得正丁醇提取部位。尼莫地平注射液购自拜耳医药公司,批号BXC94E3。DMEM-F12培养基(GIBCO,美国);N2营养因子(GIBCO,美国);Fura-2,AM Ester染料(Biotium,美国);Calpain 1 引物(Invitrogen,美国);总RNA提取试剂盒(TaKaRa,日本);兔抗大鼠 calpain1多克隆抗体(Santa Cruz,美国)。
1.1.2 主要仪器 荧光分光光度计RF-5301(岛津,日本);FV500激光共聚焦显微镜(Olympus,日本);5417R高速低温离心机(Eppendorf,德国);PT-200 PCR热循环仪(MJ Research,美国);核酸定量仪(Eppendorf,德国);Bio-Rad 680 酶标仪(Bio-Rad,美国);Western Blot电泳仪及电转仪(Bio-Rad,美国)。
1.1.3 实验动物 健康SD大鼠,雌鼠12只雄鼠6只,由解放军军事医学科学院实验动物中心提供,许可证号:SCK-(军)2002-001。动物饲养于清洁级动物房,室温26℃,湿度60%,雌雄鼠交配后分离饲养,实验选取24 h内新生SD乳鼠进行海马组织分离。
1.2 方法
1.2.1 体外原代大鼠海马神经元培养 取24 h内新生SD乳鼠,分离海马组织,剪碎过200目滤网筛,用DEME-F12培养基、10%胎牛血清、1%链霉素、1%青霉素和5%葡萄糖稀释细胞悬液,以4×105个/mL的密度接种于培养皿,48 h换全液撤去胎牛血清,加1%N2神经营养因子,以后每3~4天换半液,细胞共培养 7 d[6]。
1.2.2 缺氧损伤模型建立及实验分组 将培养7 d的细胞用无糖D-hank's液(预先充入95%N2-5%CO2混合气饱和30 min)替代正常培养基,而后将培养细胞置于95%N2-5%CO2混合气37℃培养箱。实验随机分为正常对照组、缺氧损伤模型组、尼莫地平(2 μmol/L)干预组以及蕨麻正丁醇部位高剂量(0.25 mg/mL)、中剂量(0.062 5 mg/mL)、低剂量(0.0156 mg/mL)。
1.2.3 [Ca2+]i的测定 ①制备样品:将细胞消化,并以1000 r/min的转速离心10 min,离心半径5 cm。弃上清,将细胞悬浮于1 mL Hanks BSA液中,导入Fura-2 AM染料,终浓度为1 μmol/L,37℃震荡孵育30 min。相同条件离心10 min,弃上清,将细胞悬浮于Hanks buffer缓冲液中。②上机检测:检测样品340 nm、380 nm 2处波长值;加入10%Tritonx-100终浓度为0.1%(30 min),检测 340 nm、380 nm 2 处波长值;加入乙二醇-双-(2-氨基乙醚)四乙酸(EGTA,为钙离子螯合剂)终浓度为5 mmol/L(30 min),检测340 nm、380 nm 2处波长值。计算公式:
[Ca2+]i=kd(FD/FS)×(R-Rmin/Rmax-R)
kd为Fura-2与钙反应的解离常数,生理条件下kd为224 nmol/L,Rmax为Fura-2全部与钙结合时饱和的荧光比值,Rmin为Fura-2完全未与钙结合时荧光比值,FD和FS分别代表无钙和钙饱和状态下380 nm处的荧光强度。
1.2.4 RT-PCR检测Calpain1基因表达 按总RNA抽提试剂盒操作提手册取各组细胞的总RNA,取A260/A280值在1.8~2.0的 RNA进行逆转录。使用PCR热循环仪合成cDNA。PCR引物的设计与合成,根据 GenBank给出的基因序列,采取 Primer Premier 5.0软件设计引物,见表1。40 μL反应体系包括:上游引物 0.5 μL,下游引物 0.5 μL,5 × RNA PCR Buffer 10 μL,灭菌三蒸水 28.75 μL,TaKaRa Taq 0.25 μL。扩增条件:94℃ 5 min,预变性后,94℃ 30 s、60℃ 45 s、72 ℃ 1 min,共30 个循环。扩增完成后,取Calpain 1和β-actin PCR产物,电泳40 min(55 V)。以同一样品Calpain 1扩增带的光密度分别与β-actin扩增带的光密度比值,作为 RT-PCR产物的相对含量。

表1 PCR引物序列Table 1 Priner sequences for PCR detection of Calpain 1 and β-actin genes
1.2.5 免疫细胞化学法检测Calpain 1蛋白 将细胞爬片丙酮固定4 h,封闭非特异性抗原,加入兔抗大鼠Calpain 1多克隆抗体(1∶1000、4℃),加入生物素化山羊抗兔二抗工作液(37℃、1h),滴加SP复合物(37℃、1 h),DAB显色液中显色。苏木精复染胞核,脱水、透明、封固。正常对照以PBS代替一抗作为阴性对照,其余步骤相同。显微镜下观察,每张切片随机选择200倍视野,以细胞核或细胞质染成棕黄色为阳性细胞。
1.2.6 Western blot法检测Calpain 1蛋白 按总蛋白提取试剂盒说明书提取蛋白,考马斯亮兰蛋白测定法进行蛋白质的定量。采用SDS-PAGE恒压电泳分离蛋白,浓缩胶为80 V,分离胶为120 V。垂直电转移槽将分离蛋白转移至PVDF膜,恒流90 V电转移2 h。冲洗PVDF膜后将其置于5%BSA封阻液(1 h),加入兔抗大鼠Calpain 1多克隆抗体(1∶1000稀释、4℃),加入生物素化山羊抗兔二抗工作液(37℃、1 h),滴加SP复合物(37℃、1 h),DAB 显色液中显色。以同一样品Calpain 1条带的光密度与β-actin的光密度的比值,作为蛋白的相对含量。
1.3 统计学分析 采用SPSS 11.5软件进行统计学分析。定量实验数据以均值±标准差()表示,多实验组结果采用单因素方差分析,组间两两比较采用LSD-t检验,以P≤0.05为差异有统计学意义。
2 结 果
2.1 神经细胞[Ca2+]i检测 荧光分光光度计检测各组细胞[Ca2+]i,实验结果显示缺氧损伤模型组较正常对照组细胞内[Ca2+]i显著增加(P<0.01);尼莫地平组及NP高、中、低剂量干预组与缺氧损伤模型组相比较神经元[Ca2+]i显著降低(P<0.05)。见图1。
2.2 免疫荧光双重染色观察神经元细胞骨架 400倍激光共聚焦显微镜观察PI标记的细胞核呈红色荧光,MAP2标记的细胞骨架蛋白呈绿色荧光,两者共定位显示黄色荧光。正常对照组可见绿色荧光均匀分布于细胞质、轴突和树突内,荧光表达量强,神经元形态呈现清晰,细胞核红染形态完好;模型组绿色荧光散在分布于细胞质、轴突及树突中,神经元突起形态不能良好呈现,与正常组相比轴突、树突内荧光强度明显减弱;尼莫地平组及高剂量NP干预组神经元突起形态良好呈现,与模型组相比绿色荧光强度明显增强;中剂量NP干预组大部分神经元轴突及树突中可见绿色荧光,呈现部分神经元突起结构,与模型组相比绿色荧光强度增强;低剂量 NP干预组仅在少量神经元突起中可见绿色荧光,但与模型组相比其绿色荧光强度有所增强。见图2。

图1 各组神经细胞中细胞内游离钙离子浓度比较Figure 1 Intracellular concentrations of[Ca2+]iin different groups

图2 各组细胞中MAP2、PI免疫荧光双重染色(×400)Figure 2 Stained with MAP2 and PI in different groups by LSCM(×400)
2.3 RT-PCR检测Calpain 1基因表达 PCR结果显示引物特异性良好,基因扩增单一。缺氧损伤模型组较正常对照组神经元Calpain 1 mRNA的表达量升高(P<0.05);尼莫地平组及NP高、中、低剂量干预组与模型组相比较神经元Calpain 1 mRNA的表达量均降低(P<0.05)。见图3。
2.4 免疫细胞化学法检测Calpain 1蛋白表达200倍视野可见Calpain 1蛋白主要在细胞质表达,阳性反应产物均呈棕黄色颗粒。正常对照组细胞免疫组化染色玻片中,Calpain 1蛋白免疫反应阳性表达较弱,而缺氧模型组细胞Calpain 1蛋白表达增强。与正常对照组比较,模型组Calpain 1免疫反应阳性细胞率升高(P<0.05);尼莫地平组及NP高、中、低剂量干预组与模型组比较,免疫反应阳性细胞率积均有显著性差异(P<0.05)。见图4、图5。
2.5 Western blot法检测Calpain 1蛋白表达 缺氧模型组神经元Calpain 1蛋白的表达量较正常对照组升高(P<0.05);尼莫地平组及NP高、中、低剂量干预组与模型组相比较神经元Calpain 1蛋白的表达量均降低(P<0.05)。见图6。

图3 NP对缺氧神经细胞Calpain 1基因表达的抑制作用(×400)Figure 3 Inhibitory effects of NP on Calpain 1 mRNA of hypoxia neurons(×400)

图4 各组细胞中免疫细胞化学法检测Calpain 1蛋白表达(×400)Figure 4 Expression of Calpain 1 protein from each groups detected by immunocytochemisty(×400)
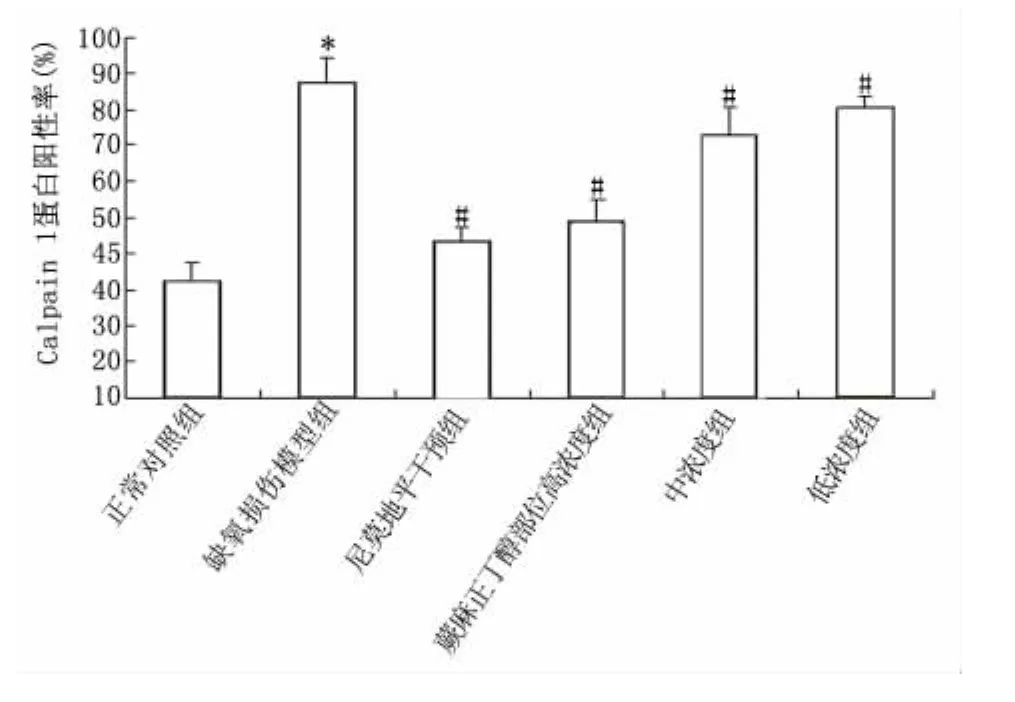
图5 各组神经细胞中Calpain 1蛋白阳性率比较Figure 5 Comparison of positive rates of Calpain 1 protein in neurocytes from each group

图6 NP对缺氧神经细胞Calpain 1蛋白表达的抑制作用Figure 6 Inhibitory effects of NP on Calpain 1 protein ofhypoxia neurons
3 讨 论
钙超载是指各种原因引起的钙平衡系统功能失调,钙分布紊乱,导致细胞[Ca2+]i异常升高[7]。当细胞发生钙超载时,可引起线粒体内氧化磷酸化过程障碍、线粒体膜电位降低、三磷酸腺苷生成障碍[8],以及细胞质内磷脂酶、蛋白酶等激活[9],导致并促进细胞的不可逆性损伤。有研究发现,当神经元细胞膜上电压依赖性钙离子通道持续开放,将诱发细胞[Ca2+]i的急剧增加导致神经细胞死亡[10]。Sibarov等[11]研究显示,神经细胞膜上钠钙泵持续开放,将使细胞内大量钙离子转移到细胞外,使细胞[Ca2+]i明显减少,抑制钙超载和神经细胞的凋亡。本研究结果显示,当神经元缺氧3 h时,细胞[Ca2+]i显著高于正常细胞[Ca2+]i,而各剂量 NP均显著降低了缺氧神经元[Ca2+]i,且[Ca2+]i随 NP剂量的增加神经元而减少,说明缺氧诱发了[Ca2+]i的升高。NP可抑制缺氧所致神经元[Ca2+]i的增加,且具有剂量依赖性。
Calpain 1是钙依赖性的蛋白酶,属于半胱氨酸蛋白水解酶家族成员[12]。钙超载时,Ca2+与其结合构象发生变化,Calpain 1被激活[13],其通过特异性蛋白水解酶作用水解细胞骨架,微丝分解、微管解聚,严重影响轴浆正常运输,导致神经细胞死亡[14]。微管相关蛋白 2(microtuble-associated protein2,MAP2)结合于微管的表面,使微管蛋白亚基聚合,并中和微管表面相互排斥的负电荷[15],增加微管的稳定性及聚合能力,为Calpain 1特异性底物,且只存在于神经元[16]。MAP2被作为特异性神经元损伤程度的评价指标之一。结果显示,缺氧3 h时细胞内Calpain 1 mRNA及其蛋白水平显著高于正常组细胞内的含量,且激光共聚焦显微镜观察发现MAP2标记的蛋白荧光强度减弱,神经元突起形态不能良好呈现;给予NP高、中剂量干预组Calpain 1 mRNA及其蛋白均显著降低缺氧细胞内的含量,且与缺氧组相比荧光强度增强,大部分神经元突起可良好呈现。说明缺氧3 h时激活了钙离子依赖的下游蛋白激酶Calpain 1基因和蛋白水平的表达,并且破坏了细胞骨架。而NP高、中剂量组显著抑制了钙离子依赖的下游蛋白激酶Calpain 1基因和蛋白水平的表达,有效保护了细胞骨架。因此,蕨麻正丁醇部位可通过抑制缺氧所致细胞钙超载而发挥神经元保护作用[17]。
[1]Zanelli SA,Trimmer PA,Solenski NJ.Nitric oxide impairs mito-chondrial movement in cortical neurons during hypoxia[J].Neurochem,2006,97(3):724-736.
[2]Ovbiagele B,Kidwell CS,Starkman S,et al.Neuroprotective agents for the treatment of acute ischemic stroke[J].Curr Neurol Neurosci Rep,2003,3(1):9-20.
[3]李灵芝,张 丽,龚海英,等.蕨麻醇提物抗缺氧及抗氧化机制研究[J].中国食品卫生杂志,2005,17(4):306-309.
[4]李建宇,李 怡,龚海英,等.蕨麻正丁醇提取部位对小鼠急性心肌缺血损伤的保护作用[J].中西医结合学报,2009,1(7):48-52.
[5]Qin XJ,Li LZ,Lv Q,et al.Neuroprotection of n-Butanol Extract from Roots of Potentilla anserina on Hypoxic Injury in Primary Hippocampal Neurons[J].Chinese Herbal Medicines,2012,4(3):195-200.
[6]Isaev NK,Stelmashook EV,Dirnagl U,et al.Neuroprotective effects of the antifungal drug clotrimazole[J].Neuroscience,2002,113(1):47-53.
[7]Avila ME,Sepúlveda FJ,Burgos CF,et al.Canonical Wnt3a modulates intracellular calcium and enhances excitatory neurotransmission in hippocampal neurons[J].J Biol Chem,2010,285(24):18939-18947.
[8]Eigel BN,Gursahani H,Hadley RW.ROS are required for rapid reactivation of Na+/Ca2+exchanger in hypoxic reoxygenated guinea pig ventricular myocyte[J].Physiol Heart Circ Physiol,2004,286(3):955-963.
[9]Bano D,Nicotera P.Ca2+signals and neuronal death in brain ischemia[J].Stroke,2007,38(2 Suppl):674-676.
[10]Zhao YL,Xiang Q,Shi QY,et al.GABAergic excitotoxicity injury of the immature hippocampal pyramidal neurons'exposure to isoflurane[J].Anesth Analg,2011,113(5):1152-1160.
[11]Sibarov DA,Bolshakov AE,Abushik PA,et al.Na+,K+-ATPase Functionally Interacts with the Plasma Membrane Na+,Ca2+Exchanger to Prevent Ca2+Overload and Neuronal Apoptosis in Excitotoxic Stress[J].J Pharmacol Exp Ther,2012,343(3):596-607.
[12]Bhatt A,Kaverina I,Otey C,et al.Regulation of focal complex composition and disassembly by the calcium-dependent protease calpain[J].J Cell Sci,2002,115(Pt17):3415-3425.
[13]Hiroyuki S,Shoji H,Yasuko O.Impact of genetic insights into calpain biology[J].J Biochem,2011,150(1):23-37.
[14]Liu J,Liu MC,Wang KK.Calpain in the CNS:From Synaptic Function to Neurotoxicity[J].Sci Signal,2008,1(14):re1.
[15]Heald R,Nogales E.Microtubule dynamics[J].Cell Sci,2002,115(Pt1):3-4.
[16]Hokkanen S,Feldmann HM,Ding H,et al.Lack of Pur-alpha alters postnatal brain development and causes megalencephaly[J].Hum Mol Genet,2012,21(3):473-484.
[17]徐祖才,王学峰,雷显泽,等.丙戊酸钠对大鼠海马神经元癫痫样放电后细胞外信号调节激酶磷酸化水平的影响[J].医学研究生学报,2012,25(11):1124-1127.
