活体成像技术监测肿瘤生长动态的研究
2014-09-28苏云术徐利军周鸿敏AlfredOmo
苏云术,徐利军,周鸿敏,Alfred Omo,魏 翔
0 引 言
生长动态的监测是肿瘤学重要的研究内容之一,现有的各种肿瘤生长动态的监测方法存在诸多缺陷。活体成像技术(in vivo imaging technique,IVIT)是近年来发展的一种追踪活性细胞的新技术,本研究以此监测标记肿瘤细胞的生长动态,取得了良好的效果,现报道如下。
1 材料与方法
1.1 实验材料 清洁级 Balb/C雄性小鼠,体重15~20 g,5~7周龄,常规饲养,由同济医院动物中心提供。实验动物许可证号:42000500001288。RPMI1640培养基为Hyclone公司产品;小鼠B16黑色素瘤细胞株(B16-F10-luc-G5,标记有萤火虫荧光素酶luc基因)、萤火虫荧光素钾盐(D-Luciferin,Firefly)和活体成像系统(in vivo imaging system,IVIS)Lumina为美国Xenogen公司产品。
1.2 方法
1.2.1 细胞培养 小鼠黑色素瘤细胞B16-F10-luc-G5复苏后,以含10%胎牛血清、青霉素和链霉素(分别稀释到50 000 U/mL后再混合)的RPMI1640培养基,37℃,5%CO2饱和湿度环境常规培养、传代。
1.2.2 小鼠皮下肿瘤模型建立 Babl/C小鼠18只,在其右侧背部近大腿处以1 mL注射器注射1×106/mL B16-F10-luc-G5细胞100 μL(细胞数1×105个)于皮下,建立皮下肿瘤模型。
1.2.3 常规方法观察肿瘤的生长动态 肿瘤接种后,每天触摸及目测接种部位,待肿块可触及时记为肿瘤出现时间。肿瘤生长速度以其逐日测定的体积计算:每次取3只小鼠,用游标千分尺记录肿瘤最长径(L)和垂直方向最大横径(W),最终计算肿瘤体积的均值,肿瘤体积(V)计算公式:
V=LW2/2
1.2.4 IVIS 监测肿瘤的生长动态 于第 0、3、5、7、9、14天以IVIS检测移植瘤的生物发光,每次取3只小鼠,检测前每只小鼠全身麻醉(系统自带吸入麻醉机吸入麻醉),按10 μL/g腹腔注入 15 mg/mL D-Luciferin后120 s显像。曝光条件:10 bin、视野15、60 s。最终获得肿瘤生物发光的均值。
1.2.5 移植瘤病理学检查 第3、5、7、9、14 天 IVIS检测移植瘤的生物发光后,3只小鼠处死,取肿瘤组织观察及按常规制成石蜡切片,光学显微镜观察。
1.3 统计学分析 采用SPSS 12.0软件进行数据分析。计量资料以均数±标准差()表示。组间均数的比较采用单因素方差分析,自身前后比较采用配对t检验,一元线性回归方程确定变量之间回归关系。以P≤0.05为差异有统计学意义。
2 结 果
2.1 移植瘤病理学检查 小鼠背部接种的局部皮肤未见变化。局部隆起出现后,解剖见黑色整块瘤体组织周围包裹着一层菲薄、光亮的致密包膜,和正常组织间界限明显,整块瘤体由数个小瘤体组成,每个小瘤体均有独立包膜,整个肿瘤出现复层包膜,符合B16黑色素瘤典型的生长特点。肿瘤生长后期该特征更为明显,见图1。组织病理切片见肿瘤细胞周围淋巴细胞浸润,见图2。

图1 B16F10移植瘤局部表现Figure 1 Local appearance of B16F10 inoculated tumor

图2 B16F10移植瘤病理切片(HE ×400)Figure 2 Pathohistology of B16F10 inoculated tumor(HE×400)

图3 小鼠B16F10移植瘤第7天的目测情况和生物发光Figure 3 Anatomical size and bioluminescence of the same inoculated tumor in Day 7
2.2 常规方法观察肿瘤的生长动态 B16-F10-G5在Babl/C小鼠的成瘤率均为100%;平均肿瘤出现时间为(6.1±0.8)d。接种后3 d内,种植瘤体积无法目测,直到第5天方可目测,第7天肿瘤体积约为4 mm ×2 mm ×1 mm,见图1a。第5、7、9、14天肿瘤大小分别为[(2.86E+00)±1.21]、[(4.87E+00)±1.66]、[(9.27E+01)±6.31]、[(2.60E+02)±7.88]mm3。
2.3 IVIS监测肿瘤模型的生长动态监测结果 在第0天以IVIS即可观察到肿瘤生物发光(此时肉眼无法观察);第0、3、5、7、9、14 天肿瘤平均实测光子数为[(6.35E+05)± 7655]、[(1.12E+05)±1820]、[(1.62E+05)± 2090]、[(2.40E+05)±3515]、[(1.18E+06)±11 530]、[(2.23E+06)±17934]photon/(cm2·ser·s)。第 3 天肿瘤生物发光(实测平均光子数)少于第0天(P<0.05)。随着时间推移,后期发光值增加明显;以IVIS监测结果绘制肿瘤生长曲线,曲线呈现类似倒置抛物线形特点。移植瘤生物发光与解剖大小的对应关系以第7天为例。见图3。
2.4 移植瘤的生物发光与体积关系分析 第5天后移植瘤平均实测光子数与体积之间存在线性回归关系,公式与相关系数分别为:Y=7 939.3X+237 606,R2=0.97。见图4。
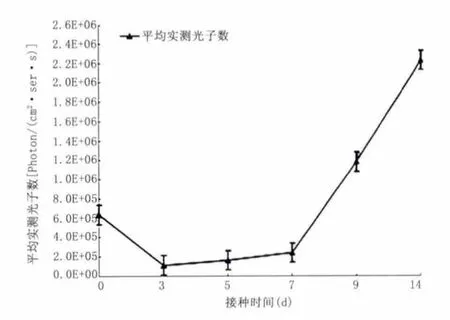
图4 以生物发光检测结果绘制移植瘤生长曲线Figure 4 Curve of tumor growth continuously monitored by IVIS
3 讨 论
肿瘤学的研究中,对于肿瘤发生、转移和治疗效果的探讨常涉及到肿瘤生长动态的监测。现有肿瘤模型生长动态的监测方法较少,常见有目测(包括解剖)和影像学检查(如动物CT),但这些方法共同的缺点是检测的敏感性和特异性较差,故对此需要寻找新的方法[1-2]。
IVIT是近年来迅速发展的一种示踪技术[3],其原理是先将光学报告基因,如荧光素酶(Luciferase)等标记到待研究对象(如细胞)染色体中,光学报告基因产物,如荧光素酶等与发光底物作用产生生物发光或激发产生荧光,通过检测生物发光或激发荧光即可追踪该对象。在光学报告基因的选择上,对于量化实验,尤其在细胞的定量示踪方面,一般选择荧光素酶而非绿色荧光蛋白(green fluorescent protein,GFP)基因标记,因GFP为激发荧光而无法定量,而荧光素酶催化的生物发光与标记对象呈线性相关且可量化研究。荧光素酶是自然界中能够产生生物荧光的酶的统称,见于发光真菌、海星、节虫、鱼和甲虫。研究中最常标记用的荧光素酶基因有3种,按照来源及特性分别为FLUC基因,来源于北美萤火虫,大小550aa,发光波长562 nm,发光底物为荧光素,发光依赖于三磷酸腺苷(adejosine triphosphate,ATP);RLUC基因,来源于海肾,大小311aa,发光波长480 nm,底物腔肠素,发光不依赖于ATP;GLUC基因,来源于古西亚虫属,大小185aa,发光波长480 nm,发光底物腔肠素,发光不依赖于ATP。其中,FLUC常被选作报告基因,其优势包括:①内源性低,哺乳动物无内源性表达,外源性荧光素酶基因标记方法简单易行,且可在细胞中稳定表达[4-6],对宿主细胞生物特征影响小;②荧光素酶检测不受细胞内其他物质影响;③利用发光检测,检测方便;④灵敏度高,仅需10-20mol荧光素酶分子;⑤检测范围广,可大于7个数量级。IVIS即利用IVIT,将非常灵敏的检测元件组合成整套仪器,从而提供了一个高灵敏性的IVIT示踪平台。IVIT及IVIS已广泛应用于肿瘤学、病毒学、干细胞、移植免疫、蛋白质和基因等诸多前沿研究领域[7-10]。本研究的前期工作成功进行了IVIS追踪细胞的定量研究[11-12]。
但迄今为止,利用IVIT进行肿瘤生长动态的监测鲜有报道[12]。针对以上问题,本研究试图探讨该可行性。研究使用了B16-F10-luc-G5细胞系(B16为黑色素瘤、Fx为变异系数、luc为荧光素酶基因、G5为加压传代编号),即标记有荧光素酶基因(FLUC)的小鼠黑色素瘤细胞。该FLUC基因在细胞中稳定表达,编码产物荧光素酶数目恒定[6]。故理论上利用IVIT捕捉生物发光不但可追踪该FLUC基因标记的肿瘤细胞生长动态,还有可以通过光子数推算细胞的数目(量化研究)。结合前期研究,本研究验证了此假设。本研究发现,IVIT连续监测肿瘤的生长状态具有可行性,与其他方法相比,其优点在于:①高度灵敏。在肉眼无法观察到的肿瘤生长早期,甚至刚植入肿瘤细胞时,IVIT即可监测肿瘤的生长状态。而此时肿块太小,尚无法用其他方法测量。②量化的结果更具可比性。IVIT测定的结果为光子数,计量单位大于7个数量级,比包括影像学测定肿瘤体积的方法更为方便。且光子数的检测结果不受肿瘤外形的影响,而影像学(如CT等)的检测结果受此影响,一旦肿瘤不规则则量化困难。③连续动态。IVIT可在不处死动物的情况下直接观察肿瘤的生长和转移,使实验具有较好的连续性,且大大减小了实验所需的动物数、创伤小。④IVIS无放射性,对被监测的细胞、动物及操作者无害。本研究还发现以IVIT检测结果绘制的肿瘤生长曲线,曲线呈倒置抛物线形,这种变化趋势反映了移植瘤在宿主体内的生长特点。分析产生此曲线可能的原因在于B16-F10细胞为C57BL/6小鼠来源,接种到Babl/C小鼠相当于异种移植,接种早期被宿主淋巴细胞所杀伤(病理图片检查证实淋巴细胞在肿瘤细胞周围浸润),但B16-F10有高变异性,很快变异而被宿主耐受而存活、增殖。因此,生长曲线呈倒置抛物线形提示接种早期肿瘤细胞因杀伤或实验操作而较多死亡。后期生长加速,这种变化其他生长动态方法难以观察到。另外,B16-F10细胞被FLUC基因标记后,其生物特征未见明显改变,仍呈现典型的黑色素瘤生长特征。
总之,本研究的结论认为IVIS可连续、灵敏、精确地监测体内外肿瘤生长动态,结果可靠,且可行细胞定量分析,与其他测定细胞活性功能的方法相比存在明显的优势,值得推荐。
[1]杨慎敏,温端改,侯建全,等.原位膀胱癌动物模型的建立及应用[J].癌症,2007,26(4):341-345.
[2]杜 睿,薛 玉.超声造影及弹性成像技术在乳腺肿瘤诊断的现状与进展[J].医学研究生学报,2013,26(4):435-437.
[3]Massoud TF,Gambhir SS.Molecular imaging in living subjects:seeing fundamental biological processes in a new light[J].Genes Dev,2003,17(5):545-580.
[4]Hardy J,Francis KP,Deboer M,et al.Extracellular replication of Listeria monocytogenes in the murine gall bladder[J].Science,2004,303(5659):851-853.
[5]Greer LF 3rd,Szalay AA.Imaging of light emission from the expression of luciferases in living cells and organisms:a review[J].Luminescence,2002,17(1):43-74.
[6]Ow DW,De Wet JR,Helinski DR,et al.Transient and stable expression of the firefly luciferase gene in plant cells and transgenic plants[J].Science,1986,234(4778):856-859.
[7]Han Z,Fu A,Wang H,et al.Noninvasive assessment of Cancer response to therapy[J].Nat Med,2008,14(3):343-349.
[8]Dentin R,Liu Y,Koo SH,et al.Insulin modulates gluconeogenesis by inhibition of the coactivator TORC2[J].Nature,2007,449(7160):366-369.
[9]Minn AJ,Gupta GP,Siegel PM,et al.Genes that mediate breast Cancer metastasis to lung[J].Nature,2005,436(7050):518-524.
[10]Shachaf CM,Kopelman AM,Arvanitis C,et al.MYC inactivation uncovers pluripotent differentiation and tumour dormancy in hepatocellular Cancer[J].Nature,2004,431(7012):1112-1117.
[11]徐利军,周鸿敏,陈忠华,等.B16F10黑色素瘤小鼠双阴性T细胞变化及肿瘤生长关系的研究[J].中华小儿外科杂志,2009,30(10):710-713.
[12]Zheng J,Xu L,Zhou H,et al.Quantitative analysis of cell tracing by in vivo imaging system[J].J Huazhong Univ Sci Technolog Med Sci,2010,30(4):541-545.
