锯齿新米虾对Cu2+和毒死蜱毒性响应研究
2014-09-27李典宝王丽卿郝瑞娟
李典宝,张 玮,2,王丽卿,,郝瑞娟
1. 上海海洋大学水产与生命学院, 上海 2013062. 上海水生环境工程有限公司, 上海 200090
锯齿新米虾对Cu2+和毒死蜱毒性响应研究
李典宝1,张 玮1,2,王丽卿1,*,郝瑞娟1
1. 上海海洋大学水产与生命学院, 上海 2013062. 上海水生环境工程有限公司, 上海 200090
为研究水生生物对水体中重金属和有机磷农药毒性的响应,研究了锯齿新米虾暴露在Cu2+、毒死蜱单一溶液和毒性1:1混合溶液下的响应状况,同时采用相加指数法对混合毒性进行了评价。单一毒性试验结果表明:毒死蜱对锯齿新米虾的毒性显著高于Cu2+(p<0.01); Cu2+对锯齿新米虾未觉察反应浓度(NOEC)和最低觉察反应浓度(LOEC)分别为1.78 mg·L-1、2.40 mg·L-1,24、48、72和96 h的LC50分别为6.41、4.75、4.20和3.44 mg·L-1;毒死蜱对锯齿新米虾NOEC和LOEC分别为0.04 μg·L-1、0.07 μg·L-1,24、48、72和96 h的LC50分别为0.35、0.17、0.11和0.06 μg·L-1;参考鱼类毒性分级标准,Cu2+对锯齿新米虾为高毒,而毒死蜱为剧毒。混合毒性试验结果表明:采用Cu2+和毒死蜱毒性1:1进行试验时,暴露时间为24、48、72和96 h的相加指数(AI)分别为0.02、0.45、1.86和2.23,即混合毒性为协同作用。通过研究锯齿新米虾对Cu2+、毒死蜱单一和联合毒性的响应,可为水环境污染与防治、物种多样性保护提供科学依据。
锯齿新米虾;Cu2+;毒死蜱;毒性响应
随着我国工农业化进程的加快,众多湖泊、水库、河流均受到不同程度的污染[1-3]。其中,重金属和农药在污染物中占有较高的比例,它们随雨水和工农业排水流入河湖,进而污染水体,危害水生生物,最终通过饮用水和食物链影响到人类健康[4,5]。铜是水体中一种典型的污染物,其具有来源广、残毒时间长、有蓄积性及生物放大作用等特点[6,7]。目前有关铜对水生生物的毒性、组织病变、富集残留及其致毒机理等方面均有一定的研究,而且重金属铜在与其他一些污染物共存时,其毒性效果会发生不同程度的改变[8,9]。毒死蜱(chlorpyrifos,C9H11Cl3NO3PS)是一种有机磷杀虫剂,具有高效、广谱的特点,目前广泛应用于农作物虫害防治方面。有研究发现,毒死蜱进入水体会对水生生物有不同程度的毒害作用,并且易残留,降解缓慢,对水生态系统和食物链的稳定造成威胁[10,11]。
在实际水环境中,污染物往往都是以多种同时存在的,而且有些污染物之间会相互影响,甚至是污染物在生物体内彼此影响,因而水生生物所暴露的水环境是一种具有多种、复杂的污染物共存的体系[12]。用重金属和农药的单一毒性试验结果, 往往不能客观地反映多种污染物共存时对水生生物的危害程度, 因而研究各污染物的联合毒性效应很有必要。
锯齿新米虾(Neocaridinadenticulate)隶属甲壳动物匙指虾科新米虾属,是一类暖水性小型虾类,主要分布于淡水中,为中国的常见种。它们常栖息于溪流、沼泽、沟渠、河流、水田等水生植物繁茂,水质较清洁的浅水区域。在我国,锯齿新米虾主要分布在太湖到上海间的苏南地区,其生殖活力强,繁殖较快,同时处于水域生态系统食物链的中间环节,在水环境监测与评价中具有较大的潜力[13]。本研究以Cu2+和毒死蜱为受试污染物,以锯齿新米虾为试验生物,研究锯齿新米虾对这两种污染物单一和联合方式存在下的响应,以此来判断锯齿新米虾在水体具有这两种污染物时所受到的危害作用,为水环境污染与防治、物种多样性保护提供科学依据。
1 材料与方法(Materials and methods)
1.1 试验生物来源与驯养
试验所采用的锯齿新米虾来自于淀山湖周边水草区。选取生长状况良好,体长(1.5~1.8)cm,体重(0.07~0.10) g·只-1的锯齿新米虾置于长、宽、高为60×40×45 cm玻璃水族缸中,每天以普通虾粮喂食1次,温度保持在(23±1)℃左右,用水为曝气48 h以上自来水,每天换水一次,换水量为2/3,试验前24 h停止喂食,驯化两周,驯化期间锯齿新米虾未出现死亡,符合OECD试验法准则[14]。驯化后锯齿新米虾的选用标准为:行动活泼、外观正常、个体均匀的个体。
1.2 受试污染物及母液配制
硫酸铜(CuSO4·5H2O)、二甲基亚砜、吐温80购于国药集团化学试剂有限公司,均为分析纯。毒死蜱(chlorpyrifos, C9H11Cl3NO3PS)产自于浙江威尔达化工有限公司,有效成分含量为480 g·L-1的乳油。将一定量的毒死蜱用助溶剂二甲基亚砜和乳化剂吐温80配置成4.8 g·L-1母液备用,其中助溶剂和乳化剂的体积分数不超过100 μL·L-1[15]。把一定量的硫酸铜溶于少量蒸馏水,按离子浓度配置成5.0 g·L-1的母液备用。
1.3 单一毒性试验设计
试验采用半静止式试验方法,试验周期为96 h[16,17]。试验用水为曝气48 h以上的自来水,pH为7.2~7.7,硬度在205.95 mg·L-1(以CaCO3计)左右,水温(24±1)℃,溶解氧(DO)5.80 mg·L-1以上。具体试验采用水浴法,即用6个长、宽、高为60×40×45 cm玻璃水族缸,缸中放置加热棒与温度计控制恒温,同时定期以曝气装置使缸内水温均匀;每个水族缸上放有日光灯,试验期间保持12 h光照12 h黑暗;每个缸中放置8个2 000 mL烧杯。
先进行预试验,通过不断缩小浓度间距来进行浓度范围的确定,即确定出锯齿新米虾96 h内在Cu2+和毒死蜱溶液中全活最高浓度和全致死的最低浓度范围,然后在此范围内采用等对数间距法设置受试污染物浓度进行正式试验。试验共设6个浓度梯度,每个浓度组设3个平行,Cu2+浓度组ρ(Cu2+)为1.78、2.40、3.21、4.33、5.60和7.54 mg·L-1;毒死蜱浓度组ρ(毒死蜱)为0.04、0.07、0.13、0.24、0.44和0.80 μg·L-1,同时设置曝气自来水空白对照以及溶剂(助溶剂+乳化剂)最高浓度对照。每个烧杯中加入试验药液2 000 mL,投入经过驯养并做过筛选的锯齿新米虾10只。试验期间不投饵,定期监测pH,溶氧等,防止溶氧不足以及毒死蜱挥发影响试验,24 h更换一次试验液。定期观察锯齿新米虾的活动情况、中毒症状和死亡等效应,每24 h记录1次死亡情况,及时挑出死亡个体。最后应用概率单位法[18]计算得到暴露24 h、48 h、72 h和96 h 的半致死浓度(LC50)值及其95%置信区间[19]。
1.4 联合毒性试验设计
采用Cu2+和毒死蜱单一毒性试验所得96 h的LC50值为一个毒性单位(毒性单位即受试物浓度与该受试物的LC50的比值),参照毒性较大的受试污染物,进行毒性1:1的混合比例,以等对数间距设计浓度组ρ(Cu2+)+ρ(毒死蜱)分别为0.63 mg·L-1+0.01 μg·L-1、1.25 mg·L-1+0.02 μg·L-1、1.88 mg·L-1+0.03 μg·L-1、2.50 mg·L-1+0.04 μg·L-1、3.13 mg·L-1+0.05 μg·L-1和4.38 mg·L-1+0.07 μg·L-1。每个浓度组设3个平行,同时设置曝气自来水空白对照以及溶剂(助溶剂+乳化剂)最高浓度对照。联合毒性试验中各化合物的LC50值的计算方法同1.3。
1.5 联合毒性评价
本研究采用Marking水生毒理联合效应相加指数法[20]对Cu2+和毒死蜱的联合毒性效应进行评价。生物毒性相加作用之和S可用式(1)求出:
S= (Am/A1) + (Bm/B1)(1)
式中:A1、B1为单一毒性物质的LC50值;Am、Bm为混合物毒性的LC50值;S为生物毒性相加作用之和。当S≤1时,相加指数AI= (1 /S)-1.0; 当S>1时,AI=-S+1.0。最后用AI值评价毒物的联合毒性效应,AI>0为协同作用;AI<0 为拮抗作用;AI=0为相加作用。
1.6 数据统计分析
对试验所得数据通过Microsoft Office Excel 2013分析,试验数据以3个平行组的平均值±标准差表示;采用概率单位法,用Origin9.0对数据进行回归分析得到半致死浓度LC50值;利用IBM SPSS Statisticts20.0对对照组和试验组进行方差分析,求出未觉察反应浓度(NOEC)及最低觉察反应浓度(LOEC)。
2 结果与讨论(Results and discussion)
2.1 锯齿新米虾中毒症状
Cu2+试验期间,对照组中锯齿新米虾未出现死亡。在不同Cu2+质量浓度中锯齿新米虾中毒症状有所差异。试验开始后,Cu2+高浓组锯齿新米虾反应激烈,异常活跃。表现为躁动不安、上下窜游,绕着烧杯壁在水体呈圆形轨迹剧烈游动等现象,并且颚足与螯足运动频率加快。随着时间的延长,其活力明显减弱,身体失去平衡,侧身运动,颚足和螯足运动速率减慢至基本不动。低浓度组与对照组无明显差异,除刚放入时运动一段时间后基本静伏与水底,偶尔受到惊吓会快速游开。锯齿新米虾在死亡前,体色先变白,然后变红,身体逐渐弓曲,最终死于杯底。
毒死蜱试验期间,自来水空白组和最高溶剂(助溶剂+乳化剂)组中锯齿新米虾均未出现死亡。和Cu2+一样,试验开始时,高浓度组试验虾首先出现异常反应, 其游泳的平衡能力明显受到影响, 有时在水中侧翻、绕杯壁也呈圆形轨迹运动,且主要为逆时针方向。有时上下窜动,颚足和螯足运动加快,并且运动剧烈程度高于Cu2+试验。12 h后,各浓度组中锯齿新米虾均较安静,自来水空白对照组偶尔会有缓慢游动现象。虾体死亡之前,身体向下弯曲并且侧翻躺卧缸底,体色变白,然后呈红色。
试验期间,若未及时捞出死虾,发现锯齿新米虾人保持着在自然条件下的残食死去的同类这一行为特征。同时观察到两种污染物中一些浓度组锯齿新米虾有蜕壳现象发生,而且最先死亡的通常是将要蜕壳、正在蜕壳或刚完成蜕壳的个体,对照组也有观察到蜕壳现象,但没有虾体死亡,说明Cu2+和毒死蜱对蜕壳期间的锯齿新米虾有更强的毒性作用。这一结果和董学兴[21]等研究的重金属对克氏原螯虾的结果一致。
2.2 锯齿新米虾对Cu2+和毒死蜱单一毒性的响应
由图1可见, 锯齿新米虾的死亡率随时间的延长和Cu2+浓度的增加而逐渐升高,表明重金属Cu2+的毒性效应具有蓄积性特征。Cu2+试验浓度为1.78 mg·L-1时,24 h未见死亡,96 h时死亡率仅有(16.7±5.8)%;当试验浓度达到2.40 mg·L-1时,暴露24 h时就开始出现致死效应;当浓度达到7.54 mg·L-1时,锯齿新米虾在24 h时死亡率就达到(50.0±10)%,在暴露96 h时锯齿新米虾全部死亡。在Cu2+不同质量浓度对数与锯齿新米虾死亡概率单位的回归方程中,相关系数R2均大于0.940,且p<0.01,表现出较好的正相关性。随着试验时间的延长,95%置信区间范围随时间的延长基本呈逐渐变小的趋势,说明Cu2+的致毒能力随试验时间的延长而明显增强(表1),这与张彩明[22]等研究重金属对脊尾白虾幼虾产生的毒性效果一致。
由图2可知,相对于Cu2+,毒死蜱对锯齿新米虾表现出较高的毒性作用。随着暴露时间和浓度的增加,锯齿新米虾的死亡率也是逐渐升高的。毒死蜱试验浓度为0.04 μg·L-1时,48 h出现死亡,在96 h时锯齿新米虾死亡率达(36.7±5.8)%;浓度为0.07 μg·L-1,24 h时死亡率就达到(33.3±0.0)%;浓度达到0.80 μg·L-1,72 h时锯齿新米虾全部死亡。毒死蜱浓度对数和死亡率概率单位的回归中,相关系数R2均大于0.930,且p<0.01,正相关性极好(表1)。
由以上试验结果看出,毒死蜱对锯齿新米虾的毒性作用显著高于Cu2+(p<0.01),二者的毒性差异可能是因为化学结构的不同,产生毒性作用的机制不同产生的。Cu2+可以对组织、生理生化等方面产生毒性。锯齿新米虾暴露在一定Cu2+浓度中,Cu2+直接被鳃吸收,从而鳃成了Cu2+富集的首要位[23];鳃受到损伤,即Cu2+的进入使钠离子和氯离子的主动吸被扰乱,鳃的渗透性和氧化应激增加[24]; 也会损伤肝脏,降低肝脏中一些酶的活性,同时呈现病理损伤[25];神经系统也会受到一定损伤[26]使中毒锯齿新米虾失去平衡。毒死蜱是有机磷农药,对鱼类等水生动物毒性较高,主要作用机理是抑制乙酰胆碱酯酶(使神经末梢的乙酰胆碱酯酶磷酸化而失去活性),阻止神经传导,从而使受试水生生物快速死亡[27]。
对浓度组和对照组死亡数作方差分析得出Cu2+和毒死蜱的NOEC、LOEC分别为1.78 mg·L-1、2.40 mg·L-1,0.04 μg·L-1、0.07 μg·L-1。对试验所得数据应用概率单位求得Cu2+和毒死蜱在24、48、72和96 h的LC50分别为6.41、4.75、4.20和3.44 mg·L-1,0.35、0.17、0.11和0.06 μg·L-1。金显文[28]等研究了Cu2+对锯齿米虾的毒性效应得出锯齿米虾48 h在铜离子溶液中的半致死浓度为2.333 mg·L-1,而本文Cu2+对锯齿新米虾48h的LC50为4.75 mg·L-1,这主要可能是因为环境的理化因素(如温度、溶解氧、盐度、pH、水体硬度等)、受试生物的种类、规格、生长条件等多种因素不同,以及与水生生物个体的健康状况和发育阶段等因素有关。与马继华[29]等研究中毒死蜱对南美白对虾96 h的LC50为0.89 μg·L-1相比,毒死蜱对锯齿新米虾的毒性比对南美白对虾的毒性更高。根据试验结果,参考鱼类毒性分级标准[30]可得出Cu2+对锯齿新米虾为高毒,而毒死蜱为剧毒,因而,对这两种污染物的含量应该加强监控。2.3 锯齿新米虾对Cu2+和毒死蜱毒性1:1时的响应在单一毒性试验的基础上, 以Cu2+和毒死蜱进行毒性1:1的混合比例对锯齿新米虾进行的联合毒性试验结果见表2。

图1 Cu2+对锯齿新米虾的剂量—效应关系Fig. 1 Relationship between the dead rate of N. denticulate versus Cu2+concentration

图2 毒死蜱对锯齿新米虾的剂量—效应关系Fig. 2 Relationship between the dead rate of N. denticulate versuschlorpyrifos concentration

表1 Cu2+和毒死蜱对锯齿新米虾的单一毒性Table 1 Single toxicity of Cu2+ and Chlorpyrifos on N. denticulate
注:Cu2+的NOEC、LOEC、LC50和LC5095%置信区间单位为mg·L-1;毒死蜱的NOEC、LOEC、LC50和LC5095%置信区间单位为μg·L-1。
Note: The confidence interval for NOEC, LOEC, and LC50of Cu2+is in mg·L-1, Chlorpyrifos in μg·L-1.
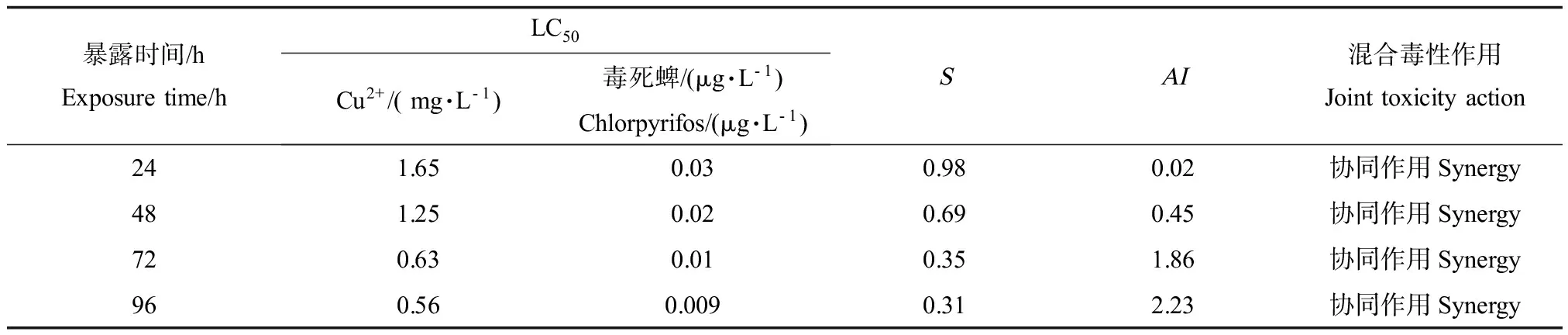
表2 Cu2+和毒死蜱毒性1:1对锯齿新米虾的联合毒性Table 2 Joint toxic action of Cu2+ and Chlorpyrifosat the toxicity of 1:1 on N. denticulate
张毓琪[31]等提出在进行混合毒性试验中,毒物除用化学上的重量浓度或体积百分浓度表示外,还可以应用毒性单位这一概念,以便于进行计算和结果比较。随后,在单一毒性试验的基础上,修瑞琴[32]等提出进行两者毒性单位1:1的联合毒性试验,认为该方法是较为简便,值得推广的。本研究结果表明:Cu2+和毒死蜱在毒性1:1的情况下的LC50均小于单一毒性时的值;Cu2+和毒死蜱对锯齿新米虾24 h、48 h、72 h和96 h联合毒性的AI分别为0.02、0.45、1.86和2.23,均大于0, 表现为协同作作用,即Cu2+和毒死蜱的存在彼此增加了对方的毒性。
关于有机磷农药与重金属离子对生物的联合作用,其毒性作用效果报道不尽相同。如戴家银等[33]研究中铜和甲基异柳磷的作用是拮抗关系,并认为很可能是有机磷农药对神经系统的麻痹作用减少了对铜的吸收, 从而减少了铜的毒性;王米道等[34]研究中,Cu2+与草甘膦复合污染时,在草甘膦不同浓度下,Cu2+的存在对根的伸长抑制效果不同。本研究中,Cu2+和毒死蜱毒性1:1混合表现出协同作用。可见,不同有机磷与重金属对不同生物的联合毒性效应不同,而且作用机制与方式极其复杂。
污染物的复合作用方式和途径多种多样,包括在机体外就发生一些的化学反应,在生命体内还会有一些的综合作用等[35]。Cu2+和毒死蜱毒性1:1的联合效应为协同作用,主要可能是因为二者致毒的结合位点和作用机制有所区别。锯齿新米虾暴露在Cu2+下,鳃首先受到损伤,其通透性和应激性有一定的增加,甚至能迅速引起呼吸运动机能改变;当进入肝胰脏和消化道后就会降低其中一些酶的活力,有研究称不同浓度的铜对肝胰腺类胰蛋白酶、胃蛋白酶、淀粉酶和纤维素酶以及一些抗氧化酶活性均有不同程度的抑制,且浓度越高,抑制作用越明显[36]。毒死蜱和其它有机磷一样,当进入生物体内后,胆碱酯酶失活导致胆碱的积累,使机体保持持续兴奋,最终死亡,这和试验观察到的锯齿新米虾在毒死蜱暴露下处于很强的兴奋状态一致。至于其联合毒性效应为协同作用可能是因为锯齿新米虾在受到Cu2+或毒死蜱中某一种污染物的致毒下其机体免疫能力减弱,在此状态下同时受到另一种污染物的致毒,则联合毒性效应最终表现为协同作用。
水体中污染物种类繁多,对水生生物毒性作用复杂。目前,重金属和有机农药仍然是水体两大污染种类,对水生生物的单一毒性研究的比较多,而且主要集中在对鱼类和大型溞方面[37,38],同时对作用的机理、预测模型的研究却较少且不够深入,本文也仅从锯齿新米虾对Cu2+和毒死蜱的死亡效应上进行了研究,对这两种污染物排放控制和水质基准的制定提供了一定的数据,在毒性机理上仍有待于从细胞分子水平上进入深入研究。联合作用效应不仅与污染物组成有关,也与受试生物的不同发育阶段及环境中的盐度、温度、溶氧等理化因子有关[39-41],今后应结合野外调查和野外模拟试验研究不同影响因素下锯齿新米虾对污染物毒性的响应。
[1] 卫志宏, 唐雄飞, 杨振祥, 等. 洱海主要污染物允许排放总量的控制分配[J]. 湖泊科学, 2013, 25(5): 665-673
Wei Z H, Tang X F, Yang Z X, et al. Allocation of major pollutants loads for Lake Erhai [J]. Journal of Lake Sciences, 2013, 25(5): 665-673(in Chinese)
[2] 敖 亮, 雷 波, 王业春, 等. 三峡库区典型农村型消落带沉积物风险评价与重金属来源解析 [J]. 环境科学, 2014, 35(1): 179-185
AO L, Lei B, Wang Y C, et al. Sediment risk assessment and heavy metal source analysis in typical countryWater Level Fluctuated Zone (WLFZ) of the three gorges [J]. Environmental Science, 2014, 35(1): 179-185 (in Chinese)
[3] 张祖麟, 余 刚, 洪华生, 等. 河口水体中有机磷农药的环境行为及其风险影响评价[J]. 环境科学, 2002, S1: 73-78
Zhang Z L, Yu G, Hong H S, et al. Environmental behavior and risk assessment of organic phosphorus pesticides at water from Jiulong river estuary [J]. Environmental Science, 2002, S1: 73-78 (in Chinese)
[4] 王 未, 黄从建, 张满成, 等. 我国区域性水体农药污染现状研究分析[J]. 环境保护科学, 2013, 39(5): 5-9
[5] 王海东, 方凤满, 谢宏芳. 中国水体重金属污染研究现状与展望[J]. 广东微量元素科学, 2010, 17(1): 14-18
Wang H D, Fang F M, Xie H F. Research situation and outlook on heavy metal pollution inwater environment of China [J]. Guang Dong Wei Liang Yuan Su KeXue, 2010, 17(1): 14-18(in Chinese)
[6] Blinova I, Ivask A, Heinlaan M, et al. Ecotoxicity of nanoparticles of CuO and ZnO in natural water [J]. Environmental Pollution, 2010, 158(1): 41-47
[7] Fang L C, Cai P, Li P X, et al. Microcalorimetric and potentiometric titration studies on the adsorption of copper byP.putidaandB.thuringiensisand their composites with minerals[J]. Journal of Hazardous Materials, 2010, 181(1-3): 1031-1038
[8] Zhang T, Li X, Lu Y, et al. Acute toxicity of heavy metals toTetrahymenain an in vitro experiment and envelope damage study[J]. Bulletin of Environmental Contamination and Toxicology, 2013, 91(1): 62-68
[9] Wong C K, Pak A P. Acute and subchronic toxicity of the heavy metals copper, chromium, nickel, and zinc, individually and in mixture, to the freshwater copepodMesocyclopspehpeiensis[J]. Bulletin of Environmental Contamination and Toxicology, 2004, 73(1): 190-196
[10] Coupe R H, Manning M A, Foreman W T, et al. Occurrence of pesticides in rain and air in urban and agricultural areas of Mississippi, April September 1995 [J]. Science of The Total Environment, 2000, 248(2-3): 227-240
[11] Booth L H, Ohalloran K. A comparison of biomarker responses in the earthworm Aporrectodeacaliginosa to the organophosphorus insecticides diazinon and chlorpyrifos [J]. Environmental Toxicology and Chemistry, 2001, 20(11): 2494-2502
[12] 周启星. 复合污染生态学[M]. 北京: 中国环境科学出版社, 1995: 25-29
[13] 梁向秋. 中国动物志·无脊椎动物(第三十六卷)甲壳动物亚门、十足目、匙指虾科[M]. 北京:科学出版社,2004: 12-17, 74-77
Liang X Q. Fauna Sinica·Invertebrata(Vol.36) Crustacea Decapoda Atyidae[M]. Beijing: Science Press, 2004: 12-17, 74-77 (in Chinese)
[14] 宫本纯之, 泷本善之, 沈俭. OECD化学品试验法准则介绍(上)[J]. 农药译丛, 1982, 4: 10-18, 45
[15] OECD. OECD guidelines for the testing of chemicals. Section 2: Effects on Biotic Systems Test No. 203: Acute Toxicity for Fish[C]. Organization for Economic Cooperation and Development, 1992: 1-9
[16] 国家环保局《水生生物监测手册》编委会. 水生生物监测手册[M]. 南京: 东南大学出版社,1993: 43-57
[17] 国家环境保护局《水和废水监测分析方法》编委会. 水和废水监测分析方法(第四版)[M]. 北京: 中国环境科学出版社, 2002: 725-729
[18] 李翠萍, 吴民耀, 王宏元. 3种半数致死浓度计算方法之比较 [J]. 动物医学进展, 2012, 33(9): 89-92
Li C P, Wu M Y, Wang H Y. LC50Caculated by Kochi, probit analysis and linear regression methods [J]. Progress in Veterinary Medicine, 2012, 33(9): 89-92(in Chinese)
[19] 贾春生. 利用SPSS软件计算杀虫剂的LC50[J]. 昆虫知识, 2006, 43(3): 414-417
Jia C S. Calculatiang the LC50of insecticides with software SPSS [J]. Chinese Bulletin of Entomology, 2006, 43(3): 414-417 (in Chinese)
[20] Marking L L. Method for assessing additive toxicity of chemical mixtures[J]. Aquatic Toxicology and Hazard Evaluation, 1977, 634: 99-108
[21] 董学兴, 吕林兰, 王爱民, 等. Cu2+和Cd2+对克氏原螯虾幼虾的毒性效应研究[J]. 水生态学杂志, 2010, 3(3): 90-93
Dong X X,Lv L L,Wang A M, et al. Study on the acute toxicity of Cu2+and Cd2+acting onProcambarusclarkiijuvenile [J]. Journal of Hydroecology, 2010, 3(3): 90-93 (in Chinese)
[22] 张彩明, 陈应华. Cr6+、Mn7+和Zn2+对脊尾白虾幼虾的单一毒性和联合毒性[J]. 海洋环境科学, 2013, 32(2): 235-238
Zhang C M,Chen Y H. Acute toxicity and joint toxicity of Cr6+、Mn7+and Zn2+onPalaemoncarincaudajuvenile [J]. Marine Environmental Scinence, 2013, 32(2): 235-238 (in Chinese)
[23] Pandey S, Parvez S, AhamdAnsar R, et al. Effects of exposure to multiple trace metals on biochemical, histological and ultrastructural features of gills of a freshwater fish, Channapunctata Bloch[J]. Chemico-Biological Interactions, 2008, 174(3): 183-192
[24] Matsuo A Y O, Playle R C, Val A L, et al. Physiological action of dissolved organic matter in rainbow trout in the presence and absence of copper: Sodium uptake kinetics and unidirectional flux rates in hard and softwater [J]. Aquatic Toxicology, 2004, 70(1): 63-81
[25] 贾秀英, 陈志伟. 铜、镉对鲫鱼组织超氧化物歧化酶活性的影响[J]. 水生生物学报, 2003, 27(3): 323-325
Jia X Y, Chen Z W. The effects of Cu2+、Cd2+on superoxide activities inCarassiusAuratus[J]. Acta Hydrobiologica Sinica, 2003, 27(3): 323-325(in Chinese)
[26] 贺诗水. 铜离子对锦鲤的急性毒性及安全浓度评价[J]. 贵州农业科学, 2010, 38(2): 205-207
He S S. Acute toxicity of copper and its safe concentrationassessment onCryprinuscarp[J]. Guizhou Agricultural Sciences, 2010, 38(2): 205-207(in Chinese)
[27] 杨先乐, 湛 嘉, 黄艳平. 有机磷农药对水生生物毒性影响的研究进展[J] . 上海水产大学学报, 2002,11(4): 378-382
Yang X L, Zhan J, Huang Y P. Progress on research of toxic effect of organophosphorous pesticides on aquatic organism [J]. Journal of Shanghai Fisheries University, 2002, 11(4): 378-382 (in Chinese)
[28] 金显文, 石春梅, 杨 青. 铜和苯酚对锯齿米虾的急性致毒研究[J]. 淮北煤炭师范学院学报(自然科学版), 2007, 28(1): 35-37
Jin X W, Shi C M, Yang Q. Acute toxicity of copper and phenol toCaridinadenticulate[J]. Journal of Huaibei Coal Industry Teachers College (Natural Science), 2007, 28(1): 35-37 (in Chinese)
[29] 马继华, 蒋耀培, 刘 泉, 等. “毒死蜱”对南美白对虾的急性毒性影响[J]. 水产科技情报, 2009, 36(4): 192-194
[30] Joint IMCO / FAO / UNESCO / WMO group of experts onthe scientific aspects of marine pollution. Abstractof the reports of the first session[J]. Water Research, 1969, 3(12): 995-1005
[31] 张毓琪, 陈叙龙. 环境生物毒理学[M]. 天津: 天津大学出版社, 1993: 99-101
[32] 修瑞琴, 许永香, 傅迎春, 等. 水生毒理联合效应相加指数法[J]. 环境化学, 1994,13(3): 269-271
Xiu R Q, Xu Y X, Fu Y C, et al. Additive index of coeffects for aquatic toxicology[J]. Environmental Chemistry, 1994, 13(3): 269-271 (in Chinese)
[33] 戴家银, 郑微云, 王淑红. 重金属和有机磷农药对真鲷和平鲷幼体的联合毒性研究[J]. 环境科学, 1997, 18(9): 44-46, 54
[34] 王米道, 程凤侠, 司友斌. 铜与草甘膦复合污染对小麦种子发芽与根伸长的抑制作用[J]. 生态毒理学报, 2009, 4(4): 591-596
Wang M D, Cheng F X,Si Y B. The inhibition of the combined pollution of copper and glyphosateto the seed germination and root elongation of wheat [J]. Asian Journal of Ecotoxicology, 2009, 4(4): 591-596 (in Chinese)
[35] Spurgeon D J, Jones O A H, Dorne J C M, et al. Systemstoxicology approaches for understanding the jointeffects of environmental chemical mixtures [J]. Science of the Total Environment, 2010, 408(18): 3725-3734
[36] 杨志彪, 赵云龙, 周忠良, 等. 水体铜对中华绒螯蟹体内铜分布和消化酶活性的影响[J]. 水产学报, 2005, 29(4): 496-501
Yang Z B, Zhao Y L, Zhou Z L, et al. Effects of copper in water on distribution of copper anddigestive enzymes activities inEriocheirsinensis[J]. Journal of Fisheries of China, 2005, 29(4): 496-501 (in Chinese)
[37] 曾艳艺, 赖子尼, 杨婉玲, 等. 铜和镉对珠江天然仔鱼和幼鱼的毒性效应及其潜在生态风险[J]. 生态毒理学报,2014, 9(1): 49-55
Zeng Y Y, Lai Z N, Yang W L, et al. Toxicities and potential ecological effects of copper and cadmium to natural fish larvae and juveniles from the Pearl River [J]. Asian Journal of Ecotoxicology, 2014, 9(1): 49-55 (in Chinese)
[38] 吴宗凡, 刘兴国, 王高学. 重金属与有机磷农药二元混合物对卤虫联合毒性的评价及预测[J]. 生态毒理学报, 2013, 8(4): 602-608
Wu Z F, Liu X G, Wang G X. Evaluating and modeling the toxicity of binary mixtures of heavy metals and organophosphate pesticides toAnemiasaliva[J]. Asian Journal of Ecotoxicology, 2013, 8(4): 602-608 (in Chinese)
[39] 端正花, 朱 琳, 王 平, 等. 双酚A对斑马鱼不同发育阶段的毒性及机理[J]. 环境化学, 2007, 26(4): 491-494
Duan Z H, Zhu L, Wang P, et al. Toxicites of bisphenol A on different developed stages of zebrafish (Danioreiroand their mechanisms) [J]. Environmental Chemistry, 2007, 26(4): 491-494 (in Chinese)
[40] 高 平, 陈昌福, 胡琼予, 等. 不同条件下高效氯氰菊酯对鲫的急性毒性研究[J]. 淡水渔业, 2007, 37(2): 48-52
Gao P, Chen C F, Hu Q Y, et al. Studies on acute toxicity of beta-cypermethrin toCarassiusauratusin different factors [J]. Freshwater Fisheries, 2007, 37(2): 48-52(in Chinese)
[41] 周 浩, 朱丽岩, 陈志鑫, 等. 几种环境因子影响下铜和TBT对中华哲水蚤的毒性效应[J]. 中国海洋大学学报(自然科学版), 2010, S1: 131-136
Zhou H, Zhu L Y, Chen Z X, et al. Toxicity of copper and TBT to the copepodCalanussinicus(Crustacea,Copepoda): Effects of acidity, temperature and salinity [J]. Periodical of Ocean University of China (NaturalScience), 2010, S1: 131-136 (in Chinese)
◆
ResearchontheResponseofNeocaridinaDenticulatetotheToxicityofCu2+andChlorpyrifos
Li Dianbao1, Zhang Wei1,2, Wang Liqing1,*, Hao Ruijuan1
1. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China2. Aquatic Environmental Engineering Corporation Limited, Shanghai 200090, China
11 August 2010accepted1 October 2010
We investigated the response of aquatic organisms to heavy metals and organ-phosphoruspesticide in waters. We exposedNeocaridinadenticulateto Cu2+, pure chlorpyrifos solution and a 1:1 compound toxicity solution. We evaluated the comprehensive toxicity using the additive index method. The single toxicity tests showed that chlorpyrifos had significantly higher toxicity toN.denticulatethan Cu2+(p<0.01). The Cu2+concentrations for which we observed no effect onN.denticulate(no observed effect concentration, NOEC) and for which we observed the lowest effect (lowest observed effect concentration, LOEC) were 1.78 mg·L-1, 2.40 mg·L-1, respectively..The LC50of 24 h, 48 h, 72 h and 96 h were 6.41 mg·L-1, 4.75 mg·L-1, 4.20 mg·L-1and 3.44 mg·L-1, respectively. For chlorpyrifos, the NOEC and the LOEC were 0.04 μg·L-1, 0.07 μg·L-1, respectively, the LC50of 24 h, 48 h, 72 h and 96 h were 0.35, 0.17, 0.11 and 0.06 μg·L-1, respectively. According to fish toxicity grading standards, Cu2+was highly toxic toN.denticulatewhile chlorpyrifos was virulent. The comprehensive toxicity tests showed that the joint toxicity of Cu2+and chlorpyrifos was synergistic when the toxicity was 1:1 at 24 h, 48 h, 72 h and 96 h, and the addition index (AI) were 0.02, 0.45, 1.86 and 2.23, respectively. This study provided a scientific basis for preventing water pollution and conserving aquatic diversity.
Neocaridinadenticulate; Cu2+;chlorpyrifos; toxicity response
2014-05-14录用日期:2014-06-11
1673-5897(2014)4-785-08
: X171.5
: A
王丽卿(1970—),女,博士,教授,主要研究方向为水生生物多样性和水域生态修复。
上海市水务局"十二五"河道生态治理技术指南研究及编制(沪水科2011-07)
李典宝(1988-),男,硕士研究生,主要从事水域生态修复研究。E-mail:liberty0117@163.com
*通讯作者(Corresponding author), E-mail: lqwang@shou.edu.cn
10.7524/AJE.1673-5897.20140607001
李典宝,张玮,王丽卿, 等. 锯齿新米虾对Cu2+和毒死蜱毒性响应研究[J]. 生态毒理学报, 2014, 9(4): 785-792
Li D B, Zhang W, Wang L Q, et al. Research on the response ofNeocaridinaDenticulateto the toxicity of Cu2+and chlorpyrifos [J]. Asian Journal of Ecotoxicology, 2014, 9(4): 785-792 (in Chinese)
