外源NO介导Cu2+胁迫下番茄幼苗活性氧与内源NO代谢的研究
2014-09-27王逸筠李晓云崔秀敏
王逸筠,李晓云,王 建,崔秀敏
山东农业大学资源与环境学院 土肥资源高效利用国家工程实验室,泰安 271018
外源NO介导Cu2+胁迫下番茄幼苗活性氧与内源NO代谢的研究
王逸筠,李晓云,王 建,崔秀敏*
山东农业大学资源与环境学院 土肥资源高效利用国家工程实验室,泰安 271018
采用营养液培养方法,研究Cu2+胁迫下外源一氧化氮(nitric oxide,NO)介导的番茄幼苗活性氧及NO代谢途径。结果表明:在Cu2+胁迫下,番茄叶片和根系氧自由基含量增加,NO释放量以及硝酸还原酶(nitrate reductase,NR)和一氧化氮合酶(nitric oxide synthase,NOS)活性降低。外源NO能提高Cu2+胁迫下番茄叶片NR和NOS活性,促进NO的产生,根系NOS活性及NO产量也同时上升。外源NO使精氨酸含量显著增加,而Hb(牛血红蛋白,NO清除剂)可部分抵消NO的促进作用,使Cu2++SNP+Hb处理下番茄精氨酸含量显著下降。可见,外源NO的加入可通过酶促和非酶促途径促进Cu2+胁迫下NO的合成,介导NO信号调控网络,调节内源NO、精氨酸和活性氧代谢途径,从而缓解过多Cu2+引起的氧化伤害。
番茄;Cu2+胁迫;一氧化氮;活性氧;精氨酸;一氧化氮代谢
Cu2+是植物必需微量元素,广泛参与各种生命活动。同时作为重金属元素,Cu2+过量会对植物造成严重伤害,导致细胞内生物代谢紊乱,最终抑制植物生长[1]。Cu2+对植物细胞的胁迫症状之一是活性氧(ROS)积累导致的膜脂过氧化作用。
NO是结构简单、高脂溶性、极不稳定的小分子气体,易通过扩散方式透过细胞膜。同时NO具有信号分子的作用,可以减少非生物胁迫下植物体内活性氧的积累,缓解各种胁迫造成的氧化伤害,从而增强植物的适应能力。植物体内NO的来源主要有一氧化氮合酶(NOS)途径,硝酸还原酶(NR)途径和非酶促途径,如经反硝化作用和氮固定形成NO;硝化作用和反硝化作用将N2O氧化成NO;酸性条件下,由NO2还原形成NO;由类胡萝卜素转化的光介导非酶促反应形成NO;抗坏血酸或光参与由NO2形成NO。植物体中还有依赖L-精氨酸的NO产生的途径存在(如图1)。NR可将硝酸根还原成亚硝酸根,进一步亚硝酸根还原成NO[2]。在酸性或还原环境中,亚硝酸的还原亦会形成NO。亚硝酸与抗坏血酸反应能够形成NO和脱氢抗坏血酸[3]。
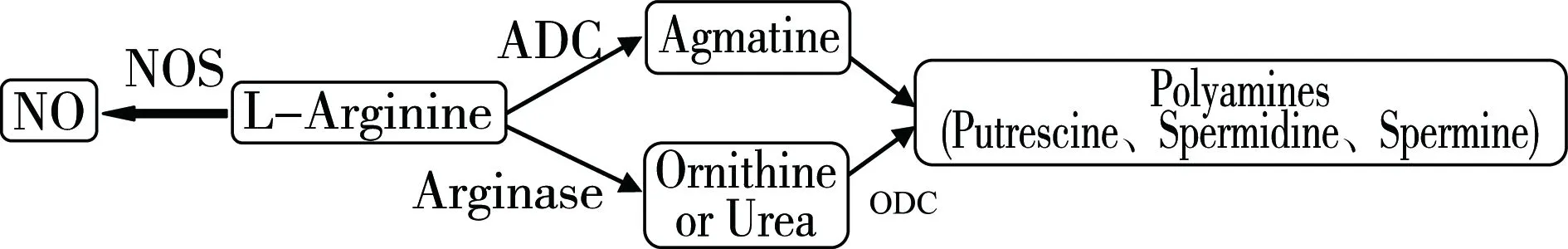
图1 植物精氨酸代谢与多胺和一氧化氮产生的关系Fig. 1 Relationship between arginine metabolism and the biosynthesis of both polyamines and nitric oxide in plants
研究表明,外源NO能够提高Cu2+胁迫下番茄植株的抗氧化能力和重金属耐性[4],适当浓度的NO能有效提高生物抗氧化酶的活性,如过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)比活性,缓解重金属引起的氧化伤害[5],另一方面,其作为信号分子,NO可上调ROS清除系统(如抗氧化酶SOD、CAT、POD、GPX等)的相关基因的表达,减少ROS过量积累以抵御胁迫伤害。然而这些研究主要集中在外源NO供体的作用下对植物抗逆性的影响,而对于内源NO代谢途径研究很少。本试验以“改良毛粉802F1”番茄种子为试材,采用NO供体硝普钠(SNP)处理Cu2+胁迫下番茄幼苗,探讨外源NO介导的Cu2+胁迫下番茄幼苗活性氧的变化认及对NO代谢的影响。
1 材料和方法(Materials and methods)
1.1 供试材料与试验设计
供试材料:“改良毛粉802F1”番茄种子,Hoagland营养液。
试验在山东农业大学智能温室内进行,用Hoagland营养液培养幼苗。种子经55 ℃温汤浸种消毒15 min,然后在润湿的吸水纸上26 ℃催芽。待种子露白后,播于洗净的蛭石中,萌发后用1/4 Hoagland营养液浇灌。当幼苗具有3~4片真叶时,挑选生长一致的植株洗净根部蛭石后,移栽于4 L塑料桶中,用厚度为3 cm的泡沫塑料板做成长方形盖子,覆盖在塑料桶顶部。每盆栽4株,用1/2Hoagland营养液进行栽培。1周后换成完全营养液,此后每3 d更换1次营养液。营养液栽培期间用电动气泵24 h连续通气。
番茄植株长至5~6片真叶时进行铜离子胁迫处理。分别向营养液中加入CuCl2、SNP和Hb。试验设5个处理:(1)完全营养液(CK);(2)50 μmol·L-1CuCl2Cu2+胁迫处理(CK+Cu2+);(3)50 μmol·L-1CuCl2+100 μmol·L-1SNP,NO缓解处理(Cu2++SNP);(4)50 μmol·L-1CuCl2+100 μmol·L-1SNP+0.1% Hb,(Cu2++SNP+Hb)。每个处理重复4次,温室内随机排列。用低浓度的KOH或者HCl调节pH至5.5±0.2,处理8 d后,收获植株。
1.2 测定项目与方法
1.2.1 植株生长量的测定
收获番茄植株后,将叶片和根系分开,用蒸馏水冲洗干净,吸水纸吸干,直接测定鲜重(FW)。
1.2.2 丙二醛和过氧化氢含量的测定
丙二醛含量的测定参照赵世杰的方法[6],取0.5 g新鲜植株样品(叶、根)加入5%三氯乙酸5 mL,研磨后所得匀浆在3 000 rpm下离心10 min,取上清液,即为酶提取液。取酶液1 mL,加入2 mL硫代巴比妥酸溶液(0.67%),沸水浴15 min, 4 000 rpm离心15 min,分别将上清液在450 nm,532 nm,600 nm下比色。
过氧化氢含量的测定参照Patterson等[7]的方法。取0.5 g叶片用6 mL冷丙酮研磨,2 500 rmp 离心10 min,取l mL上清液,加入0.l mL四氯化钛(TiC14)浓盐酸溶液(20%),0.2 mL氨水,2 500 rmp离心10 min,用丙酮悬浮洗涤沉淀5次,将沉淀溶于3 mL 1 mol·L-1的硫酸中,测定OD410。
1.2.3 植物根系活力测定
根系活力采用氯化三苯基四氮唑(TTC)法测定[6],用四氮唑的还原强度(μg·g-1·h-1) 表示根系活力。将番茄根系洗净,吸干表面水后剪碎,均匀称取0.4 g于试管中,加入0.4% TTC和磷酸缓冲液的等量混合液10 mL,37 ℃保温4 h,加入1 mol·L-1H2SO42 mL终止反应,放置15 min后,取出根系吸干,加入10 mL 95%的乙醇提取24 h后,于485 nm下比色。
1.2.4 精氨酸含量测定
参考Sakaguchi 和胡桂娟等 的方法[8-9]。植物材料用10%(w/v)三氯乙酸按1:10(w/v)的比例冰浴研磨,1 457 rmp冷冻离心10 min,上清液为精氨酸提取液。一定量上清液按顺序加入3%(w/v)NaOH、0.15%(w/v)1-萘酚,再加入50%(v/v)安替福民(次氯酸钠溶液)启动反应,530 nm比色测定。

参考Elstner的方法[10],植物材料按1:5(w/v)的比例用50 mmol·L-1PBS(pH=7.8)冰浴研磨,1 278 rmp 4 ℃离心15 min。上清液加10 mmol·L-1盐酸羟胺,25 ℃保温20 min后再加入17 mmol·L-1对氨基苯磺酸和7 mmol·L-1α-萘胺,25 ℃保温20 min,正丁醇萃取,测530 nm比色。
1.2.6 CAT比活性测定
采用Cakmak和Marschner的方法[11]。取上清液100 μL,加25 mmol·L-1磷酸缓冲液(pH=7.0,含0.1 mmol·L-1的EDTA)1 700 μL,10 mmol·L-1H2O2200 μL,25 ℃下反应。用紫外可见分光光度计(SHIMADZU UV-2450)按Kinetics程序测定OD240,取其中20 s的动力学变化计算酶促反应速率。
1.2.7 内源NO含量测定
根据Murphy和Noack[12]方法稍加改进测定内源NO。取0.5 g切成1 cm长的新鲜叶片,在含100UCAT和100USOD的溶液中浸泡5 min,以除去植物内源的活性氧,然后加入10 mL纯化好的血红蛋白溶液反应2 min,测定反应液在577 nm和591 nm吸光值,根据公式C=(OD577-OD591) /11.2计算NO的释放率。
1.2.8 硝酸还原酶活性的测定
采用活体法测定硝酸还原酶活性[6]。称取样品0.5 g 3份,放入带编号的试管中。分别向试管加入KNO3-异丙醇-磷酸缓冲混合液9 mL,其中一管立即加1.0 mL三氯乙酸混匀之后作空白对照。将试管放入真空干燥器,抽气,直到样品叶片全部沉在管底。然后把试管放在30 ℃下于黑暗处保持温度30 min,分别向处理管加1.0 mL三氯乙酸溶液,摇匀以终止酶活性。静置2 min,吸取上2 mL清液加入另一组试管,以对照管作参比,按标准曲线做法进行显色测定,计算酶活性。
1.2.9 一氧化氮合酶(NOS)活性的测定
采用NOS试剂盒测定NOS活性。1.000 g叶片加入50 mmol·L-1pH 7.2的缓冲液1 mL冰浴研磨,3 mL缓冲液冲洗,10 000 rmp冷冻离心 10 min。参考试剂盒说明书进行测定(试剂盒购自南京建成生物工程研究所):0.4 mL上清液依次加0.2 mL底物缓冲液、0.01 mL促进剂、0.1 mL显色剂,混匀,37oC水浴准确反应5 min,然后依次加0.1 mL透明剂、2 mL终止液,混匀,蒸馏水调零,530 nm比色测定,每个处理重复3次。
1.3 数据处理
采用Microsoft Excel软件对数据进行处理及绘图,采用SAS统计软件对平均数进行多重比较。
2 结果与分析(Results and analysis)
2.1 外源NO对Cu2+胁迫下番茄氧自由基释放量的影响
Cu2+处理的番茄叶片氧自由基释放速率比CK增加53.0%,差异显著。与Cu2+处理相比,Cu2++SNP处理番茄叶片氧自由基释放速率降低7.7%。Cu2++SNP处理番茄叶片氧自由基释放速率比CK增加41.21%。Cu2++SNP+Hb处理番茄叶片氧自由基释放速率比Cu2++SNP处理增加27.67%,达显著水平(图2-A)。
与CK相比,Cu2+处理番茄根系氧自由基释放速率增加30.7%,达显著水平。Cu2++SNP处理比Cu2+处理根系氧自由基释放速率差异不显著。Cu2++SNP处理番茄根系氧自由基释放速率比CK增加28.05%。与Cu2++SNP处理相比,Cu2++SNP+Hb处理番茄根系氧自由基释放速率增加13.63%(图2-B)。

图2 外源NO对Cu2+毒害下番茄叶片(A)和根系(B)中释放速率的影响Fig. 2 Effects of exogenous NO on the production rate of · in tomato leaves(A)and roots(B)under Cu2+ stress
2.2 外源NO对Cu2+胁迫下番茄过氧化氢含量的影响
如图3-A所示,与CK相比,Cu2+处理番茄叶片H2O2含量增加1.1倍,差异显著。Cu2++SNP处理的番茄叶片H2O2含量降低47.4%,差异显著。与Cu2+处理相比,Cu2++SNP处理番茄叶片H2O2含量降低47.36%,差异显著。Cu2++SNP+Hb处理番茄叶片H2O2含量比Cu2++SNP处理增加40.63%,差异显著。
Cu2+处理下番茄根系H2O2含量比CK增加87.3%,差异显著。与Cu2+处理相比,Cu2++SNP处理番茄根系H2O2含量降低38.4%,差异显著。Cu2++SNP处理番茄根系H2O2含量比CK增加15.3%。Cu2++ SNP+Hb处理番茄根系H2O2含量比Cu2++SNP处理增加39.6%,差异显著(图3-B)。
2.3 外源NO对Cu2+胁迫下番茄MDA含量的影响
如图4-A,Cu2+处理番茄叶片MDA含量比CK降低34.4%,差异显著。与Cu2+处理相比,Cu2++SNP处理番茄叶片MDA含量增加14.9%,差异显著。Cu2++SNP处理的番茄叶片MDA含量比CK增加14.4%。与Cu2++SNP处理相比,Cu2++SNP+Hb处理番茄叶片MDA含量增加8.6%。
与CK相比,Cu2+处理番茄根系MDA含量增加3.0倍,差异显著。Cu2++SNP处理番茄根系MDA含量比Cu2+处理降低30.4%,差异显著。与CK相比,Cu2++SNP处理番茄根系MDA含量减少64.16%,差异显著。与Cu2++SNP处理相比,Cu2++SNP+Hb处理的番茄根系MDA含量增加57.89%,差异显著(图4-B)。

图3 外源NO对Cu2+胁迫下番茄幼苗叶片(A)和根系(B)H2O2含量的影响Fig. 3 Effects of exogenous NO on the content of H2O2 in tomato leaves(A)and roots(B)under Cu2+ stress

图4 外源NO对Cu2+胁迫下番茄幼苗叶片(A)和根系(B)MDA含量的影响Fig. 4 Effects of exogenous NO on MDA content in tomato leaves(A)and roots(B)under Cu2+ stress
2.4 外源NO对Cu2+胁迫下番茄CAT活性的影响
与CK相比,Cu2+处理的番茄叶片CAT活性降低35.4%,差异显著。Cu2++SNP处理的番茄叶片CAT活性提高39.5%,差异极显著。与Cu2+处理相比,Cu2++SNP处理番茄叶片CAT活性升高39.48%,差异显著。与Cu2++SNP处理相比,Cu2++SNP+Hb处理的番茄叶片CAT活性降低45.22%,差异显著(图5-A)。
Cu2+处理的番茄根系CAT活性比CK降低30.9%,差异显著。与Cu2+处理相比,Cu2++SNP处理的番茄根系CAT活性提高16.7%,差异显著。Cu2++SNP处理的番茄根系CAT活性比CK处理降低19.39%。与Cu2++SNP处理相比,Cu2++SNP+Hb处理的番茄根系CAT活性减少62%,差异极显著(图5-B)。
2.5 外源NO对Cu2+胁迫下番茄硝酸还原酶活性和根系活力的影响
由图6-A可见,与CK相比,Cu2+处理叶片NR活性降低15.4%,差异显著。Cu2++SNP处理叶片NR活性比Cu2+处理增加53%,达极显著水平。Cu2++SNP处理叶片NR活性比CK处理增加29.6%,达极显著水平。Cu2++SNP+Hb处理叶片NR活性比Cu2++SNP处理减少40.66%,差异极显著。
与CK相比,Cu2+处理的根系活力降低40.7%,达极显著水平。Cu2++SNP处理的根系活力比Cu2+处理提高20.2%,差异显著。Cu2++SNP处理根系活力比CK降低28.74%。Cu2++SNP+Hb处理根系活力比Cu2++SNP处理减少30.85%,差异显著,说明外源NO能够部分缓解Cu2+胁迫对根系活力的抑制,但不能完全逆转(图6-B)。

图5 外源NO对Cu2+毒害下番茄叶片(A)和根系(B)中CAT活性的影响Fig. 5 Effects of exogenous NO on the CAT activity in tomato leaves(A)and roots(B)under Cu2+ stress
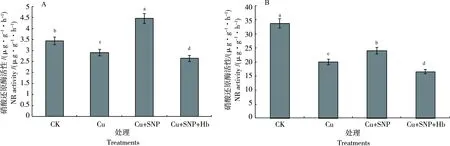
图6 外源NO对Cu2+胁迫下番茄幼苗叶片NR活性(A)和根系活力(B)的影响Fig. 6 Effects of exogenous NO on the NR activity in tomato leaves(A)and the root activity(B)under Cu2+ stress
2.6 外源NO对Cu2+胁迫下番茄NO释放量的影响
Cu2+处理下番茄叶片NO释放量比CK降低12.6%,差异显著。与Cu2+处理相比,Cu2++SNP处理番茄叶片NO释放量增加34.0%,差异显著。Cu2++SNP处理番茄叶片NO释放量比CK降低3.73%。Cu2++SNP+Hb处理番茄叶片NO释放量比Cu2++SNP处理减少9.96%(图7-A)。
与CK相比,Cu2+处理番茄根系NO释放量降低22.1%,差异显著。Cu2++SNP处理的番茄根系NO释放量比Cu2+处理增加36.0%,差异显著。Cu2++SNP处理番茄根系NO释放量比CK增加6%。与Cu2++SNP处理相比,Cu2++SNP+Hb处理番茄根系NO释放量减少11.06%(图7-B)。可见,外源NO可以有效激发内源NO的合成,而Hb可以部分减缓这种刺激效应。
2.7 外源NO对Cu2+胁迫下番茄NOS活性的影响
番茄叶片和根系NOS活性变化趋势相似。与CK相比,Cu2+处理的番茄叶片NOS活性降低12%。Cu2++SNP处理的番茄叶片NOS活性比Cu2+处理提高55.63%,差异极显著。与CK相比,Cu2++SNP处理番茄叶片NOS活性增加37%。Cu2++SNP+Hb处理番茄叶片NOS活性比Cu2++SNP处理降低38.8%,差异显著(图8-A)。
Cu2+处理番茄根系NOS活性比CK提高62.4%,差异显著。与Cu2+处理相比,Cu2++SNP处理番茄根系NOS活性提高56.8%,差异显著。Cu2++SNP处理番茄根系NOS活性是CK的2.5倍,差异极显著。Cu2++SNP+Hb处理番茄根系NOS活性比Cu2++SNP处理降低20.6%(图8-B),抵消了部分SNP的激发效应。
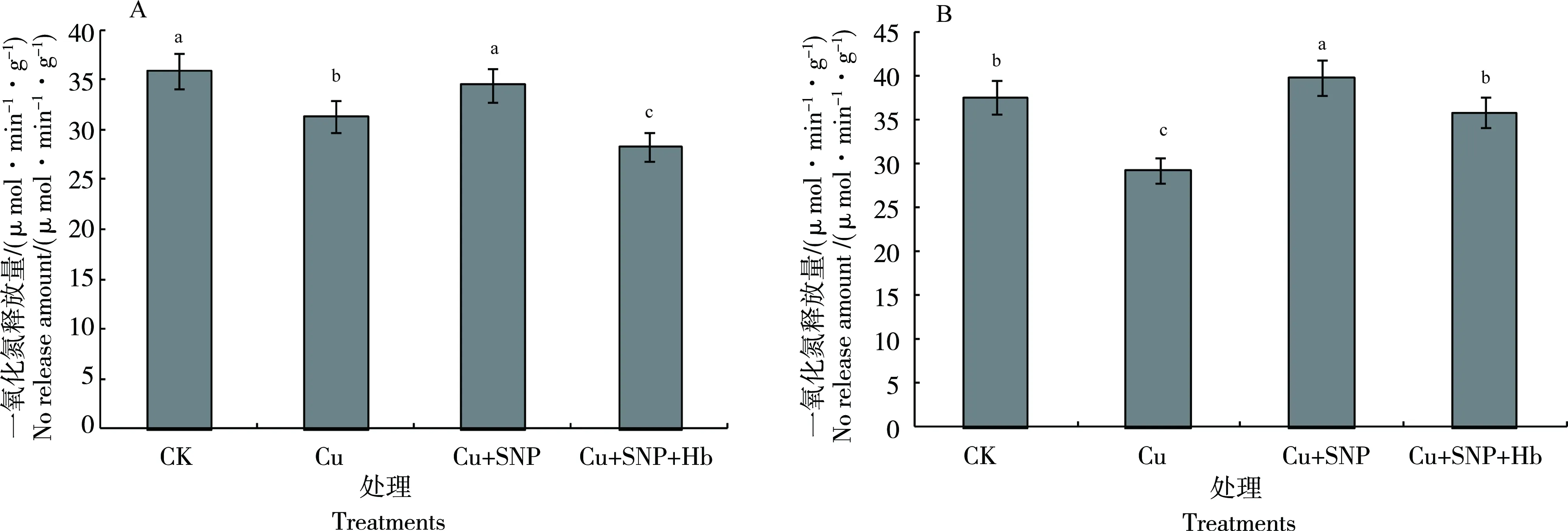
图7 外源NO对Cu2+毒害下番茄叶片(A)和根系(B)中NO释放量的影响Fig. 7 Effects of exogenous NO on the production amout of NO in tomato leaves(A)and roots(B)under Cu2+ stress
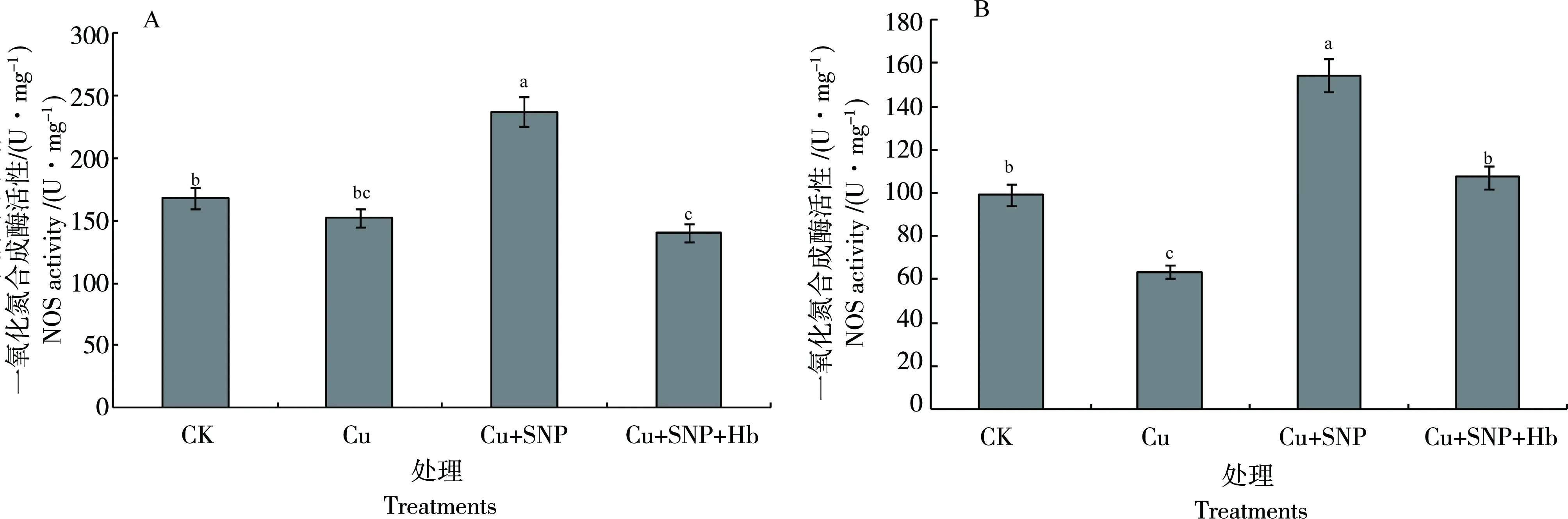
图8 外源NO对Cu2+毒害下番茄叶片(A)和根系(B)中NOS活性的影响Fig. 8 Effects of exogenous NO on the NOS activity in tomato leaves(A)and roots(B)under Cu2+ stress
2.8 外源NO对Cu2+胁迫下番茄精氨酸含量的影响
Cu2+处理下番茄叶片精氨酸含量比CK增加20.2%,差异显著。与Cu2+处理相比,Cu2++SNP处理番茄叶片精氨酸含量增加83%,达极显著水平。Cu2++SNP处理番茄叶片精氨酸含量为CK的2倍,差异显著。与Cu2++SNP处理相比,Cu2++SNP+Hb处理番茄叶片精氨酸含量降低11%(图9-A)。
与CK相比,Cu2+处理的番茄根系精氨酸含量提高54.5%,差异显著。Cu2++SNP处理的番茄根系精氨酸含量比Cu2+处理增加78.5%,差异极显著。Cu2++SNP处理番茄根系精氨酸含量增加为CK的2.8倍,差异极显著。Cu2++SNP+Hb处理番茄根系精氨酸含量比Cu2++SNP降低24.6%,差异显著(图9-B)。
2.9 外源NO对Cu2+胁迫下番茄生物量的影响
由图10-A可知,Cu2+处理下,番茄地上部分鲜重比CK减少39.1%,差异显著。与Cu2+处理相比,Cu2++SNP处理地上部分鲜重增加26.5%,差异显著。Cu2++SNP+Hb处理比Cu2++SNP处理地上部分鲜重减少19.6%,与CK相比,Cu2++SNP处理地上部分鲜重减少23%。
与CK相比,Cu2+处理根系鲜重减少48.8%,差异显著。Cu2++SNP处理根系比Cu2+处理增加46.1%。与CK处理相比,Cu2++SNP处理根系鲜重减少26.27%。Cu2++ SNP +Hb处理比Cu2++SNP处理根系鲜重减少25.26%(图10-B)。

图9 外源NO对Cu2+毒害下番茄叶片(A)和根系(B)中精氨酸含量的影响Fig. 9 Effects of exogenous NO on the production amout of NO in tomato leaves and roots under Cu2+ stress
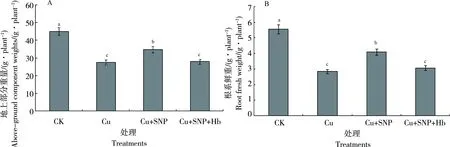
图10 外源NO对Cu2+胁迫下番茄幼苗生物量的影响Fig. 10 Effect of exogenous NO on biomass in tomato seedlings under copper stress
3 讨论(Discussion)


ROS主要以单线态氧(1O2)、超氧阴离子(O2-)、过氧化氢(H2O2)、羟基自由基(-OH)和氢过氧基(HO2·)5种形式相互转换。很多研究表明,铜胁迫导致大量的活性氧自由基,如H2O2、O2-等在植物体内积累,达到一定浓度时便会引起质膜和细胞器膜的膜脂过氧化,导致细胞死亡。而植物体自身会产生应激反应,即诱导植物体内的酶促清除系统—抗氧化酶类,如CAT抗氧化系统的启动,其可在一定程度上清除过多活性氧以维持机体自由基代谢平衡,缓解过多Cu2+胁迫对植物体的伤害。本研究中,过量Cu2+造成番茄体内活性氧的积累,H2O2和O2-、MDA的含量显著上升,而CAT活性下降,说明铜在此浓度下,会使CAT活性下降,高浓度铜对植物体内抗氧化防御系统有一定的破坏作用。
H2O2是植物体内较为活跃的信号分子[19]。大量研究显示,NO和H2O2可能是植物胁迫信号转导的中心环节,介导多种信号途径,二者共同参与调控气孔运动,促进细胞编程性死亡以及诱导防御基因表达等过程。在细胞内不同的NO和ROS自由基能发生直接的化学反应而彼此相互转换[20]。NO和H2O2均可跨膜运输,在许多情况下NO和H2O2之间相互联系。例如由真菌激发子刺激而引起的H2O2和NO的形成过程,基本上是同步的。ROS是生物体氧化代谢的副产物,而NO则会通过调节ROS的生成和降解影响植物体内ROS的水平和毒性,并通过参与胞内氧化还原平衡的调节来降低植物过氧化伤害。大量研究表明,在外界环境刺激下,植物体内NO与其它信号分子如H2O2,在生物合成、基因表达和蛋白活性调控水平上,存在串流作用[21]。NO可影响超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(ASA-POD)的活性,进而调节植物体内源H2O2的含量。在一些生理过程中,NO和ROS具有相似的生物学特性。如引起胞质Ca2+浓度升高、激活磷脂酶或蛋白激酶等,表明彼此可能存在相互关系。不同的非生物胁迫和刺激,如盐胁迫、干旱胁迫、重金属胁迫,都会诱导NO和H2O2的共同产生。Capone等[22]用NO或H2O2处理拟南芥根系,发现叶片中MAPK这类植物逆境传递信号分子的活性会迅速升高,表明NO与H2O2作为信号分子具有相似的信号传递作用。本研究中,外源NO供体的加入明显降低H2O2、O2-和MDA的含量,提高了CAT的活性,这说明,NO可能通过其信号分子的作用,诱导CAT抗氧化酶系统启动,对活性氧进行及时的清除。试验结果中,在对番茄进行Cu2++SNP处理后,H2O2、O2-和MDA含量呈与对照组接近的趋势,均有所下降,说明正常生长条件下,植物体内需要H2O2等活性氧在一定浓度下参与特定的生理代谢活动,并且活性氧浓度可能与NO水平密切相关。植物体内可能存在NO与活性氧的平衡体系,共同发挥信号分子的作用。植物体中包含多种NO合成酶源,包括黄嘌呤氧化还原酶,过氧物酶,细胞色素P450,和一些亚铁血红素蛋白。精氨酸不仅作为一种重要的氮素贮藏营养,还具有一些特殊生理功能[23],可能与精氨酸代谢有关,即NO是精氨酸代谢产物之一。植物细胞内,NO的产生途径之一是一类以L-精氨酸为底物的类NOS。研究发现拟南芥中有一类与哺乳类NOS序列不相同的AtNOS1蛋白,在植物体中具有一套独特的精氨酸依赖型NO合成机制。L-精氨酸是生成多胺和NO等的前体物质,而多胺是与植物生长发育有直接关系的生物活性分子[24]。多胺和NO是参与植物发育和胁迫响应的多功能信号分子,这表明L-精氨酸可能会通过精氨酸代谢途径,在参与多胺和NO的生物合成平衡中扮演重要角色。本试验发现,对番茄的不同处理,显著影响了番茄NO释放量,改变了NOS和NR活性,而对精氨酸含量影响不显著,结果表明NOS和NR是NO合成途径之一。精氨酸含量可能受精氨酸代谢途径的影响而有所变化。

本试验通过对番茄在铜胁迫及外源NO对其缓解性研究,表明过量的铜会对植物细胞产生过氧化伤害,外源NO的施入通过提高NOS和NR活性调节内源NO代谢途径,从而缓解这一胁迫。精氨酸代谢与内源NO代谢紧密相关,NOS途径和NR途径间接与精氨酸合成有关。外源NO的施入对番茄植株内精氨酸含量产生影响,但可能由于精氨酸酶对精氨酸合成的直接作用而表现不明显。
[1] Wojcik M, Tukiendorf A. Response of wild type of Arabidopsis thaliana to copper stress [J]. Biologia Plantarum, 2003, 46: 79-83
[2] 秦毓茜, 李延红. 一氧化氮在植物中的生理作用[J]. 安徽农业科学, 2006, 34(9): 1802-1804
Qin Y Q, Li Y H. Role of nitric oxide in plant [J]. Journal of Anhui Agricultural Sciences, 2006, 34(9): 1802-1804 (in Chinese)
[3] Weitzberg E, Lundberg J O N. Nonenzymatic nitric oxide production in humans [J]. Nitric Oxide. 1998, 2: 1-7
[4] 崔秀敏, 吴小宾, 李晓云, 等. 铜、镉毒害对番茄生长和膜功能蛋白酶活性的影响及外源NO的缓解效应[J]. 植物营养与肥料学报, 2011, 17(2) : 349-357
Cui X M, Wu X B, Li X Y, et al. Responses of growth, functional enzyme activity in biomembrane of tomato seedlings to excessive copper, cadmium and the alleviating effect of exogenous nitric oxide [J]. Plant Nutrition and Fertilizer Science, 2011, 17(2): 349-357 (in Chinese)
[5] 张义凯, 崔秀敏, 杨守祥, 等. 外源NO对镉胁迫下番茄活性氧代谢及光合特性的影响[J]. 应用生态学报, 2010, 21(6) : 1432-1438
Zhang Y K, Cui X M, Yang S X, et al. Effects of exogenous nitric oxide on active oxygen metabolism and photosynthetic characteristics of tomato seedlings under cadmium stress [J]. Chinese Journal of Applied Ecology, 2010, 21(6): 1432-1438 (in Chinese)
[6] 赵世杰, 史国安, 董新纯. 植物生理学实验指导[M]. 北京: 中国科学技术出版社, 2002: 42-43
Zhao S J, Shi G A, Dong X C. Plant physiology experiment instruction [M]. Beijing: China Science and Technology Press, 2002: 42-43 (in Chinese)
[7] Patterson B D, Mackae E A, Mackae I B. Estimation of hydrogen peroxide in plant extracts using titanium (IV) [J]. Analytical Chemistry, 1984, 139: 487-492
[8] Sakaguehi S. A new method for the colorimetric determination of arginine [J]. Journal of Biochemistry, 1950, 37: 231-236
[9] 胡桂娟, 刘寄明, 剃嘉芬. 化学法测定精氨酸总量[J]. 落叶果树, 1995, 01: 22
Hu G J, Liu J M, Ti J F. Chemical method for determination of total arginine [J]. Deciduous Fruit, 1995, 01: 22 (in Chinese)
[10] Elstner E F, Heupel A. Inhibition of nitrite formation from hydroxylam inonium-chloride: A simple assay for superoxide dismutase [J]. Analytical Biochemistry, 1976, 70: 616-620
[11] Cakmak I, Marschner H. Magnesium deficiency and high light intensity enhance activities of superoxide dismutase, ascorbate peroxidase, and glutathione reductase in bean leaves [J]. Plant Physiology, 1992, 98: 1222-1227
[12] Murphy M E, Noack E. Nitric oxide assay using haemoglob in method [J]. Methods in Enzymology, 1994, 233: 240-250
[13] Neill S J, Desikan R, Hancock J T. Nitric oxide signaling in plants [J]. New Phytologist, 2003, 159: 11-35
[14] 史庆华, 赖齐贤, 朱祝军, 等. 一氧化氮在植物中的生理功能[J]. 细胞生物学杂志, 2005, 01: 39-42
Shi Q H, Lai Q X, Zhu Z J, et al. Physiological function of nitric oxide in plant [J]. Chinese Journal of Cell Biology, 2005, 1: 39-42 (in Chinese)
[15] Mocquot B, Vangronsveld J, Clijsters H, Mench M. Copper toxicity in yong maize (Zea mays L) plants: Effects on growth, mineral and chlorophyll contents, and enzymes activities [J]. Plant and Soil, 1996, 182: 287-300
[16] Onzounidou G,Moustakas M,Lannoye R. Chlorophyll fluorescence and photoacoustic characteristics in relationship to changes in chlorophyll and Ca2+content of a Cu2+- tolerant Silene compacta ecotype under Cu2+treatment [J]. Physiol Plant, 1995, 93: 551-557
[17] Weitzberg E, Lundberg J O N. Nonenzymatic nitric oxide production in humans [J]. Nitric Oxide, 1998, 2: 1-7
[18] Bethke P C, Badger M R. Jones R L. Apoplastic synthesis of nitric oxide by plant tissues [J]. The Plant Cell, 2004, 16: 332-341
[19] 苗雨晨, 董发才, 宋纯鹏. 过氧化氢—植物体内的一种信号分子[J]. 生物学杂志, 2001, 02: 4-6
Miao Y C, Dong F C, Song C P. Hydrogen peroxide-signal molecular in plants [J]. Journal of Biology, 2001, 02: 4-6 (in Chinese)
[20] 杨洪强, 高华君. 植物精氨酸及其代谢产物的生理功能[J]. 植物生理与分子生物学学报, 2007, 33(1): 1-8
Yang H Q, Gao H J. Physiological function of arginine and its metabolites in plants [J]. Journal of Plant Physiology and Molecular Biology, 2007, 33(1): 1-8 (in Chinese)
[21] Qiao W, Li C, Fan L M. Cross-talk between nitric oxide and hydrogen peroxide in plant responses to abiotic stresses [J]. Environmental and Experimental Botany, 2014, 100: 84-93
[22] Capone R, Tiwari B S, Lenine A. Rapid transmission of oxidative and nitrosative stress signals from roots to shoots in Arabidopsis [J]. Plant Physiology and Biochemistry, 2004, 42: 425-428.
[23] 高华君, 杨洪强, 杜方岭, 等. 平邑甜茶幼苗生长过程中精氨酸和一氧化氮水平的变化[J]. 植物营养与肥料学报, 2008, 14(4): 774-778
Gao H J, Yang H Q, Du F L, et al. Changes in arginine and nitric oxide levels in hupehensis Rehd. Seedlings during plant development [J]. Plant Nutrition and Fertilizer Science, 2008, 14(4): 774-778 (in Chinese)
[24] Gao H J, Yang H Q, Wang J X. Arginine metabolism in roots and leaves of apple (MalusdomesticaBorkh.): The tissue-specific formation of both nitric oxide and polyamines [J]. Scientia Horticulturae, 2009, 119(2): 147-152
[25] Morris Jr S M. Recent advances in arginine metabolism [J]. Current Opinion in Clinical Nutrition & Metabolic Care, 2004, 7(1): 45-51
[26] 赵福庚, 刘友良. 大麦幼苗多胺合成比脯氨酸合成对盐胁迫更敏感[J]. 植物生理学报, 2000, 26(4): 343-349
Zhao F G, Liu Y L. Synthesis of polyamine has more sensitivity than that of proline in barley seedling [J]. Acta Phytophysiologica Sinica, 2000, 26(4): 343-349 (in Chinese)
[27] Cheng L, Ma F, Ranwala D. Nitrogen storage and its interaction with carbohydrates of young apple trees in response to nitrogen supply [J]. Tree Physiol, 2004, 24: 91-98
[28] Modolo L V, Augusto O, Almeida I M G, et al. Decreased arginine and nitrite levels in nitrate reductase-deficient Arabidopsis thaliana plants impair nitric oxide synthesis and the hypersensitive response to Pseudomonas syringae [J]. Plant Science, 2006, 171(1): 34-40
[29] 张洪艳, 赵小明, 白雪芳, 等. 氮合成途径研究进展[J]. 西北植物学报, 2009, 29(7): 496-1506
Zhang H Y, Zhao X M, Bai X F, et al. Nitric oxide biosynthesis pathway in Plant [J]. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(7): 1496-1506 (in Chinese)
[30] Todd C D, Gifford D J. Loblolly pine arginase responds to arginine in vitro [J]. Planta, 2003, 217: 610-615
◆
StudyontheMetabolismPathwayofROSandNOofTomatoSeedlingsMediatedbyExogenousNOunderCopperIonStress
Wang Yijun, Li Xiaoyun, Wang Jian, Cui Xiumin*
College of Resources and Environment, Shandong Agricultural University, National Engineering Laboratory for Efficient Utilization of Soil and Fertilizer Resources, Tai’an 271018, China
29 April 2014accepted20 June 2014
By using solution culture method, this study investigated the effects of exogenous nitric oxide on reactive oxygen and the metabolism of NO of tomato seedling. The results showed that under copper ion stress, the production rate of oxygen radical both in leaves and roots of tomato seedlings increased,while the production of NO, the activities of NR and NOS in tomato seedling reduced. The application of nitric oxide promoted the activity of NOS in leaves and roots and activity of NR in leaves, thus increased the production of NO. Meanwhile, the exogenous NO significantly affected arginine metabolism and led to an upward tendency of arginine. Under the Cu+SNP+Hb treatment, Hb (the scavenger of NO) could partly counteract the effect of exogenous NO, which made arginine decrease. In conclusion, adding exogenous NO could improve the production of NO through enzymatic and non-enzymatic pathway, which mediated the NO signal networks regulating the metabolic pathway among the NO, reactive oxygen and arginine metabolism so as to relieve oxidative damage caused by excessive copper ion.
tomato; copper stress; nitric oxide; ROS; arginine; NO metabolism
2014-04-29录用日期:2014-06-20
1673-5897(2014)4-678-11
: X171.5
: A
崔秀敏(1977—),女,博士,副教授,植物营养机理与调控。
国家自然科学基金项目(31201619)和泰安市科技发展计划项目(32606)
王逸筠(1990-),女,硕士研究生;研究方向:植物营养机理与调控;E-mail:leixiaolei1@163.com
*通讯作者(Corresponding author),E-mail: xiumincui@sdau.edu.cn
10.7524/AJE.1673-5897.20140429001
王逸筠,李晓云,王 建,等. 外源NO介导Cu2+胁迫下番茄幼苗活性氧与内源NO代谢的研究[J]. 生态毒理学报, 2014, 9(4): 678-688
Wang Y J, Li X Y, Wang J, et al. Study on the metabolism pathway of ROS and NO of tomato seedlings mediated by exogenous NO under copper ion stress [J]. Asian Journal of Ecotoxicology, 2014, 9(4): 678-688 (in Chinese)
