腐殖酸作用下沉积物中纳米氧化铜对铜锈环棱螺生态毒性的影响
2014-09-27马陶武刘珊珊彭巾英
王 萌,马陶武,龙 奕,刘珊珊,刘 佳,彭巾英
吉首大学生物资源与环境科学学院,吉首 416000
腐殖酸作用下沉积物中纳米氧化铜对铜锈环棱螺生态毒性的影响
王 萌,马陶武*,龙 奕,刘珊珊,刘 佳,彭巾英
吉首大学生物资源与环境科学学院,吉首 416000
为了探讨不同水平腐殖酸作用下沉积物中纳米氧化铜(CuO-NPs)对底栖生物生态毒理学效应的影响,以铜锈环棱螺(Bellamyaaeruginosa)为受试生物,通过腐殖酸和CuO-NPs加标沉积物的慢性(28 d)生物测试,研究了肝胰脏中Cu的生物积累、Na+K+-ATP酶(ATPase)、超氧化物歧化酶(SOD)以及过氧化氢酶(CAT)活性的变化规律。结果表明,在低浓度CuO-NPs处理组(60 μg·g-1),沉积物中腐殖酸水平对Cu的生物积累以及ATPase、SOD和CAT活性均没有显著影响。在中、高浓度CuO-NPs处理组(≥180 μg·g-1),Cu的生物积累均随腐殖酸水平的增加而显著升高;肝胰脏ATPase活性随腐殖酸水平的增加而显著下降;当腐殖酸水平为0.05 g·g-1时,SOD活性显著高于未添加腐殖酸组,表现为显著诱导,当腐殖酸水平≥0.1 g·g-1时,SOD活性开始下降,并具有浓度依赖性;随腐殖酸水平的增加,肝胰脏CAT活性总体上表现为浓度依赖性显著下降。由于沉积物中腐殖酸的存在,显著增加CuO-NPs在沉积物中的分散稳定性,更容易被铜锈环棱螺摄取,从而通过增加CuO-NPs的生物积累而增强对铜锈环棱螺的生态毒性。
腐殖酸;纳米氧化铜;生物积累;ATP酶;抗氧化酶;沉积物;铜锈环棱螺
随着纳米材料的大量生产和广泛使用,人工纳米颗粒(engineered nanoparticles,ENPs)将不可避免地释放到环境中,成为一种新型污染物,极大地增加了人类和生态系统受到ENPs暴露的机会。由于水环境是所有污染物的最终沉积库,所以ENPs将最终归入水环境[1],并在沉积物中积累,对水生底栖生物构成潜在的威胁。由于ENPs特殊的理化性质和沉积物介质的复杂性,使得进入沉积物中纳米颗粒的生态毒理学问题变得更为复杂。水环境介质中诸多因素可能影响ENPs的性质,进而影响到ENPs对底栖生物的生物有效性和生态毒理学效应。ENPs的环境化学研究显示,天然有机大分子可以包被ENPs并使其稳定地分散在环境介质中[2-3];沉积物中有机质含量是影响ENPs迁移能力和环境行为的重要因素[4-7]。
溶解性有机质广泛存在于天然水环境中,腐殖酸(humic acid,HA)是其中尤为重要的组分。腐殖酸具有较强的络合、螯合、吸附和氧化还原能力,对有机、无机化合物在自然界的迁移、转化和归宿具有非常重要的影响[8]。
纳米氧化铜(CuO-NPs)是一类十分重要的纳米材料,由于其具有独特的高温超导性、电子关联效应(较窄的能带隙和自旋动力学特性)、极高的催化活性和抑菌作用[9-10],在工业上得到广泛的应用。目前,关于CuO-NPs的毒性和生态毒性效应已有一些报道,这些报道主要探讨了CuO-NPs对离体细胞、微生物、藻类、原生动物、甲壳动物、海生双壳类、两栖动物、哺乳动物以及高等植物的毒性和毒作用机理。研究显示,CuO-NPs的生物有效性和生物积累性高于常规氧化铜,如CuO-NPs可以积累在甲壳动物肠道内[11],尤其对于摄食颗粒的生物而言,CuO-NPs在肠内的生物有效性更高[12];还有研究指出CuO-NPs比Cu2+更容易进行生物积累[13];另有证据显示CuO-NPs比常规氧化铜和同类型的其它纳米颗粒的毒性更强[114]。然而目前基于底栖动物的有机质对沉积物中ENPs生态毒理学效应影响的研究还未见报道。
本研究以实验室培养的淡水腹足类底栖动物铜锈环棱螺(Bellamyaaeruginosa)为受试生物,以Cu的生物积累、能量生物标志物Na+K+-ATP酶(ATPase)、抗氧化生物标志物超氧化物歧化酶(SOD)和过氧化氢酶(CAT)作为测试指标,采用沉积物生物测试研究不同水平腐殖酸作用下沉积物CuO-NPs对铜锈环棱螺生态毒理学效应的影响,以期为合理评价沉积物中CuO-NPs的生态毒理学效应及其潜在生态风险提供科学依据。
1 材料与方法(Materials and methods)
1.1 实验动物
实验所用铜锈环棱螺(Bellamyaaeruginosa)为相同年龄,大小均匀的健康个体,年龄为4月龄、壳长为(16.28 ± 1.15)mm,体重为(1.24 ± 0.23)g,在实验室人工控制条件下按照Ma等的方法[15]进行培养。
1.2 实验沉积物
实验所用沉积物为采自湖南吉首市德夯自然保护区内的无污染自然沉积物。用塑料铲采集表层沉积物样品(0~10 cm厚度),然后用孔径0.2 mm的尼龙筛现场挤压过筛,去除杂物和粗颗粒,静置,倒掉上覆水,并将所采集的多个沉积物样品充分混合均匀,装入聚乙烯塑料袋中,运回实验室。分析表明,该沉积物由淤泥和粘土组成,分别占33.64%和66.36%,总有机碳TOC 4.48%,pH 7.78,总氮TN 1 064 mg·kg-1,总磷TP 1 215 mg·kg-1。
1.3 仪器与试剂
仪器:UV-757CRT 紫外可见分光光度计(上海精科);TGL-16M台式高速冷冻离心机(长沙平凡);电感耦合等离子体发射光谱仪(ICP-OES,iCAP6300 Radial,ThermoFisher Scientific,USA);玻璃匀浆器。
试剂:氧化铜纳米颗粒(CuO-NPs,CAS# 1317-38-0,40 nm,纯度99.5%,日本三菱);腐殖酸(天津市光复精细化工研究所);超微量ATP酶、超氧化物歧化酶与过氧化氢酶活性测定试剂盒以及蛋白测定试剂盒均购自南京建成生物工程研究所;蛋白酶抑制剂苯甲基磺酰氟(PMSF)购自Genview公司;蔗糖、Tris、EDTA-Na2及其它试剂均为国产分析纯。
1.4 实验设计
实验共设13个处理组,包括对照组;低(60 μg·g-1)、中(180 μg·g-1)和高浓度(540 μg·g-1)CuO-NPs单独处理组及分别与低(0.05 g·g-1)、中(0.1 g·g-1)和高浓度(0.2 g·g-1)腐殖酸的联合处理组,每个处理组设3个重复。加标前,先测定湿沉积物(以能搅动为宜)的干湿比,计算每个处理所需湿沉积物和相应CuO-NPs及腐殖酸的量,然后按CuO-NPs和腐殖酸的加标浓度称取CuO-NPs干粉和腐殖酸分别加入相应的沉积物中,在玻璃缸中用干净的小木铲边加边搅拌,加完后再持续搅拌至少1 h。加标玻璃缸在室温下储存30 d,在储存期间,每隔3 d对加标沉积物充分搅拌1次以使CuO-NPs和腐殖酸在沉积物中达到均匀分布。对照组沉积物除不加CuO-NPs和腐殖酸外,按相同方式处理。
实验开始前,按沉积物与上覆水体积比1∶4 的比例,将每个处理的测试沉积物分别加到相应的测试缸(4 L)中,然后加上覆水(去氯自来水)至满,加水过程尽可能减少对沉积物的扰动。所有测试缸置于一个水浴控温的有机玻璃容器中,静置24 h。实验开始时,将所选实验动物随机分配到每个测试缸中(10只/缸),采用上覆水连续更新的方式进行毒性测试[15]。暴露实验持续28 d,光照周期为12 h(白昼):12 h(黑暗),维持水温(24±1)℃。每日投喂人工饵料1次,每隔3 d检查1次水质。实验结束后,将实验螺取出,洗净,用钳子夹破螺壳,从内脏团中分离出肝胰脏,称重,将一部分个体的肝胰脏样品直接放入液氮中速冻保存,用于生化测定,另一部分保存于-20℃的冰箱中,用于测定Cu的生物积累。
1.5 生化测定
取冷冻的肝胰脏样品,按1∶4(g·mL-1)的比例加入含0.0001 mol·L-1EDTA-Na2、0.01 mol·L-1蔗糖和0.8% NaCl的Tris-HCl匀浆(0.01 mol·L-1、pH = 7.4)介质,同时加入苯甲基磺酰氟(PMSF终浓度为1 mmol·L-1),用玻璃匀浆器在冰浴下制成匀浆,然后于4℃、10 000 r·min-1下离心10 min,取上清液,即得20%的匀浆液,置液氮中保存备测,测定时用匀浆介质稀释到1%。采用钼蓝法测定Na+K+-ATPase活性;采用考马斯亮蓝法测定蛋白含量;采用羟胺法测定SOD活性;采用紫外分光光度法测定过CAT活性,具体测定操作和计算按南京建成生物工程研究所的试剂盒说明书进行。ATPase、SOD和CAT活性分别以活力单位U·mg-1、U·mg-1和U·g-1(以蛋白计)表示。
1.6 Cu生物积累测定
将肝胰脏在80℃下烘干,称重,采用HNO3-HClO4消解法[16]对组织样品进行消解,通过ICP-OES测定Cu的含量。同时采用标准物质贻贝(GBW08571,北京世纪奥科生物技术有限公司)进行质量控制,结果表明该方法具有良好的准确度和精密度。
1.7 统计分析
实验数据采用SPSS 20.0进行统计分析。对实验数据先进行正态分布检验,然后利用单因素方差分析法(ANOVA)和多重比较检验法(LSD)进行组间差异显著性检验,差异显著性水平为0.05,实验结果以平均值±标准差表示。
2 结果与分析(Results and analysis)
2.1 肝胰脏中Cu的生物积累
在不同腐殖酸水平下,28 d慢性暴露后,不同浓度CuO-NPs处理组中铜锈环棱螺肝胰脏Cu的生物积累情况见图1。总体上,各处理组Cu的含量是对照组(110.45 μg·g-1干重)的2~3倍,CuO-NPs暴露导致Cu在铜锈环棱螺肝胰脏中显著积累。在低浓度CuO-NPs处理组(60 μg·g-1),沉积物中腐殖酸水平对Cu的生物积累没有影响。在中、高浓度CuO-NPs处理组,未加腐殖酸时,Cu的生物积累不随CuO-NPs浓度的升高而增加,处于稳定水平(200 μg·g-1干重);当添加腐殖酸时,Cu的生物积累均随腐殖酸水平的增加而显著升高,最高值分别达到275.23和338.33 μg·g-1干重。
2.2 不同水平腐殖酸作用下CuO-NPs对铜锈环棱螺肝胰脏Na+K+-ATPase活性的影响
不同水平腐殖酸作用下CuO-NPs慢性暴露(28 d)对铜锈环棱螺肝胰脏Na+K+-ATPase活性的影响如图2所示。Na+K+-ATPase是主动运输所需要的特殊的运载酶,是生物体内重要的代谢酶之一,当生物受到生理胁迫时,ATPase活性会随之变化,ATPase活性是一个广泛用于评价污染压力的重要分子生态毒理学生物标志物。在低浓度CuO-NPs处理组(60 μg·g-1),与对照组(1.62 U·mg-1蛋白)相比,ATPase活性均表现为显著升高,但不同腐殖酸水平对ATPase活性没有影响。在中、高浓度CuO-NPs处理组,随腐殖酸水平的增加,ATPase活性均表现浓度依赖性显著下降,在最高腐殖酸水平(0.1 g·g-1)时,ATPase活性分别下降到1.25和0.74 U·mg-1蛋白,为对照组的77%和48%。
2.3 不同水平腐殖酸作用下CuO-NPs对铜锈环棱螺肝胰脏SOD活性的影响

图1 沉积物中不同腐殖酸水平作用下28 d暴露后铜锈 环棱螺肝胰脏中Cu的生物积累(在相同CuO-NPs浓度的不同 腐殖酸水平处理组标有不同字母表示差异显著, p<0.05,下同)Fig. 1 Bioaccumulation of Cu in the hepatopancreas of Bellamya aeroginosa following 28-d exposure to sediments with different humus acid (HA) levels (HA Treatments with same CuO-NPs concentration labeled with different letters differed significantly, p < 0.05. The same below)

图2 沉积物中不同腐殖酸水平作用下28 d 暴露后铜锈环棱螺肝胰脏Na+K+-ATPase活性Fig. 2 Na+K+-ATPase activities in the hepatopancreas of Bellamya aeroginosa following 28-d exposure to sediments with different humus acid (HA) levels
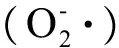
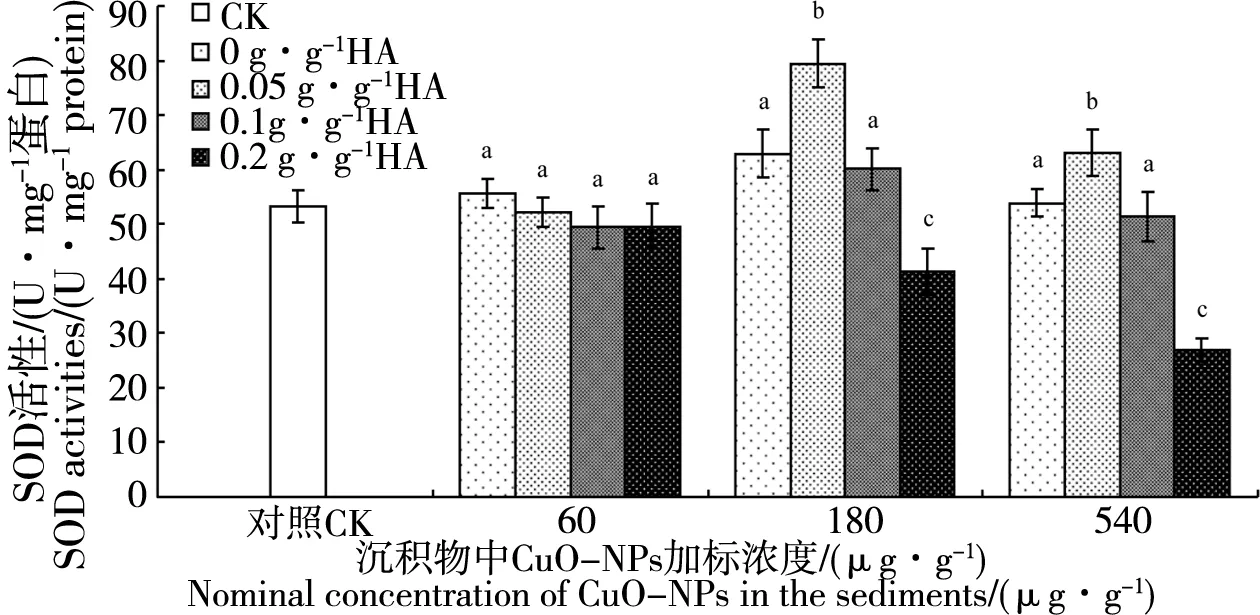
图3 沉积物中不同腐殖酸水平作用下28 d 暴露后铜锈环棱螺肝胰脏SOD活性Fig. 3 SOD activities in the hepatopancreas of Bellamya aeroginosa following 28-d exposure to sediments with different humus acid (HA) levels
2.4 不同水平腐殖酸作用下CuO-NPs对铜锈环棱螺肝胰脏CAT活性的影响
不同水平腐殖酸作用下CuO-NPs慢性暴露(28天)对铜锈环棱螺肝胰脏CAT活性的影响如图4所示。CAT也是生物体内抗氧化防御系统中的关键酶类之一,主要将H2O2转化为H2O, CAT亦常与SOD一起用作指示环境污染胁迫的重要生物标志物。低浓度CuO-NPs处理组(60 μg·g-1)的CAT活性与对照组相比差异不显著,而且沉积物中腐殖酸水平对CAT活性也没有影响。在中、高浓度CuO-NP处理组,随腐殖酸水平的增加,CAT活性总体上表现为浓度依赖性下降。当腐殖酸水平为0.1和0.2 g·g-1时,CAT活性随CuO-NPs浓度的增加均呈现急剧下降的趋势,分别为对照组的55%和40%。
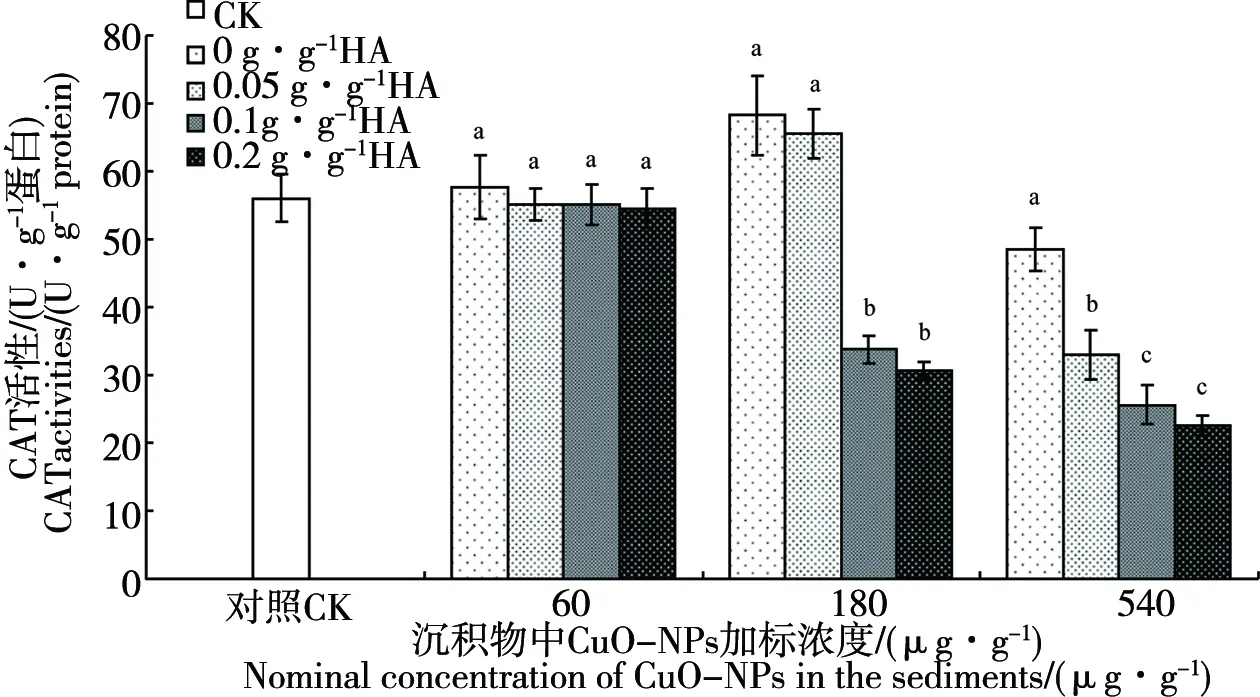
图4 沉积物中不同腐殖酸水平作用下28 d 暴露后铜锈环棱螺肝胰脏CAT活性Fig. 4 CAT activities in the hepatopancreas of Bellamya aeroginosa following 28-d exposure to sediments with different humus acid (HA) levels
3 讨论(Discussion)
有研究指出天然有机质的存在可以增强ENPs对测试生物的毒性。Lin等的研究[7]发现天然有机质的存在显著增大了碳纳米颗粒的毒性。金霏霏等[17]研究了不同浓度HA对ZnO-NPs毒性效应的影响,发现HA浓度的增加明显促进ZnO-NPs对鲫鱼肝脏和脑部的氧化损伤。本研究显示,在0.05~0.2 g·g-1腐殖酸水平范围内,沉积物中低浓度的CuO-NPs(60 μg·g-1)对铜锈环棱螺肝胰脏ATPase、SOD和CAT活性几乎没有影响;而当沉积物中的CuO-NPs浓度较高(≥180 μg·g-1)时,3种酶的活性均随腐殖酸水平的增加明显降低,提示在腐殖酸存在的情况下,CuO-NPs对铜锈环棱螺肝胰脏细胞产生了明显的氧化胁迫,因此沉积物中较高水平的腐殖酸可以增强CuO-NPs对铜锈环棱螺的肝胰脏毒性。这与前述研究的结果基本一致。朱江等利用大型溞(Daphniamagna)研究了沉积物中腐殖质对铜毒性的影响[18],发现沉积物间隙水中铜离子对大型溞的毒性随沉积物中腐殖质含量的升高而减弱,但随沉积物中总铜含量的增加而增强,这说明,沉积物中铜离子和CuO-NPs对生物的生态毒性影响机制是不同的,也与生物种属有关。腐殖质是金属在沉积物中的主要吸附相[19-20],铜在沉积物中能与腐殖质形成竞争性的有机络合物[21],沉积物中腐殖质的浓度会影响金属在沉积物/间隙水相间的分配,引起间隙水中有关化合物浓度的变化,最终影响间隙水对大型溞的毒性。而Chen & Elimlech[2]和Giashuddin等[3]指出,天然有机大分子可以包被ENPs并使其稳定地分散在环境介质中;Hyung等的研究[22]证实,腐殖质可以在C60-NPs和碳纳米管的表面形成表面包被,这种表面包被通过增加静电排斥作用抑制了ENPs的团聚,从而增加了ENPs在介质中的分散稳定性。因此,测试体系中ENPs的分散效果及对生物的毒性在很大程度上受介质中有机质水平的影响。在本研究中,在CuO-NPs中、高浓度处理组,铜锈环棱螺肝胰脏Cu的生物积累随腐殖酸水平的增加而显著升高,这是由于腐殖酸的存在,显著增加CuO-NPs在沉积物中的分散稳定性,更容易被铜锈环棱螺摄入,从而通过增加CuO-NPs的生物积累而增强对铜锈环棱螺的毒性。因此,腐殖酸对沉积物中ENPs生态毒理学效应的影响与腐殖酸的水平和ENPs的浓度均有关。因此在关注ENPs的潜在生态风险时,应当考虑相关环境因子的影响。
[1] Kaegi R, Ulrich A, Sinnet B, et al. Synthetic TiO2nanoparticle emission from exterior facades into the aquatic environment [J]. Environmental Pollution, 2008, 156(2): 233-239
[2] Chen K L, Elimelech M. Influence of humic acid on the aggregation kinetics of fullerene (C60) nanoparticles in monovalent and divalent electrolyte solutions [J]. Journal of Colloid and Interface Science, 2007, 309(1): 126-134
[3] Giashuddin A B M, Kanel S R, Choi H. Adsorption of humic acid onto nanoscale zerovalent iron and its effect on arsenic removal [J]. Environmental Science & Technology, 2007, 41(6): 2022-2027
[4] Ghosh S, Mashayekhi H, Pan B, et al. Colloidal behavior of aluminum oxide nanoparticles as affected by pH and natural organic matter [J]. Langmuir, 2008, 24(21): 12385-12391
[5] Domingos R F, Tufenkji N, Wilkinson K J. Aggregation of titanium dioxide nanoparticles: Role of a fulvic acid [J]. Environmental Science & Technology, 2009, 43(5): 1282-1286
[6] Baalousha M. Aggregation and disaggregation of iron oxide nanoparticles: Influence of particle concentration pH and natural organic matter [J]. Science of The Total Environment, 2009, 407(6): 2093-2101
[7] Lin S, Reppert J, Hu Q, et al. Uptake, translocation, and transmission of carbon nanomaterials in rice plants [J]. Small, 2009, 5(10): 1128-1132
[8] 刘亚子, 高占启. 腐殖质提取与表征研究进展[J]. 环境科技, 2011, 24(Supp.1): 76-80
Liu Y Z, Gao Z Q. Progress in research on extraction and characterization of humus [J]. Environmental Science & Technology, 2011, 24(Supp.1): 76-80 (in Chinese)
[9] Tranquada J M. Charge stripes and spin correlations in copper-oxide superconductors [J]. Physica C: Superconductivity, 1997, 282-287, Part 1: 166-169
[10] Yamaura K, Huang Q, Cava R J. Synthesis, crystal structure, electrical, and magnetic properties of the new layered cobalt oxides (Sr, Ca, Ln)3Co2O6±δ [J]. Journal of Solid State Chemistry, 1999, 146(1): 277-286
[11] Blinova I, Ivask A, Heinlaan M, et al. Ecotoxicity of nanoparticles of CuO and ZnO in natural water [J]. Environmental Pollution, 2010, 158(1): 41-47
[12] Heinlaan M, Kahru A, Kasemets K, et al. Changes in theDaphniamagnamidgut upon ingestion of copper oxide nanoparticles: A transmission electron microscopy study [J]. Water Research, 2011, 45(1): 179-190
[13] Buffet P E, Tankoua O F, Pan J F, et al. Behavioural and biochemical responses of two marine invertebratesScrobiculariaplanaandHedistediversicolorto copper oxide nanoparticles [J]. Chemosphere, 2011, 84(1): 166-174
[14] Karlsson H L, Cronholm P, Gustafsson J, et al. Copper oxide nanoparticles are highly toxic: A comparison between metal oxide nanoparticles and carbon nanotubes [J]. Chemical research in toxicology, 2008, 21(9): 1726-1732
[15] Ma T W, Gong S J, Zhou K, et al. Laboratory culture of the freshwater benthic gastropodBellamyaaeruginosa(Reeve) and its utility as a test species for sediment toxicity [J]. Journal of Environmental Sciences, 2010.22(2): 304-313
[16] 吴春红, 薛晶, 杨建明, 等. 用钉螺作为指示生物监测其孳生地重金属污染状况[J]. 湖北大学学报(自然科学版), 2007, 29(1): 96-98
Wu C H, Xue J, Yang J M, et al.Oncomelinahupensisas an indictor to monitor the pollution of heavy metals in soil [J]. Journal of Hubei University (Natural Science), 2007, 29(1): 96-98 (in Chinese)
[17] 金霏霏, 尹颖, 黄娟, 等. 腐殖酸(HA)作用下纳米氧化锌对鲫鱼的毒性效应[J]. 应用与环境生物学报, 2011, 17(6): 829-832
Jin F F, Yin Y, Huang J, et al. Effect of HA on ecotoxicity of NanoZnO inCarassiusauratus[J]. Chinese Journal of Applied and Environmental Biology, 2011, 17(6): 829-832 (in Chinese)
[18] 朱江, 侯海瑛, 葛虹, 等. 沉积物中腐殖质对铜毒性的影响[J]. 应用与环境生物学报, 2003, 9(6): 631-634
Zhu J, Hou H Y, Ge Hong, et al. Effect of humus on toxicity of copper in sediment [J]. Chinese Journal of Applied & Environmental Biology, 2003, 9(6): 631-634 (in Chinese)
[19] Marshall S J, House W A, Russell N J, et al. Comparative adsorption of natural and commercially available humic acids to river sediments [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 1998, 144(1-3): 127-137
[20] Wasserman J C, Oliverira F B L, Bidarra M. Cu and Fe associated with humic acids in sediments of a tropical coastal lagoon [J]. Organic geochemistry, 1998, 28(12): 813-822
[21] Laxen D P H. Trace metal adsorption/ coprecipition on hydrous ferric oxide under realistic conditions-The role of humic substance [J]. Water Research, 1985, 19(10): 1229-1236
[22] Hyung H, Kim J H. Natural organic matter (NOM) adsorption to multi-walled carbon nanotubes: Effect of NOM characteristics and water quality parameters [J]. Environmental Science & Technology, 2008, 42(12): 4416-4421
◆
ImpactsofHumicAcidonEcotoxicityofCuONanoparticleinBellamyaaeruginosaundertheSedimentScenario
Wang Meng, Ma Taowu*, Long Yi, Liu Shanshan, Liu Jia, Peng Jinying
College of Biology and Environmental Science, Jishou University, Jishou 416000, China
15 April 2014accepted23 May 2014
The effects of with humic acid (HA) and CuO nanoparticles (CuO-NPs) in sediments on Cu accumulation, Na+K+-ATPase, SOD, and CAT activities in the hepatopancreas ofBellamyaaeruginosafollowing a 28-d chronic bioassay were investigated to get insight into the ecotoxicological effects of CuO-NPs in sediments with various gradient of HA on benthic macroinvertebrates. The results indicated that, at low concentration of CuO-NPs (60 g·g-1), the content of HA had no effects on the hepatopancreatic Cu accumulation, Na+K+-ATPase, SOD, and CAT activities. At CuO-NPs concentration of 180 g·g-1or above, Cu accumulation raised significantly with increase of HA content, however ATPase activities decreased significantly when enhancing HA content. At HA content of 0.05 g·g-1, SOD activities were significantly higher than that in the free HA groups, indicating a marked induction. However, at HA content of 0.1 g·g-1or above, SOD activities showed a content-dependent decline of HA. Generally, the hepatopancreatic CAT activities increased significantly with increase of HA content. The HA in sediments could reduce the aggregation of CuO NPs and enhance its homogeneous dispersion, which facilitated ingestion of CuO-NPs byB.aeroginosa, so the increased Cu accumulation enhanced its ecotoxicity.
humic acid; CuO nanoparticles; bioaccumulation; Na+K+-ATPase; antioxidant enzyme; sediments;Bellamyaaeruginosa
2014-04-15录用日期:2014-05-23
1673-5897(2014)4-803-06
: X171.5
: A
马陶武(1968—),男,博士,教授,主要研究方向为水生态毒理学,发表论文40余篇。
国家自然科学基金项目(No. 41171383)
王萌(1988-),男,硕士研究生,研究方向为生态毒理学,E-mail:wangmeng433101@126.com;
*通讯作者(Corresponding author),E-mail: mtw922@163.com
10.7524/AJE.1673-5897.20140415001
王 萌, 马陶武, 龙 奕, 等. 腐殖酸作用下沉积物中纳米氧化铜对铜锈环棱螺生态毒性的影响[J]. 生态毒理学报, 2014, 9(4): 803-808
Wang M, Ma T W, Long Y, et al. Impacts of humic acid on ecotoxicity of CuO nanoparticle inBellamyaaeruginosaunder the sediment scenario [J]. Asian Journal of Ecotoxicology, 2014, 9(4): 803-808 (in Chinese)
