铜对水生生物的毒性:类群特异性敏感度分析
2014-09-27金小伟王子健
王 振,金小伟,王子健
1. 香港大学太古海洋科学研究所与生物科学学院,香港2. 中国环境监测总站,北京1000123. 中国科学院生态环境研究中心,北京100085
铜对水生生物的毒性:类群特异性敏感度分析
王 振1,金小伟2,*,王子健3
1. 香港大学太古海洋科学研究所与生物科学学院,香港2. 中国环境监测总站,北京1000123. 中国科学院生态环境研究中心,北京100085
铜的毒性因受多种环境因素(如温度、pH等)的影响,其水质基准和标准经历过多次修改。由于不同区系生物受生活环境等因素的影响,不同物种对铜的耐受性和敏感度上存在很大的差异。本文通过构建类群特异性敏感度分布,以及对10%安全浓度值(10% hazardous concentration,HC10)及其95%置信区间(95% confidence interval,95%CI)的比较,分析了铜对淡水和海水各类群的敏感度差异,以期为我国在制定相关水质基准的物种选择上提供参考。结果显示,淡水系统中藻类为对铜毒性最敏感类群,其次为甲壳类,软体动物类,鱼类,寡毛类,而昆虫类为对铜的最耐受类群。海水各类群对铜的敏感度顺序与淡水类似,只是在寡毛类和鱼类顺序上有所不同。相对于海洋物种,淡水水体生物总体上比海水中各相应类群生物对铜更为敏感。
铜;淡水生物;海水生物;类群特异性;物种敏感度分布
铜是维持生命所必需的微量营养元素,尤其在机体细胞代谢中起到重要的作用[1]。低剂量的铜对生物生长发育等生命过程中可起到保护、促进作用。同时,铜对藻类和菌类具有高毒性,低剂量的硫酸铜 (CuSO4) 在鱼类养殖中常被用来作为一种杀藻剂和防虫剂,以防止由藻,轮虫,枝角类和桡足类生物所引起的疾病、毒害等[2-3]。当水环境中铜的浓度超过生物所需浓度的10至50倍时,会在水生生物体内产生过量的自由基,并对蛋白质、氨基酸和脂肪等产生氧化损伤,或者通过影响生物对二价元素,如钙、镁的吸收影响水生生物的生长、发育、繁殖和行为,甚至产生致死等毒性效应[4-7]。由此可见,即使铜可作为水生生物生命活动的必需元素,一旦达到一定的浓度即可成为环境污染物。因此在自然环境中铜的暴露浓度以及生物可利用度非常重要。铜在天然海水和淡水环境中的浓度分别为0.03~0.23 μg·L-1(海水)、0.20~30 μg·L-1(淡水)[8],而人为输入水体中的铜可能高达100 μg·L-1[9],在一些矿区甚至可达到200 000 μg·L-1[10]。为了保护淡水和海水水生生物安全,不同国家、地区相继颁布了一系列铜的水质基准和水质标准文件[11-13]。
生物区系是水质基准研究的重要内容,也是水质基准需要保护的对象。习惯上通常采用全部生物类群作为受体,通过保护大部分生物的方式来确定水质基准的数值。这种做法并不考虑不同物种的生态地位和经济价值,基准制定中对所有生物的权重是等同的。在实践中,一方面希望利用铜的毒性来控制藻华的大量爆发;另一方面又在基准制定中考虑铜对藻类的毒性,显然存在矛盾。因此从中国的国情出发,制定水质基准和标准必须考虑水生生物的不同类群的生态地位和当前的重点保护对象[14-16]。Maltby等研究了16种杀虫剂,指出物种的种类对于构建物种敏感度分布曲线(用于推导水质基准)具有显著的影响[17]。吴丰昌等研究物种对锌的敏感度分布中发现,甲壳类对锌最为敏感,而鱼类次之[18]。因此不同类群的生物对同一污染物的敏感性差异亦是水质基准制定时所需考虑的重要因素之一。关于铜对水生生物毒性的报道很多[8, 19],王振等对温带和热带不同地理区域生物敏感度差异性作了探讨分析,同时也发现不同类群生物对不同的化学物存在很大的差异性[20]。
为了进一步分析不同类群对铜的敏感度差异,本研究搜索数据库中所有铜对淡水、海水物种急性毒理数据 (1970-2014年),建立类群特异性SSD并通过比较推导出的10%危险浓度 (hazardous concentration,HC10) 及其95% 置信区间 (confidence interval,95%CI)而分析各类群对铜的敏感度情况。另外,同一生物类群在不同生态系统 (淡水和海水) 的敏感度情况也进行了比较。本文亦尝试通过对各物种对铜的不同生理、生化等反应,分析讨论引起类群敏感度差异的可能机制。本研究以期为铜的水质基准建立时的类群选取上提供研究基础和理论依据,同时也为其他毒物的类群敏感度分析提供方法支持。
1 方法(Methods)
1.1 数据收集及处理
数据主要来源于ECOTOX毒性数据库 (http://www.epa.gov/ecotox/) 和已发表的文献,数据收集截止到2014年。本研究只收集4 d内藻类半抑制浓度 (median effective concentration,EC50) 和水生动物半致死浓度 (median lethal concentration,LC50) 数据。对于搜集的毒性数据,依据“可靠性”和“相关性”的原则进行严格筛选[21-23]:1) 剔除不满足水质基准技术要求的数据,如无对照试验、暴露时间不规范、无相关水质因子数据、稀释水不合格、试验设计不规范等;2) 对受试物种试验地点与物种来源不符的数据 (如温带的急性数据的受试物种来源于热带,或热带急性数据的受试物种来源于温带) 也均予剔除[24]。如果某一物种的特定测试终点存在多个数据时,用几何平均的方法进行数据整理。筛选后的数据,按照物种所属类群划分类群特异性数据库,如藻类 (algae),甲壳类 (crustaceans),两栖类 (amphibians),鱼类 (fish),软体动物类(molluscs),寡毛类 (worms) 和昆虫类(insects)。对于各类群中可能存在的异常值 (极大或极小值),通过Grubb’s检验或Tietjen-Moore检验[25-26]进行分析,所检测到的异常值均予剔除。
1.2 类群特异性SSD的建立及比较
SSD的建立采用序列百分数法,对所有数据从小到大排列,按公式R/(N+ 1) 计算序列百分数,其中:R是毒性数据在序列中的位置,N是所获得的毒性数据量[22]。对于得到的淡水、海水类群SSD,利用以下两种方法对各种群SSD曲线进行比较[20, 27]:(1) 直接观察法:对SSD低端10%处的比较 (越靠近y轴,物种越敏感); (2) 协方差分析法 (analysis of covariance, ANCOVA; SPSS, Chicago, IL, USA):各相应曲线进行线性拟合(y=ax+b) 后对斜率a和y轴截距b的比较 (α= 0.05)。
1.3HC10(95%CI) 的推导及类群敏感度差异性分析
本研究采用5种国际常用模型对各SSD进行拟合,包括:log-normal 模型、log-logistic模型、Gompertz模型、Fisher-Tippett模型、Weibull模型。由于不同的拟合模型对HC10值的推导具有差异性[20, 28],因此,通过对以上5种拟合模型的参量对比,选择出各SSD的“最佳”拟合模型:即同时通过Shapiro-Francia (SF)检验[29]和Anderson-Darling (AD) 检验[30]且具有最小均方根值 (Root Mean Square, RMS)[31]。由“最佳”拟合模型得到的各类群的HC10及其95%CI,通过Graph Pad PrismTM(Version 5.00, San Diego, CA) 中的单因素方差分析 (one-way analysis of variance, ANOVA) 比较各HC10值是否存在显著性差异 (α= 0.05),即类群敏感度差异。
2 结果与讨论(Results and discussion)
2.1 淡水生物类群敏感度差异分析
依据毒性数据的筛选原则,共整理151个铜对淡水水生生物的急性毒性数据,其中包括11个藻类数据,38个甲壳类数据,7个两栖类数据,27个软体动物数据,51个鱼类数据,7个寡毛类数据和10个昆虫类数据。铜对淡水水生生物不同类群敏感度分布如图1所示,结果显示淡水藻类SSD在最左侧,即为最敏感类群;水生昆虫类SSD曲线在最右侧,即为最不敏感类群。基于ANCOVA分析和构建SSD推导HC10值(表1)比较结果显示:1)藻类HC10(95%CI; μg·L-1) 为6.1 (2.8, 13),明显小于昆虫类HC10值 (p<0.05;表1) ;2)鱼类和昆虫类具有相同斜率a(p>0.05),但具不同y-截距b(p<0.05)。而其余各类群SSD曲线存在相互交叉现象(低端、中端或高端;见图1),这也可通过各SSD曲线的ANCOA分析可知,即各曲线线性拟合后的斜率存在显著性差异(p<0.05)。通过对物种敏感度分布以及HC10值的比较 (ANOVA) 发现,淡水类群对铜的敏感度趋势为:藻类>甲壳类>软体动物类 = 鱼类>昆虫类 (p<0.05;表1)。其中藻类对铜最为敏感,两栖类对铜的敏感度与甲壳类相似;寡毛类对铜的敏感度与鱼类相似,却与软体动物类明显不同 (p<0.05)。

表1 淡水类群特异性10% 危险浓度 (HC10) 及其95%置信区间 (95%CI)Table 1 Freshwater taxon-specific 10% hazardous concentration (HC10) and its 95% confidence interval (95% CI)
注:*单因素方差分析,α=0.05;各类群HC10(95%CI) 值由“最佳”拟合模型推导得出:即同时通过Shapiro-Francia检验和Anderson-Darling检验,且具有最小均方根值 (Root Mean Square,RMS)。N为各类群中物种数目。下表同。
Note: *One-way analysis of variance (ANOVA),α=0.05;95% Cofidence interval (95%CI) was from the best fit model which must pass both Shapiro-Francia and Anderson-Darling tests, and have the minimum root mean square (Min-RMS).Nindicates sample size. The Same as follows.
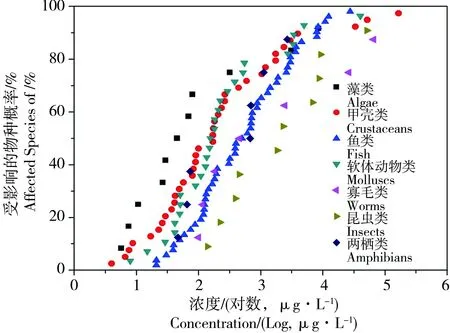
图1 淡水类群特异性物种敏感度分布 SSD中不同符号代表不同类群(见图注)Fig. 1 Freshwater taxon-specific species sensitivity distribution (SSD). Symbols for taxonomic groups are given in the right key.
2.2 海水生物类群敏感度差异分析
依据毒性数据的筛选原则,共整理232个铜对海水水生生物的急性毒性数据,其中包括35个藻类数据,84个甲壳类数据,51个软体动物数据,49个鱼类数据,14个寡毛类数据。铜对海水水生生物不同类群敏感度分布,如图2所示,海水藻类对铜最为敏感(SSD曲线在最左侧),鱼类相对较不敏感(SSD曲线在最右侧)。这一点亦可通过ANCOVA分析可得:具有相同斜率a(p>0.05),但具不同y-截距b(p<0.05)。而甲壳类SSD曲线在软体动物类SSD曲线左侧,表明甲壳类比软体动物类对铜更敏感。通过对物种敏感度分布以及HC10值的比较 (ANOVA) 发现,海水类群对铜的敏感度趋势为:藻类>甲壳类>软体动物类>寡毛类>鱼类(p<0.05;表2)。海水藻类最为敏感,无脊椎动物动物的敏感度相似,而海水鱼类对铜最不敏感。
2.3 铜对水生生物的制毒机制
在环境因素中铜对水生生物的毒性以及生物利用度取决于铜的总浓度及其形态[32]。在重度或者中度污染的水体中,43%~88%的铜被吸附在悬浮颗粒而不能对生物所利用[33]。水中的生物有效态铜主要是溶解性铜离子(Cu2+)和可能的一些羟基络合物[7, 32]。总溶解性铜中通常包括与碳酸酯,氨基酸,或腐殖物质相结合的铜,其中毒性最强的Cu2+占0.1~0.2%[33]。而络合态或者吸附形式的铜的毒性均小于自由态铜的毒性[32]。对于淡水生物,游离铜通过物理传输进入细胞最先与质膜结合,增加了质膜的渗透性,造成钾以及其他离子的流失[34]。铜离子对藻类可能的制毒机理大体总结为:1)破坏细胞膜;2)进入细胞内后破坏蛋白质、酶等。当铜离子一旦进入藻细胞后,立刻进攻细胞蛋白质内含硫的氨基酸,使得光合作用不能正常进行,藻细胞由此死亡。铜离子可以迅速被细胞表面吸附,缓慢渗入细胞内部,与有机物形成的络合物或盐可以加速这种渗入,而进入细胞内部的金属离子可以干扰各种酶的作用,使其失去应有的生物功能,从而导致细胞的死亡[8, 35]。对于水生脊椎动物,高浓度的铜容易造成腮的损伤[36]。如蟹的腮部是铜中毒的重要部位,水溶性铜降低了血蓝蛋白的氧的亲和力[37]。高浓度铜暴露下蟹致死效应与糖酵解酶的活性有关,但并不像鱼涉及到细胞能量的损失[38]。日本曾进化了水生蜉蝣的铜耐受菌株,其耐受性是由于诱导铜与蛋白螯合的能力远超过镉和锌等其他金属[39]。对于鱼类,腮表面对金属的低亲和力允许更多的金属进入细胞内腔,并形成更复杂的结合位点,可能形成的制毒机制包括:1)与生物体内的巯基结合,阻断生物分子的基本生物官能团;2)抑制生命必须元素如钙、镁的摄入;3)修饰生物分子的活性构象。这些机制可以解释离子铜(Cu2+)暴露后传输抑制的特异性[40]。Reid等[40]通过对虹鳟鱼的研究表明其外部鳃上皮表面对铜具有较低的亲和性,使铜容易渗入细胞内的隔间。铜通过损害跨上皮的离子交换(如通过抑制主动吸收或刺激被动损失妨碍或扰乱电解质平衡)破坏虹鳟鱼鳃的功能。铜在鱼组织累积且长期保留的特点是其较高的持久性以及可能与非交换性或者缓慢可交换性的蛋白相结合[41]。在鱼体内铜解毒机制包括金属硫蛋白的诱导等[41-43]。个别鱼类肝脏的金属硫蛋白含量通常反映铜在该器官的积累状况,这也证明可以使用金属硫蛋白作为铜胁迫的生物指示物[42]。从铜对不同营养层生物的毒理机制研究发现,铜对不同类群生物的致毒机制不尽相同,这种差异影响了铜生态毒性的物种敏感度分布。

图2 海水类群特异性物种敏感度分布 SSD中不同符号代表不同类群(见图注)Fig. 2 Marine taxon-specific species sensitivity distribution (SSD). Symbols for taxonomic groups are given in the right key.
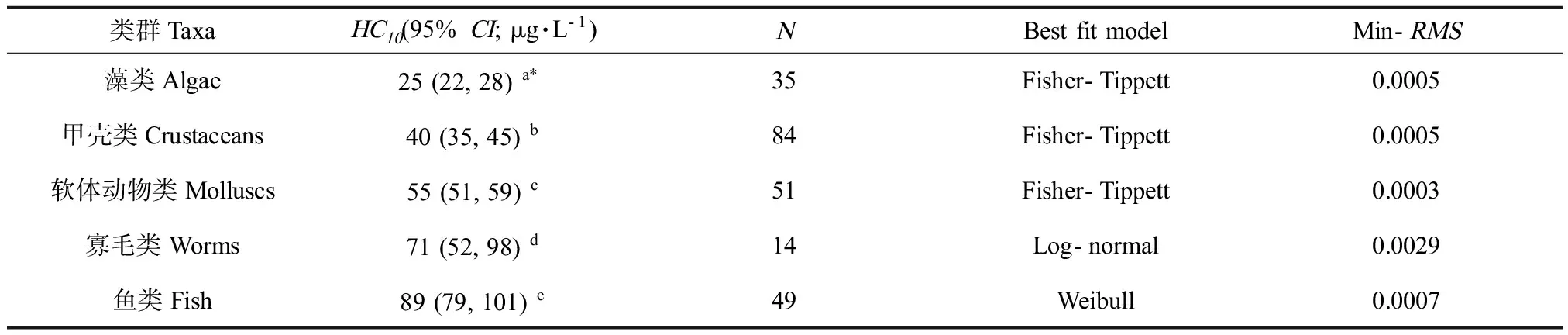
表2 海水类群特异性10% 危险浓度 (HC10) 及其95%置信区间 (95%CI)Table 2 Marine taxon-specific 10% hazardous concentration (HC10) and its 95% confidence interval (95% CI)
注:*单因素方差分析,α=0.05。
Note: * One-way analysis of variance (ANOVA),α=0.05.
2.4 淡水和海水各类群敏感度差异分析
通过对比各类群在淡水和海水中的HC10值 (表1和2) 发现,淡水各类群均比相应各类群在海水系统中对铜更敏感。如海水藻类HC10值为淡水藻类的4.1倍 (最大差距),海水寡毛类HC10值为淡水的1.6倍 (最小差距)。该结果与Wheeler[44]中结果相似,即淡水物种比海水物种对铜更敏感。这有可能由以下3方面原因:1) 海水和淡水各类群本身差异性;另外,海水生物具有比淡水生物更强的铜代谢能力而使其对铜更耐受[45]。2) 铜在海水和淡水中的游离态形式的差异而导致物种对其吸收和累积效应的不同:如淡水体系更易使铜呈现出游离态而增加物种的吸收和累积[46, 47]。3) 不同的试验体系 (海水或淡水) 而导致的毒性差异性:如海水的高盐度可致使铜在其试验系统中因具有较低的溶解度 (即较低的游离态) 而降低其对海水生物的毒性[27, 44]。
综上所述,可以得出以下结论:
(1)通过对物种敏感度分布以及HC10值的比较 (ANOVA) 发现,淡水类群对铜的敏感度趋势为:藻类>甲壳类>软体动物类 = 鱼类>水生昆虫类,海水类群对铜的敏感度趋势为:藻类>甲壳类>软体动物类>寡毛类>鱼类;藻类对铜最为敏感,鱼对铜最不敏感;通过对比各类群在淡水和海水中的HC10值 (表1和2) 发现,淡水各类群均比相应海水各类群对铜更敏感。
(2)从铜对不同营养层生物的毒理机制研究发现,铜对不同类群生物的致毒机制不尽相同,这种差异影响了铜生态毒性的物种敏感度分布。考虑到中国水体较为严重的富营养化现象,水中的铜对藻类生长有一定抑制作用。
[1] Festa R A, Thiele D J. Copper: An essential metal in biology [J]. Current Biology, 2011, 21(21): 877-883
[2] Tucker C S, Robinson E H. Channel Catfish Farming Handbook [M]. Van-Nostrand-Reinhold, New York, USA, 1990
[3] Boyd C E. Water Quality in Ponds for Aquaculture [M]. Birmingham Publishing Co., Birmingham, Alabama, USA, 1990
[4] Wurts W A, Perscbacher P W. Effects of bicarbonate alkalinity and calcium on the acute toxicity of copper to juvenile channel catfish (Ictaluruspunctatus) [J]. Aquaculture, 1994, 125: 73-79
[5] Abdel-Tawwab M, Mousa M A A, Abbass F E. Growth performance and physiological response of African catfish,Clariasgariepinus(B.) fed organic selenium prior to the exposure to environmental copper toxicity [J]. Aquaculture, 2007, 272(1-4): 335-345
[6] Burba A. The effect of copper on behavioural reactions of Noble crayfishAstacusastacusL. [J]. Acta Zoologica Lituanica, 1999, 9(2): 30-36
[7] Hall L W, Scott M C, Killen W D. Ecological risk assessment of copper and cadmium in surface waters of Chesapeake Bay watershed [J]. Environmental Toxicology and Chemistry, 1998, 17(6): 1172-1189
[8] Flemming C, Trevors J. Copper toxicity and chemistry in the environment: A review [J]. Water, Air, and Soil Pollution, 1989, 44(1-2): 143-158
[9] Nriagu J O. Copper in the Environment. Part I: Ecological Cycling [M]. John Wiley & Sons, 1979
[10] Davis A, Ashenberg D. The aqueous geochemistry of the Berkeley pit, Butte, Montana, USA [J]. Applied Geochemistry, 1989, 4(1): 23-36
[11] US EPA. Aquatic Life Ambient Water Quality Criteria: Copper. EPA-822-R-07-001 [R], National Technichal Information Service, Springfield, VA., 2007
[12] ANZECC & ARMCANZ. Australian and New Zealand Guidelines for Fresh and Marine Water Quality [R]. Canberra, Australia; Australian and New Zealand Environmentent and Conservation Council and Agriculture and Resource management Council of Australia and New Zealand. 2000
[13] CCME. A Protocol for the Derivation of Water Quality Guidelines for the Protection of Aquatic Life [R]. Canadian Council of Ministers of the Environment, Winnipeg, 2007
[14] Jin X, Wang Y, Giesy, J P, et al. Development of aquatic life criteria in China: Viewpoint on the challenge [J]. Environmental Science and Pollution Research, 2013, 21(1): 61-66
[15] 金小伟, 王业耀, 王子健. 淡水水生态基准方法学研究: 数据筛选与模型计算[J]. 生态毒理学报, 2014, 9(1): 1-13
Jin X W, Wang Y Y, Wang Z J. Methodologies for derivingaquatic life criteria (ALC): Data screeningand model calculating[J]. Asian Journal of Ecotoxicology, 2014, 9(1): 1-13
[16] 苏海磊, 吴丰昌, 李会仙, 等. 太湖生物区系研究及与北美五大湖的比较[J]. 环境科学研究, 2012, 24(12): 1346-1354
Su H L, Wu F C, Li H X, et al. Aquatic biota of Taihu Lake and comparison with those of the North America Great Lakes [J]. Research of Environmental Sciences. 2012, 24(12): 1346-1354
[17] Maltby L, Blake N, Brock T C M, et al. Insecticide species sensitivity distributions: Importance of test species selection and relevance to aquatic ecosystems [J]. Environmental Toxicology and Chemistry, 2005, 24(2): 379-388
[18] 吴丰昌, 冯承莲, 曹宇静, 等. 锌对淡水生物的毒性特征与水质基准的研究[J]. 生态毒理学报, 2011, 6(4): 367-382
Wu F C, Feng C L, Cao Y J, et al. Toxicity characteristic of zinc to freshwater biota and its water quality criteria [J]. Asian Journal of Ecotoxicology, 2011, 6(4): 367-382
[19] Eisler R, Copper hazards to fish, wildlife, and invertebrates: A synoptic review [J]. DTIC Document, 1998
[20] Wang Z, Kwok K W, Lui G, et al. The difference between temperate and tropical saltwater species' acute sensitivity to chemicals is relatively small [J]. Chemosphere, 2013, 105: 31-43
[21] Klimisch H J, Andreae M, Tillmann U. A systematic approach for evaluating the quality of experimental toxicological and ecotoxicological data [J]. Regulatory Toxicology and Pharmacology, 1997, 25(1): 1-5
[22] Wheeler J R, Grist E P M, Leung K M Y, et al. Species sensitivity distributions: Data and model choice [J]. Marine Pollution Bulletin, 2002, 45: 192-202
[23] Jin X W, Zha J M, Xu Y P, et al. Derivation of predicted no effect concentrations (PNEC) for 2,4,6-trichlorophenol based on Chinese resident species [J]. Chemosphere, 2012, 86(1): 17-23
[24] Chapman P M, Mcdonald B G, Kickham P E, et al. Global geographic differences in marine metals toxicity [J]. Marine Pollution Bulletin, 2006, 52: 1081-1084
[25] Grubbs F E. Procedures for detecting outlying observations in samples [J]. Technometrics, 1969, 11(1): 1-21
[26] Tietjen G L, Moore R H. Some grubbs-type statistics for the detection of several outliers [J]. Technometrics, 1972, 14(3): 583-597
[27] Leung K M Y, Morritt D, Wheeler J R, et al. Can saltwater toxicity be predicted from freshwater data? [J]. Marine Pollution Bulletin, 2001, 42(11): 1007-1013
[28] Xing L Q, Liu H L, Zhang X W, et al. A comparison of statistical methods for deriving freshwater quality criteria for the protection of aquatic organisms [J]. Environmental Science and Pollution Research, 2014, 21(1): 159-167
[29] Shapiro S S, Francia R S. An approximate analysis of variance test for normality [J]. Journal of the American Statistical Association, 1972, 67(337): 215-216
[30] Anderson T W, Darling D A. A test of goodness of fit [J]. Journal of the American Statistical Association, 1954, 49(268): 765-769
[31] Kwok K W H, Leung K M Y, Lui G S G, et al. Comparison of tropical and temperate freshwater animal species' acute sensitivities to chemicals: Implications for deriving safe extrapolation factors [J]. Integrated Environmental Assessment and Management, 2007, 3(1): 49-67
[32] Hung T C, Chuang A, Wu S J, et al. Relationships among the species and forms of copper and biomass along the Erhjin Chi coastal water [J]. Acta Oceanographica Taiwanica, 1990, 25: 65-76
[33] Shaw T, Brown V. The toxicity of some forms of copper to rainbow trout [J]. Water Research, 1974, 8(6): 377-382
[34] Stokes P M. Copper accumulations in freshwater biota [J]. Copper in the environment, Part I, 1979, 1: 357-381
[35] Stauber J, Florence T. Mechanism of toxicity of ionic copper and copper complexes to algae [J]. Marine Biology, 1987, 94(4): 511-519
[36] Hodson P V, Borgmann U, Shear H. Toxicity of copper to aquatic biota [J]. Copper in the Environment, Part I, 1979, 2: 307-372
[37] Truchot J. Factors controlling the in vitro and in vivo oxygen affinity of the hemocyanin in the crabCarcinusmaenas(L.) [J]. Respiration Physiology, 1975, 24(2): 173-189
[38] Hansen J I, Mustafa T, Depledge M. Mechanisms of copper toxicity in the shore crab,Carcinusmaenas[J]. Marine Biology, 1992, 114(2): 259-264
[39] Suzuki K T, Hiroyuki S, Shigehisa H, et al. Differential binding of cadmium and copper to the same protein in a heavy metal tolerant species of mayfly (Baetisthermicus) larvae [J]. Comparative Biochemistry and Physiology Part C: Comparative Pharmacology, 1989, 94(1): 99-103
[40] Reid S D, Mcdonald D. Metal binding activity of the gills of rainbow trout (Oncorhynchusmykiss) [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1991, 48(6): 1061-1068
[41] Carbonell G, Tarazona J. Toxicokinetics of copper in rainbow trout (Oncorhynchusmykiss) [J]. Aquatic Toxicology, 1994, 29(3): 213-221
[42] Hogstrand C, Lithner G, Haux C. The importance of metallothionein for the accumulation of copper, zinc and cadmium in environmentally exposed perch,Percafluviatilis[J]. Pharmacology & Toxicology, 1991, 68(6): 492-501
[43] Hylland K, Haux C, Hogstrand C. Hepatic metallothionein and heavy metals in dabLimandalimandafrom the German Bight [J]. Marine Ecology Progress Series, 1992, 91(1-3): 89-96
[44] Wheeler J R, Leung K M Y, Morritt D, et al. Freshwater to saltwater toxicity extrapolation using species sensitivity distributions [J]. Environmental Toxicology and Chemistry, 2002, 21(11): 2459-2467
[45] Phillips D J H, Rainbow P S. Biomonitoring of Trace Aquatic Contaminants [M]. Elsevier, London, UK, 1993
[46] Rainbow P S. Ecophysiology of trace metal uptake in crustaceans [J]. Estuarine, Coastal and Shelf Science, 1997, 44: 169-175
[47] Rainbow P S. Trace metal accumulation in marine invertebrates: Marine biology or marine chemistry [J]. Journal of the Marine Biological Association of the United Kingdom, 1997, 77: 195-210
◆
Taxon-specificSensitivityDifferencesofCoppertoAquaticOrganisms
Wang Zhen1, Jin Xiaowei2,*, Wang Zijian3
1. The Swire Institute of Marine Science and School of Biological Sciences, The University of Hong Kong, Hong Kong, China2. China National Environmental Monitoring Center, Beijing 100012, China3. Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China
31 May 2014accepted18 June 2014
The toxicity of copper is affected by many environmental factors, e.g. temperature, pH, etc. To better control copper's discharge and protect aquatic organisms from the toxicity of copper, the water quality criteria (WQC) of copper have been updated several times so as to reflect the latest scientific knowledge. To date, the differences of species' tolerance and sensitivities to copper might exist partly due to the effects of environmental factor on different taxon living in different geographical regions. Using all available fresh water and marine toxicity data in the literature, taxon-specific species sensitivities were compared by using species sensitivity distributions (SSDs) approach. The results obtained in the present study can provide a reference for species selection of WQC development in China. Through a comprehensive meta-analysis of taxon-specific 10% hazardous concentrations (HC10) and their 95% confidence interval (95%CI), our results suggest that algae is the most sensitive taxa to copper in fresh water ecosystems, followed by crustaceans, molluscs, fishes and worms, while insects is the least sensitive one. Comparatively, there is almost a similar decline in copper sensitivity from algae to crustaceans, molluscs, worms and then fishes for marine organism. Whereas, fresh water taxa is more sensitive against copper than their marine counterparts.
copper; freshwater species; marine species; taxon-specific species sensitivity distribution
2014-05-31录用日期:2014-06-18
1673-5897(2014)4-640-07
: X171.5
: A
金小伟(1985―),男,甘肃兰州人,博士,中国环境监测总站工程师,主要从事生态毒理以及生态风险评价的研究,已发表论文20余篇。
国家自然科学青年基金(21307165);国家水体污染控制与治理科技重大专项(2013ZX07502001);环境模拟与污染控制国家重点联合实验室(中国科学院生态环境研究中心)开放基金(14K02ESPCR)
王振(1984-),男,博士,主要从事生态毒理与水质基准研究,E-mail: wangzhen.dln@hotmail.com
*通讯作者(Corresponding author),E-mail: jxw85@126.com
10.7524/AJE.1673-5897.20140531001
王 振,金小伟,王子健. 铜对水生生物的毒性:类群特异性敏感度分析[J]. 生态毒理学报, 2014, 9(4): 640-646
Wang Z, Jin X W, Wang Z J. Taxon-specific sensitivity differences of copper to aquatic organisms [J]. Asian Journal of Ecotoxicology, 2014, 9(4): 640-646 (in Chinese)
