我国土壤中重金属铜的生物配体模型的建立与应用
2014-09-27马义兵王学东
李 波,马义兵,王学东
1. 辽宁省农业科学院植物营养与环境资源研究所,沈阳 1101612. 中国农业科学院农业资源与农业区划研究所,北京 1000813. 首都师范大学资源环境与旅游学院,北京 100048
我国土壤中重金属铜的生物配体模型的建立与应用
李 波1,马义兵2,*,王学东3
1. 辽宁省农业科学院植物营养与环境资源研究所,沈阳 1101612. 中国农业科学院农业资源与农业区划研究所,北京 1000813. 首都师范大学资源环境与旅游学院,北京 100048
关于重金属污染的风险评价及其预测模型日益成为环境领域的研究热点。近年来,一种用于预测和评价环境中重金属生物毒性的机理性模型—生物配体模型(BLM)被广泛应用于水体及陆地生态系统。本研究以我国土壤的陆地生物配体模型(TBLM)建构为目标,以土壤溶液系统为媒介,通过17种土壤上重金属铜离子与大麦根长的相互作用关系,发现了土壤中Cu-TBLM的主要影响因素为Cu2+、CuOH+、Mg2+以及铜离子与大麦根系表面的专性结合能力。基于模型大麦根长预测值与实测值之间的相关关系,通过数学拟合功能求得TBLM中各参数值为logKCuBL= 4.87、logKCuOH+= 7.62、logKMgBL= 1.91、f50%= 0.103、β= 1.09。本研究所得到的TBLM模型能很好地预测我国土壤中铜对大麦根长的毒害程度,预测值与实测值的相关性达到了90%。本研究结果不仅可以为我们降低重金属离子生物有效性提供有力的理论借鉴,更对我国土壤环境质量保护和长期良性可持续发展具有重要意义。
铜;大麦根长;陆地生物配体模型;毒性预测
众所周知,土壤中重金属离子的全量不能很好地评价其生物有效性,真正作用于土壤生物体的重金属离子只占全量的很小部分[1-3]。土壤溶液是金属离子与生物体作用的媒介,水溶性金属离子被认为是作用于植物根系最直接、最有效的形态[4-5]。以铜为例,土壤溶液中总铜含量与植物生长效应具有很好的相关性[4,6],但这种经验的剂量-效应关系很难从机理层面解释铜离子与土壤中共存生物体的相互作用关系。
近几年来,应用生物配体模型(BLM)理论解释溶液中金属离子对植物、动物、微生物的毒性作用的报道逐渐增多[7-10]。该模型将生物受体位点作为生物配体,假设当结合在具有生理活性的生物受体位点的重金属达到一定量时,毒性就可能发生。模型考虑了影响生物毒性的溶液组成性质以及具有生物有效性的金属离子比例,在水质、土壤毒性预测上取得了一定的成绩[9-11]。与水体BLM相似,土壤中的生物配体模型(陆地生物配体模型,TBLM)把土壤溶液相作为金属离子与生物体作用的媒介,一切作用的发生都以这个媒介为基础,然而,不同的是TBLM相对于水体BLM来说更加复杂,土壤作为土壤溶液成分的供给源引入了更多不可控制的因素。目前关于TBLM的研究还只处于探索阶段[12-13]。TBLM模型以有效态金属离子为研究出发点,任何影响金属离子有效性的因子都应该被模型所考虑。以铜离子为例,土壤溶液中铜离子有效性与自由铜离子活度、生物配体专性作用位点、以及其他可能具有生物有效性的铜离子形态有关,同时,自由铜离子活度还受土壤溶液中共存竞争阳离子数量(如Ca2+、Mg2+等)、可溶性有机碳(DOC)浓度以及pH的影响。本研究以我国17种土壤中铜离子的TBLM建构为研究目标,从土壤中有效性铜离子形态与植物毒性反应关系入手,针对不同土壤类型中铜的有效性及影响因素,从机理角度解释土壤中铜离子与植物根系的相互作用关系,探讨TBLM在我国土壤上的预测能力及应用性。
1 材料与方法(Materids and methods)
1.1 土壤溶液参数测量
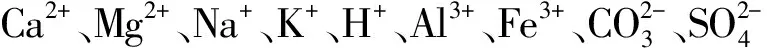
根据ISO 11269-1[16]大麦根伸长毒性试验的标准方法,取风干的污染土壤样品每个处理360 g,装入自制根长生长筒内(内径3.5 cm,高12 cm),3次重复,保持最大持水量(WHC)的60%培养7 d后,种植预发芽的大麦种子4粒到根长生长筒内,置于人工气候箱内生长,生长条件为白天14 h(22 °C),夜间10 h(18 °C),光照强度为24 000 lux·m-2,水分湿度为70%,保持整个试验过程中土壤含水量为最大持水量的60%,5 d后收集大麦根,清洗后测定每个重复内每株大麦的最长的根长,并求均值。
1.3 TBLM的建立
1.3.1 土壤溶液中铜离子活度测量
使用Orion 94-29铜离子选择电极(Thermo Electron Corporation, USA)测量土壤溶液中铜离子活度[17]。由于土壤样本较大以及污染处理较多,本研究仅选取17个土壤样品的两个污染浓度,即约为大麦根伸长10%(EC10)及50%(EC50)抑制时的浓度水平[18]。电极标准溶液使用各5 mL 1 mol·L-1Cu(NO3)2、0.01 mol·L-1IDA、0.025 mol·L-1KHC8H4O4、0.1 mol·L-1KNO3及不同体积的0.02 mol·L-1NaOH(1~10 mL)配置[13]。根据电极标准溶液测定结果绘制电极电位mV对pCu(自由离子活度的负对数)标准曲线图,标准溶液的pCu结果使用WHAM 6[19]模型计算。测量土壤溶液中铜离子的电极电位,根据标准曲线图查出相应的pCu值。
1.3.2 土壤溶液中铜离子活度的预测

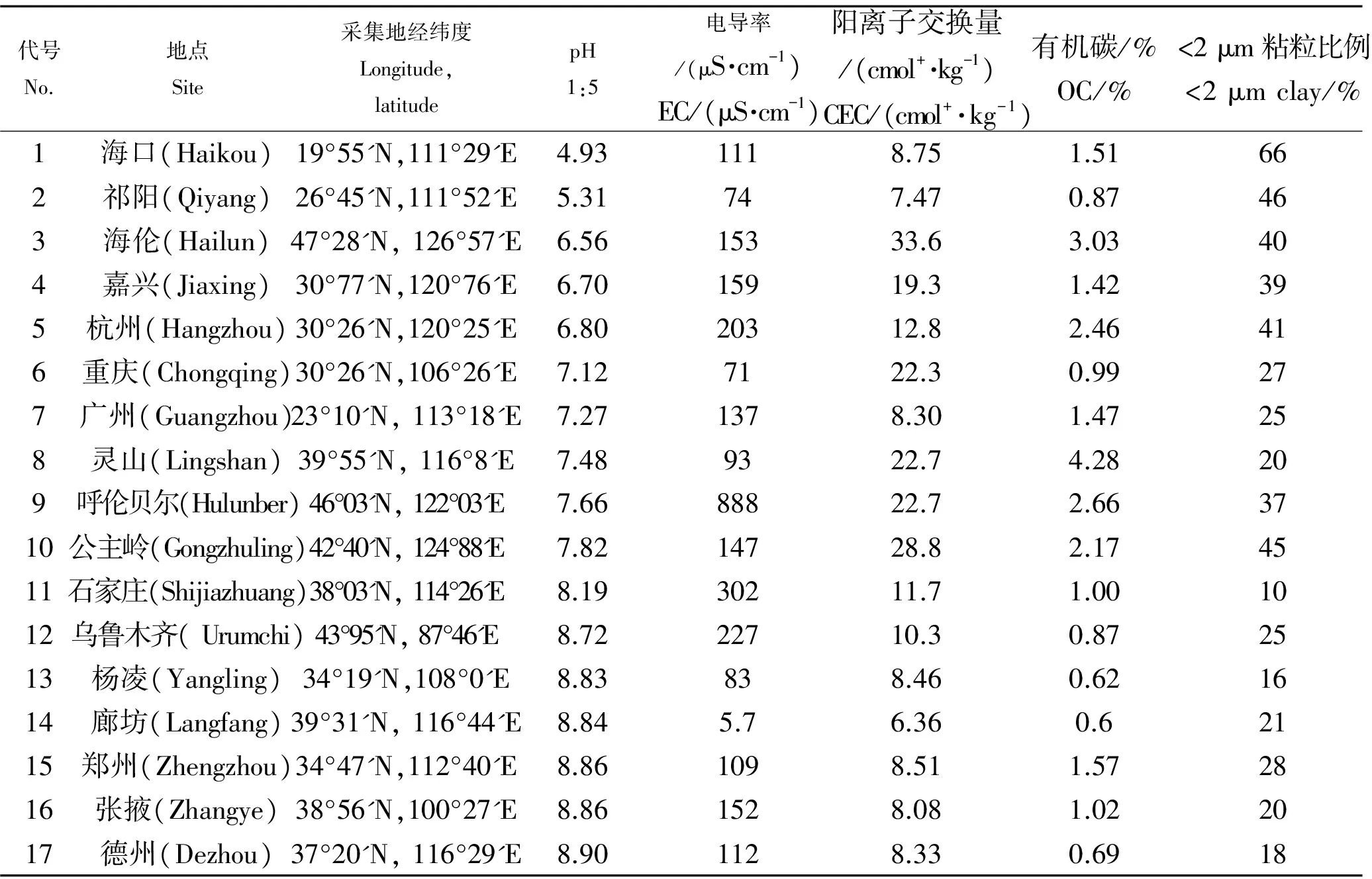
表1 17 种土壤的基本理化性状Table 1 Selected physicochemical properties of soil used in this experiment
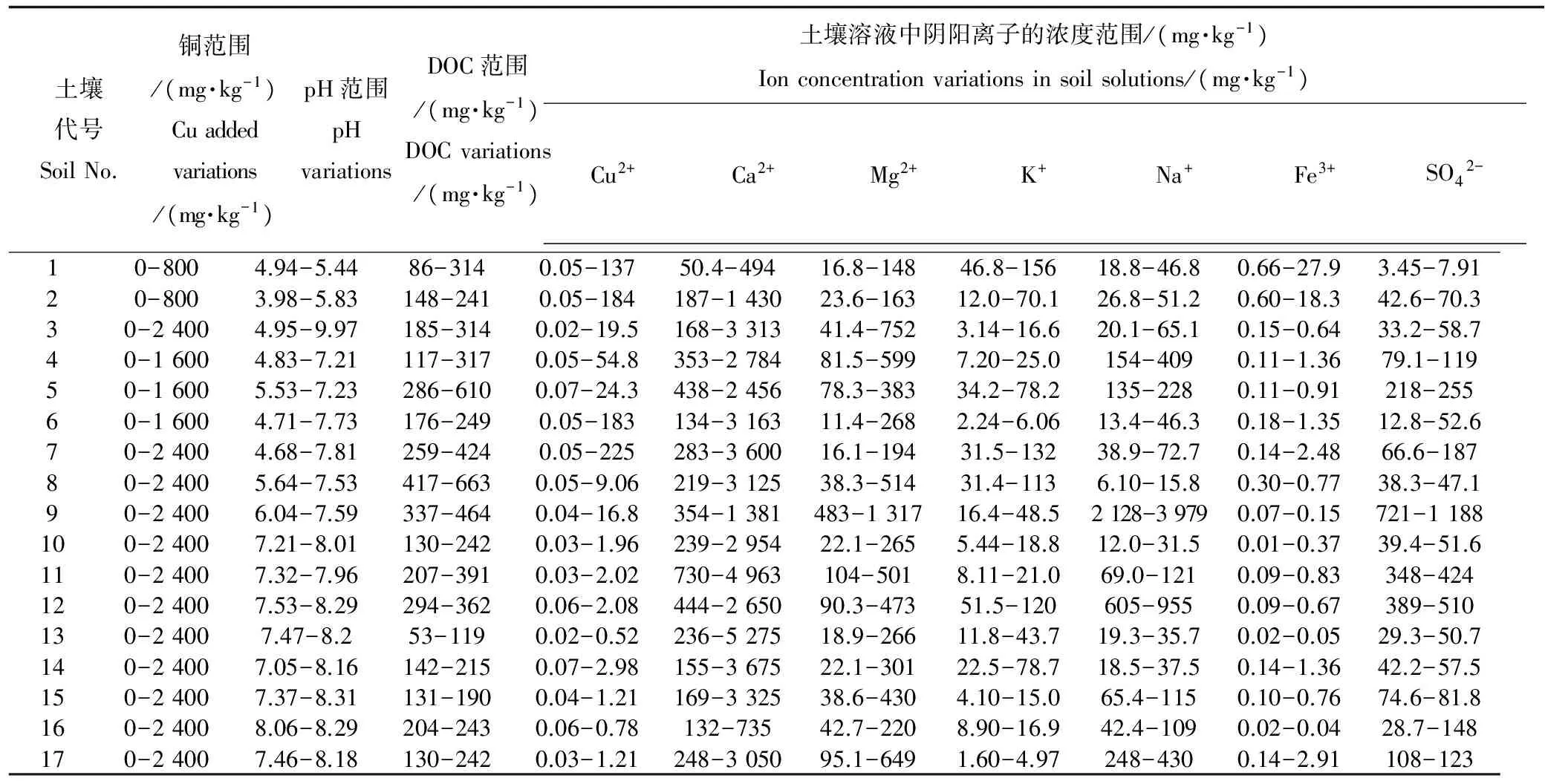
表2 17个土壤样本的土壤溶液参数Table 2 Soil solution parameters measured for Cu added to 17 soils by extracting soil solution
1.3.3 TBLM的建立
根据Wang等[20]研究结果,即除二价铜离子(Cu2+)之外,羟基铜离子(CuOH+)在高pH条件下具有很强的毒性,考虑到我国土壤背景中大部分土壤的pH高于7,因此在TBLM建模时Cu2+与CuOH+被同时考虑为生物有效性的铜离子形态。此外,Mg2+可以与Cu2+竞争大麦根表面的结合位点,因此被作为Cu2+毒性消减作用的唯一离子[20]。最终输入到TBLM模型的变量锁定为{Cu2+}(离子活度形式)、{CuOH+}、{Mg2+}以及大麦根长相对长度RE,TBLM方程为[13]:
2 结果与讨论(Results and discussion)
2.1 WHAM 6 模型校正结果
根据测量的与模型预测的pCu的一致程度,采用最大相关系数及最小残差平方和法校正WHAM 6化学模型中FA默认参数。研究发现我国农业土壤的DOC对铜的络合能力与WHAM 6中默认的络合能力相差很大,即我国农业土壤的DOC远小于模型默认能力。通常来说,WHAM 6中65%的FA被认为是活性的FA[21-24],而对于我国土壤来说,只有当铜与FA的结合常数logKCuFA从默认的2.1(图1a)下降到1.5(图1b)时,测量与预测的pCu才最吻合,此时两者的相关系数R2从0.51增加到0.74,方程的斜率值从0.931增加到1.005(图1)。因此,输入到WHAM 6中DOC参数为FA = 2 × DOC × 0.65,并logKCuFA=1.5。
2.2 TBLM模型建立
输入表2中136个土壤溶液变量组到校正的WHAM 6模型,得到的铜离子和其他阳离子的活度见表3。从表3发现,在pH<7.3的土壤里,铜离子活度占总溶解性铜的40%以内,且与土壤pH呈负相关;pH>7.3的土壤里,铜离子活度仅占总溶解性铜的15%以内,大部分铜离子与DOM结合起来,失去活性。此外,总体上{Cu2+}显著高于{CuOH+},{Ca2+}离子活度高于{Mg2+}。输入表3中变量到DPS 9.0数据表中,根据大麦根长的预测值与测量值之间的相关关系,拟合得到各参数值为logKCuBL= 4.87、logKCuOHBL=7.62、logKMgBL=1.91、f50%= 0.103、β= 1.09。预测和测量的大麦根长的相关关系如图2a所示,其中残差平方和RMSE = 11.4,相关系数R2= 0.90。总体看来大麦根长的预测结果很好,基本所有的预测值都落在实际测量值2倍的范围内(图2b),意味着TBLM能够很好地预测我国土壤中铜对大麦根长生长的毒害程度。
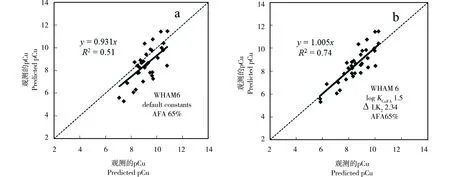
图1 铜离子选择电极测量的pCu与WHAM 6模型预测的pCu的相关性Fig. 1 Comparison between measured and predicted pCu. The predictions were made with WHAM 6 using default parameter values and 65% AFA (a), optimized parameter values and 65% AFA (b).
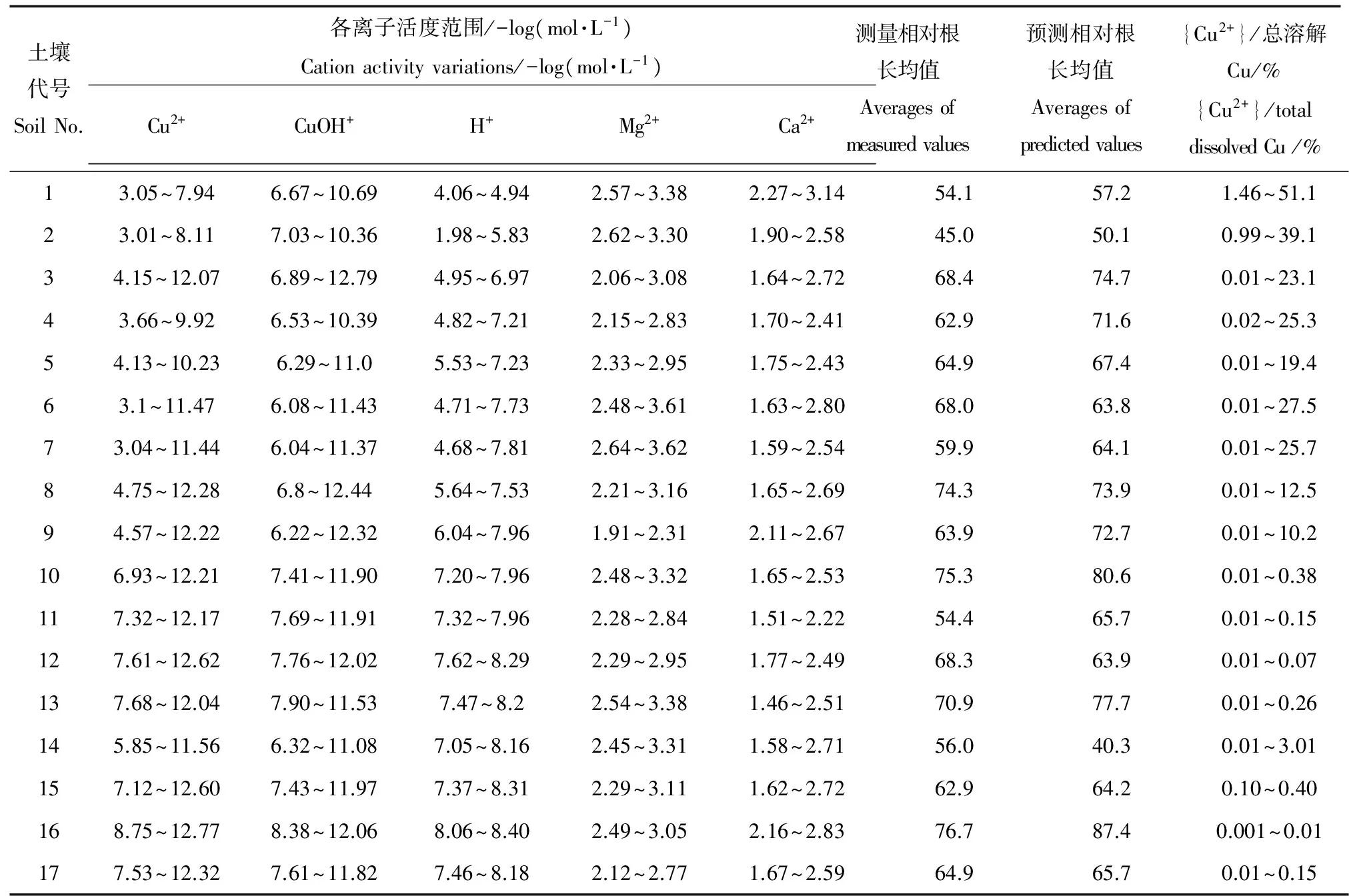
表3 土壤溶液离子活度预测值及大麦根长值Table 3 Relative cation activity predicated using soil solution parameter for 17 Cu added soils
2.3 TBLM验证
为了进一步确定本研究结果的准确性,我们应用王学东等[12]大麦根长水培试验得到的参数值即logKCuBL= 6.57、logKCuOHBL= 7.03、logKMgBL= 3.00代入到以上TBLM方程中,通过DPS软件数据拟合得到f50%= 0.047、β= 0.625,预测值与实测值的相关系数R2= 0.51,RMSE = 22.47,说明模型预测能力很差(表4)。此外,我们也使用Thakali等[9]中得到的参数f50%= 0.05、β= 0.96以及王学东等(2008)得到的结合常数logKCuBL= 6.57、logKCuOHBL= 7.03、logKMgBL= 3.00代入到TBLM方程中,结果发现模型的预测能力也很差,即R2= 0.56,RMSE = 23.71。尽管本研究得到的TBLM模型不尽完美,仍有一些数值偏离实测值两倍的范围区间,但相对于Thakali等[9]基于欧洲非碳酸钙土壤的TBLM模型(RMSE =15.4;R2= 0.85)却有很大的提高(表4)。此外,Thakali等[9]选取的土壤样本pH较低,有机质含量较高,而我国碳酸钙土壤比例较大,有机质含量较低,基于我国土壤背景得到的TBLM更能针对我国土壤的分布特点,从机理上解释土壤溶液系统中铜与植物根系作用的方式。
2.4 TBLM建模的影响因素
由于DOC对铜有很强的络合能力,在污染较轻的土壤上,几乎90%以上的铜以DOC络合形式存在,因此,DOC的浓度及结构差异对铜的生物有效性影响很大。通常来说,酸性土壤溶液中的DOC比中性与碱性土壤络合能力低,主要因为酸性土壤中H+含量高,H+可以占据DOC与Cu2+的结合位点,降低DOC对铜的络合能力[9]。本研究中没有引入不同pH土壤的DOC差异,主要是因为在模型校正时没有发现极异常数据值。其次,DOC因来源不同,结构差异很大,一般来源于农业土壤的DOC要比来源于有机肥、秸秆腐熟物等DOC芳香度低,也就是说来源于农业土壤的DOC含有较多的羧基、较少的芳香基[25-26],从而导致前者的络合能力相对较低,因此,追溯农业土壤的外源有机物来源及添加量对于模型准确建构具有一定的作用。再次,不同土壤溶液的提取方法产生的效果不同。MacDonald等[27]提出使用渗透方法提取土壤溶液,能够较好地模拟了田间土壤的化学性质,而采用离心、压力、抽气等方法提取的土壤溶解性离子的浓度要大于渗透方法测得的离子浓度。因此,正确的土壤溶液提取方法对TBLM的准确建立起到非常重要的作用。
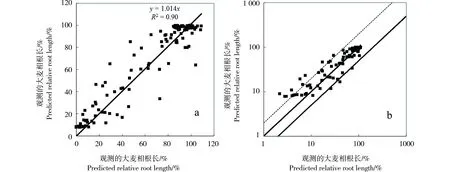
图2 大麦根长的测量值和预测值的相关性。其中a为百分数、b为对数转换值Fig. 2 The relationship between the measured and predicted barley relative root lengths, and a (%) and b (log-transformed) represent Cu toxicity results
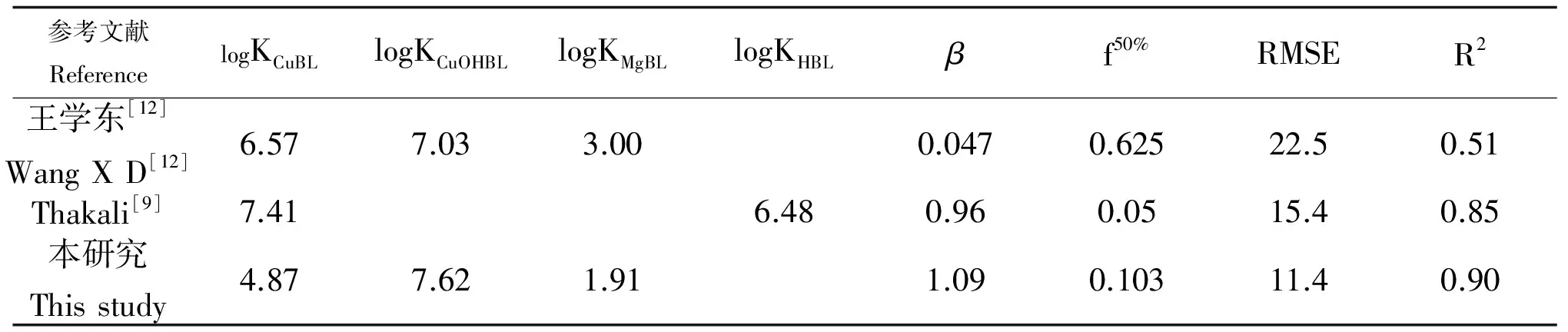
表4 不同研究得到的大麦根系与铜离子结合的生物配体模型参数Table 4 The BLM parameters based on barley root and Cu ion binding from different studies
此外,不同的生物配体对TBLM的建构影响很大。Thakali等[9-10]基于pH ≤ 7.0的欧洲土壤的植物生长和微生物活性抑制试验建立了适合欧洲非碱性土壤的TBLM,研究发现对于土壤硝化细菌来说降低铜害的竞争离子为H+与Mg2+,而对于大麦根长与西红柿茎叶生长来说竞争离子仅为H+;然而,Lock等[28]基于非碱性溶液培养试验的研究发现降低大麦根长铜害的竞争离子为H+与Mg2+。王学东等[12,20]通过大麦根长水培试验,进一步验证了Mg2+的竞争作用;并通过pH范围试验,发现了除Cu2+之外,CuOH+的毒害作用,进一步解释了低pH条件下H+对Cu2+的竞争作用[9,28]只是一种假象,而实际上是由于pH的升高,生成了CuOH+这种比Cu2+毒性更强的形态。由于本研究中大部分土壤pH超过7,因此,选用王学东的研究结果构建我国TBLM。值得注意的是,不同生物配体与铜离子的结合能力(以logK表示)有所不同,对于西红柿茎叶生长来说,虽然竞争离子与大麦根长相同,但络合常数logK却有显著差异[9-10]。Cheng等[29]研究了铜对生菜的毒性,估算生菜根系与铜的结合常数(logK)变化在11.15~12.16之间;Antunes等[30]通过小麦培养试验发现了铜浓度不同时小麦根和铜的结合常数(logK)不同,变化范围在4.07~9.06之间。本研究得到的结合常数远小于生菜根与铜的结合常数,而与小麦根结合常数变化区间较为一致,可能由于大麦与小麦植物科属相近所致。
总之,BLM是一个机理性的模型,能够从机理角度摸清土壤生物体与金属离子的相互作用关系,是一个能够替代生物毒性试验来预测金属毒性的有用工具。尽管模型现在存在着局限性,但随着对痕量金属吸收过程中的化学、生理学和生物学过程的深入理解,这些问题将会逐步得到解决,未来BLM既面临挑战又有着广阔的应用和发展前景。
[1] Sauvé S, McBride M B, Norvell W A, et al. Copper solubility and speciation of in situ contaminated soils: Effects of copper level, pH and organic matter [J]. Water, Air and Soil Pollution, 1997, 100(1-2): 133-149
[2] McLaughlin M J. Bioavailability of metals to terrestrial plants. In Allen HE (Ed.). Bioavailability of Metals in Terrestrial Ecosystems: Influence of Partitioning for Bioavailability to Invertebrates, Microbes and Plants [M]. Pensacola, FL: SETAC Press, 2000: 39-67
[3] Nolan A L, Lombi E, McLaughlin M J. Metal bioaccumulation and toxicity in soils: Why bother with speciation? [J]. Australian Journal of Chemistry, 2003, 56(3): 77-91
[4] Zhao F J, Rooney C P, Zhang H, et al. Comparison of soil solution speciation and diffusive gradients in thin-films measurement as an indicator of copper bioavailability to plants [J]. Environmental Toxicology and Chemistry, 2006, 25(3): 733-742
[5] Song J, Zhao F J, Luo Y M, et al. Copper uptake by Elsholtzia splendens and Silene vulgaris and assessment of copper phytoavailability in contaminated soils [J]. Environmental Pollution, 2004, 128(3): 307-315
[6] Sauvé S, Hendershot W, Allen H E. Solid-solution partitioning of metals in contaminated soils: Dependence on pH, total metal burden and organic matter [J]. Environmental Science and Technology, 2000, 34(7): 1125-1131
[7] Niyogi S, Wood C M. Biotic ligand model, a flexible tool for developing site-specific water quality guidelines for metals [J]. Environmental Science and Technology, 2004, 38(23): 6177-6192
[8] Slaveykova V I, Wilkinson K J. Predicting the bioavailability of metal complexes: Critical review of the biotic ligand model [J]. Environmental Chemistry, 2005, 2(1): 9-24
[9] Thakali S, Allen H E, Di Toro D M, et al. A terrestrial biotic ligand model. 1. Development and application to Cu and Ni toxicity to barley root elongation in soils [J]. Environmental Science and Technology, 2006, 40(22): 7085-7093
[10] Thakali S, Allen H E, Di Toro D M, et al. A terrestrial biotic ligand model. 2. Application to Ni and Cu toxicities to plants, invertebrates, and microbes in soil [J]. Environmental Science and Technology, 2006, 40(22): 7094-7100
[11] 黄圣彪. 水环境中铜形态与其生物有效性/毒性关系及其预测模型研究[D]. 北京, 中国科学院生态环境研究中心, 2003
Huang S B. Measurement and prediction in the toxic/bioavailable concentration of copper in natural water [D]. Beijing, Research Center for Eco-Environmental Sciences, 2003 (in Chinese)
[12] 王学东, 马义兵, 华珞, 张璇. 铜对大麦的急性毒性预测模型-生物配体模型研究[J]. 环境科学学报, 2008, 28(8): 1704-1712
Wang X D, Ma Y B, Hua L, et al. Development of Biotic Ligand Mod el (BLM) predicting copper acute toxicity to barley (Hordeum vulgare) [J]. Acta Scientiae Circumstantiae, 28(8): 1704-1712 (in Chinese)
[13] 李波. 外源重金属铜、镍的植物毒害及预测模型研究[D]. 北京, 中国农业科学院, 2010
Li B. The Phytotoxicity of added copper and nickel to soils and predictive models [D]. Beijing, Chinese Academy of Agricultural Sciences, 2010 (in Chinese)
[14] Thibault D H, Sheppard M I. A disposable system for soil pore-water extraction by centrifugation [J]. Communications in Soil Science and Plant Analysis, 1992, 23(13): 1629-1641
[15] Zarcinas B A, McLaughlin M J, Smart M K. The effect of acid digestion technique on the performance of nebulisation systems used in inductively coupled plasma spectrometry [J]. Communications in Soil Science and Plant Analysis, 1996, 27(5-8): 1331-1354
[16] International Organization for Standardization. Soil quality-Determination of the effects of pollutants on soil flora-Part 1: Method for the measurement of inhibition of root growth [S]. Geneva, Switzerland. 1993
[17] Sauvé S, McBride M B. Hendershot W H. Ion-selective electrode measurements of copper (II) activity in contaminated soils [J]. Archives Environment Contamination Toxicology, 1995, 29(3): 373-379
[18] Li B, Ma Y B, McLaughlin M J, et al. Influences of soil properties and leaching on copper toxicity to barley root elongation [J]. Environmental Toxicology and Chemistry, 2010, 29(4): 835-842
[19] Tipping E. Humic Ion Binding Model VI: An improved description of the interactions of protons and metal ions with humic substances [J]. Aquatic Geochemistry,1998, 4(1): 3-48
[20] Wang X D, Ma Y B, Hua L, et al. Identification of CuOH+toxicity to barley root elongation in solution culture [J]. Environmental Toxicology and Chemistry 2009, 28(3): 662-667
[21] Weng L P, Temminghoff E J M, Lofts S, et al. Complexation with dissolved organic matter and solubility control of heavy metal in a sandy soil [J]. Environmental Science and Technology, 2002, 36(22): 4804-4810
[22] Van Laer L, Smolders E, Degryse F, et al. Speciation of nickel in surface waters measured with the Donnan membrane technique [J]. Analytica Chimica Acta, 2006, 578(2): 195-202
[23] Oorts K, Bronckaers H, Smolders E. Discrepancy of the microbial response to elevated Cu between freshly spiked and long-term contaminated soils [J]. Environmental Toxicology and Chemistry, 2006, 25(3): 845-853
[24] Oorts K, Ghesquiere U, Smolders E. Leaching and aging decrease nickel toxicity to soil microbial processes in soils freshly spiked with nickel chloride [J]. Environmental Toxicology and Chemistry, 2007, 26(6): 1130-1138.
[25] Weishaar J L, Aiken G R, Bergamaschi B A, et al. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon [J]. Environmental Science and Technology, 2003, 37(20): 4702-4708
[26] Grybos M, Davranche M, Gruau G, et al. Is trace metal release in wetland soils controlled by organic matter mobility or Fe-oxyhydroxides reduction? [J]. Journal of Colloid and Interface Science, 2007, 314(2): 490-501
[27] MacDonald J D, Belanger N, Hendershot W H. Column leaching using dry soil to estimate solid - solution partitioning observed in zero - tension lysimeters. 2 Trace metals [J]. Soil and Sediment Contamination, 2004, 13(4): 375-390
[28] Lock K, Criel P, De Schamphelaere K A C, et al. Influence of calcium, magnesium, sodium, potassium and pH on copper toxicity to barley (Hordeum vulgare) [J]. Ecotoxicology and Environmental Safety, 2007, 68: 299-304
[29] Cheng T, Allen H E. Prediction of uptake copper from solution by lettuce (Lactuca sativa romance) [J]. Environmental Toxicology and Chemistry, 2000, 20(11): 2544-2551
[30] Antunes P M C. Beyond the free-ion activity model: The biotic ligand model for estimating copper uptake by durum wheat [D]. Guelph, University of Guelph, 2004
◆
DevelopmentandApplicationofBioticLigandModelforCopperinChineseSoils
Li Bo1,Ma Yibing2,*,Wang Xuedong3
1. Institute of Plant Nutrition and Environmental Resources, Liaoning Academy of Agricultural Sciences, Shenyang 110161, China2. Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081, China3. The Key Lab of Resource Environment and GIS, College of Resource Environment & Tourism, Capital Normal University, Beijing 100048, China
15 May 2014accepted30 July 2014
The terrestrial biotic ligand model (TBLM) is a newly developed method for evaluating bioavailability of heavy metal ion in soils. Seventeen soil samples covering China were selected in this study by adding a series of Cu concentrations. The soil solutions were extracted according to the method of maximum water holding capacity. The cation and anion concentrations as well as dissolved organic carbon (DOC) in soil solutions were measured for the predictions of Cu (Cu2+and CuOH+especially at high-pH conditions) and Mg ion activities. The WHAM 6 model was used to predict free Cu2+, CuOH+and Mg2+activities using 65% DOM as active fluvic acid (FA) and adjusted binding constant logKCuFA= 1.5. The predicted ion activities and measured barley relative root elongation as variables were input into TBLM equation, and binding constants and parameters were fitted out as logKCuBL= 4.87, logKCuOH+= 7.62, logKβ= 1.09 by DPS statistic software according the best agreement between measured and predicted barley relative root lengths. The results showed that predicted and measured barley root elongation can match quite well with an R2= 0.90, RMSE = 11.4 and almost all predicted values lied within 2-fold of measured values. In order to ensure accuracy of TBLM in our study, some parameters from relative studies were compared with the values in this study, which showed that our TBLM was better than others and more suitable for Cu prediction of bioavailability in Chinese soils because a series of high-pH soils samples were included. The study will help a lot on formulating guidance of soil environment risk assessments not only for China but for the other areas around world.
: copper; barley; terrestrial biotic ligand model; toxicity prediction
2014-631-15录用日期:2014-07-30
1673-5897(2014)4-632-08
: X171.5
: A
马义兵(1957—),男,博士,研究员,主要研究方向为土壤重金属环境化学、风险评价与治理,发表学术论文160余篇。
国家自然科学基金项目(No.20677077; No.40620120436)和国际铜业协会,澳大利亚力拓矿业集团资助
李波(1979-), 女, 博士, 主要从事土壤重金属污染毒理与修复研究. E-mail: libocaas@163.com
*通讯作者(Corresponding author),E-mail: ybma@caas.ac.cn
10.7524/AJE.1673-5897.20140510006
李 波,马义兵,王学东. 我国土壤中重金属铜的生物配体模型的建立与应用[J]. 生态毒理学报, 2014, 9(4): 632-639
Li B, Ma Y B, Wang X D. Development and application of biotic ligand model for copper in Chinese soils [J]. Asian Journal of Ecotoxicology, 2014, 9(4): 632-639 (in Chinese)
