CCL18通过整合素聚集促进乳腺癌SK-3rd细胞浸润和迁移*
2014-09-26陈静琦朱必胜侯开连
陈静琦,朱必胜,侯开连
(广州医科大学附属第二医院肿瘤科,广东广州510260)
整合素是介导细胞与细胞外基质相互作用的主要分子,其中整合素β1主要介导细胞与纤维粘连蛋白(FN)的黏附[1]。以前认为细胞与细胞外基质的黏附抑制细胞的迁移,但现在研究认为,肿瘤细胞只有黏附于细胞外基质,才可以抵抗失巢性凋亡,而迁移就是细胞在细胞外基质上伸出伪足,在伪足的前缘依靠整合素形成黏附,而细胞体的后缘则去黏附,使得整个细胞体前移,整个细胞在细胞外基质上爬行,从而实现肿瘤的浸润和迁移[2]。但是,什么样的机制调控了肿瘤细胞这个黏附与去黏附的过程,目前还不清楚。
趋化因子分为CXC、CC、C等几种类型,大量研究已经证明趋化因子及其受体在肿瘤的浸润和迁移中起关键的作用,例如SDF-1作用于受体CXCR4促进肿瘤迁移,CCL5、CCL2在肿瘤转移中均起关键的作用[3]。但在趋化因子促进肿瘤趋化的过程中,发挥黏附功能的整合素起什么样的作用,还没有充分证明。CCL18是一种CC型的趋化因子[4],本研究前期已经证明乳腺癌细胞表达CCL18的受体PITPNM3,CCL18通过作用于PITPNM3产生乳腺癌细胞的趋化作用,从而促进乳腺癌浸润和迁移[5],本文将进一步研究CCL18促进乳腺癌SK-3rd细胞浸润和迁移的分子机制,探讨整合素在CCL18促迁移过程中的作用,为靶向肿瘤微环境的治疗提供实验依据。
1 材料与方法
1.1 材料 利用从ATCC购买的乳腺癌SKBR3细胞系构建SK-3rd细胞系;Transwell培养板购自Corning公司,微孔直径为0.4μm;FN购自美国Roche公司。细胞培养板购自Corning公司;CCL18蛋白购自R&D公司;整合素α5β1抗体购自美国Millipore公司。
1.2 方法
1.2.1 细胞培养 在完全培养基(含10%胎牛血清的DMEM)中培养SK-3rd细胞。
1.2.2 流式细胞检测 用CCL18(20ng/mL)处理SK-3rd乳腺癌细胞1h,然后用PBS洗涤细胞,再用鼠抗人整合素α5β1抗体4℃孵育细胞15min,用同型抗体作为对照,PBS洗涤后,再加入PE标记的荧光二抗(BD Biosciences),避光情况下室温孵育20min,然后用流式细胞仪(BD Biosciences)检测乳腺癌细胞整合素α5β1的聚集情况。以非相关蛋白人血清蛋白(ALB)处理组和未处理组(PBS)为对照。独立重复实验3次。
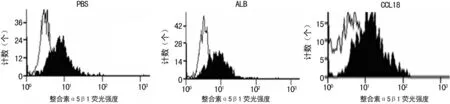
图1 CCL18促进乳腺癌SK-3rd细胞表面整合素α5β1的聚集
1.2.3 Western blot检测 收集培养、诱导成功的细胞,加入混有蛋白酶抑制剂(Merk)的RIPA裂解液(150nmol NaCL,1%NP-40,0.5%去氢醋酸钠,0.1%十二烷基硫酸钠(SDS),50mmol三羟甲基氨基甲烷,pH 8.0),提取细胞总蛋白,作蛋白定量。制备电泳SDS凝胶后,每个泳道加入10~50μg提取蛋白电泳,蛋白转移至PVDF膜(Millipore),洗膜,孵育针对Tyr397-黏着斑激酶(FAK)和β-actin的一抗(美国CST公司),洗膜,用标记辣根过氧化酶的对应的IgG二抗(美国CST公司)孵育。抗原抗体结合用化学发光剂(Thermo)观测。在培养板包被或不包被FN的条件下,用Western blot的方法检测CCL18对乳腺癌SK-3rd细胞FAK的影响。独立重复实验3次。
1.2.4 靶向整合素β1的siRNA转染 胰酶消化SK-3rd细胞,用含10%胎牛血清的DMEM(Gibco)悬浮细胞,37℃放置。使siPoRT NeoFX转染试剂(Ambion)和OPTI-MEM Ⅰ培养基(Invitrogen)恢复至室温。根据说明书溶解siPORT NeoFX在OPTI-MEMⅠ培养基中,常温下孵育10min。把siRNA按所需的终浓度(30nmol)溶解在OPTI-MEM Ⅰ培养基中。混合溶解的siRNA和转染试剂,常温下孵育10min,把混合液加入培养板,再把细胞悬液加到转染混合物上面,轻摇培养板。转染细胞在正常培养条件下培养48h,然后用于黏附实验。整合素β1的siRNA-1上游引物:5′-GGA AAU GGU GUU UGC AAG U-3′,下游引物:5′-ACU UGC AAA CAC CAU UUC C-3′;整合素β1的siRNA-2上游引物:5′-AAU GUA ACC AAC CGU AGC ATT-3′,下游引物:5′-ACU UGC AAA CAC CAU UUC C-3′。
1.2.5 Transwell侵袭实验 在Transwell上层小室(24 wells,8μm,Corning)底部膜的下表面铺10μL FN(40μg/mL,Roche),4℃放置48h;把50μL Matrigel(用无血清培养基1∶3稀释,R&D)加入Transwell的嵌套内,37℃孵育30 min。消化收集SK-3rd乳腺癌细胞,用无血清培养基(DMEMF12加入2%B27、胰岛素140IU和0.4%BSA)制细胞悬液,把乳腺癌细胞加入Transwell上室(105cells/well),下层小室加20%的胎牛血清和CCL18蛋白。培养8h后,用棉签去除Transwell上层小室内的基质胶,用多聚甲醛固定黏附在Transwell小室膜下表面的侵袭细胞,用结晶紫(0.005%,sigma)染色,在400倍的光学显微镜下,随机选取10个视野计数,同时拍摄图片,独立重复实验3次。在CCL18存在(un组)或CCL18不存在(con组)的条件下,在Transwell培养板中,检测转染整合素β1-siRNA(si-int-1组、si-int-2组)的乳腺癌 SK-3rd细胞浸润迁移功能(n=3),以单用转染试剂(mock组)、转染绿色荧光蛋白(GFP)的siRNA(si-GFP组)为对照。
2 结 果
2.1 CCL18促进SK-3rd乳腺癌细胞表面整合素α5β1的聚集乳腺癌细胞与细胞外基质的黏附在乳腺癌的浸润和迁移过程中起关键的作用,整合素是乳腺癌细胞表面的黏附分子,故在乳腺癌细胞黏附和浸润迁移中起关键的作用,本结果表明CCL18作用于乳腺癌细胞,引起SK-3rd细胞表面整合素α5β1的聚集(图1),从而启动了乳腺癌细胞黏附于细胞外基质的过程。
2.2 CCL18促进SK-3rd乳腺癌细胞中FAK的磷酸化激活本研究用CCL18和细胞外基质FN处理乳腺癌SK-3rd细胞,用Wester blot检测FAK的磷酸化激活,结果观察到CCL18可以使SK-3rd细胞中在Tyr397位点磷酸化FAK蛋白量升高,表明CCL18可以磷酸化激活FAK,见图2。

图2 CCL18引起乳腺癌SK-3rd细胞中FAK的激活

图3 各组SK-3rd乳腺癌细胞浸润和迁移比较
2.3 CCL18通过整合素促进SK-3rd乳腺癌细胞浸润和迁移在证明CCL18可以引起整合素在乳腺癌细胞表面聚集的基础上,进一步把针对整合素β1的siRNA通过脂质体转染入乳腺癌细胞,经过48h沉默整合素β1的表达,检测CCL18对乳腺癌SK-3rd细胞浸润和迁移的影响,结果发现,在Transwell侵袭实验中,与没有CCL18处理组比较,CCL18使乳腺癌SK-3rd细胞浸润迁移数量增加10倍(P<0.01,图3),转染GFP siRNA或单纯加入脂质体(mock)没有影响CCL18促乳腺癌细胞浸润和迁移的作用,转染靶向整合素β1的siRNA-1和si-RNA-2可以抑制CCL18促进乳腺癌细胞浸润和迁移的作用,浸润和迁移细胞数恢复到没有CCL18作用的水平(P>0.05,图3),证明CCL18通过促进整合素的聚集可促进乳腺癌细胞浸润和迁移。
3 讨 论
以前的研究认为细胞的黏附抑制肿瘤细胞的浸润和迁移,但细胞黏附功能的系统研究认为,细胞的黏附分为细胞与细胞外基质的黏附和细胞与细胞之间的黏附[6],如果没有细胞与周围细胞或细胞外基质的黏附,细胞就会出现失巢性凋亡,就不能维持增殖、迁移的生物学功能[7]。肿瘤细胞在周围环境的支撑下,在微环境中生物活性因子的诱导下,运动能力增强,浸润和迁移的能力增强[8],实质上肿瘤细胞的迁移是细胞在细胞外基质上的一种滚动样的爬行。整合素是肿瘤细胞表面的黏附分子,是细胞外基质成分的受体[9],介导肿瘤细胞与细胞外基质的黏附[10]。整合素发挥黏附功能,首先表现为聚集[11],而且肿瘤细胞周围的生物活性因子可以作用于肿瘤细胞,诱导整合素的聚集,从而促进肿瘤细胞的黏附功能。
趋化因子促进肿瘤细胞的趋化[11-12]。CCL18在乳腺癌微环境中,是一种来源于肿瘤相关巨噬细胞(tumor associated macrophages,TAM)的CC型趋化因子[13],在本研究前,关于CCL18的研究主要集中在CCL18对树突状细胞、淋巴细胞的趋化作用[14],还少有研究CCL18对肿瘤细胞的作用,严重影响了这种趋化因子功能的阐明。本课题的前期研究证明CCL18与乳腺癌细胞表面受体PITPNM3结合,促进乳腺癌浸润和迁移,CCL18可促进乳腺癌细胞黏附于细胞外基质[5]。
在本研究证明TAM来源的CCL18作用于乳腺癌细胞,促进乳腺癌细胞表面整合素α5β1的聚集,整合素的聚集引起黏着斑形成,从而促进乳腺癌细胞黏附。整合素α5β1的配体是细胞外基质中的FN,CCL18引起整合素α5β1聚集的同时,引起乳腺癌细胞内FAK的磷酸化激活,从而进一步激活细胞内的信号传导通路,同时也证明沉默整合素β1,抑制CCL18促进乳腺癌细胞黏附的功能,可以抑制CCL18促进乳腺癌浸润和迁移的作用。说明整合素介导的乳腺癌细胞黏附于细胞外基质是乳腺癌浸润和迁移的关键步骤,初步阐明了CCL18促进乳腺癌浸润和迁移的机制,为抑制CCL18促乳腺癌浸润迁移提供了实验依据。
[1]Raymond K,Faraldo MM,Deugnier MA,et al.Integrins in mammary development[J].Semin Cell Dev Biol,2012,23(5):599-605.
[2]Crowe DL,Shuler CF.Regulation of tumor cell invasion by extracellular matrix[J].Histol Histopathol,1999,14(2):665-671.
[3]Lechner MG,Russell SM,Bass RS,et al.Chemokines,costimulatory molecules and fusion proteins for the immunotherapy of solid tumors[J].Immunotherapy,2011,3(11):1317-1340.
[4]Struyf S,Van Damme J.The role of plasma chemokines in cancer[J].Verh K Acad Geneeskd Belg,2007,69(3):149-165.
[5]Chen JQ,Yao YY,Gong C,et al.CCL18from Tumor-associated macrophages promotes breast cancer metastasis via PITPNM3[J].Cancer Cell,2011,19(4):541-555.
[6]Bourboulia D,Stetler-Stevenson WG.Matrix metalloproteinases(MMPs)and tissue inhibitors of metalloproteinases(TIMPs):Positive and negative regulators in tumor cell adhesion[J].Semin Cancer Biol,2010,20(3):161-168.
[7]Crowe DL,Shuler CF.Regulation of tumor cell invasion by extracellular matrix[J].Histol Histopathol,1999,14(2):665-671.
[8]Ito K,Ralph SJ.Inhibiting galectin-1reduces murine lung metastasis with increased CD4(+)and CD8(+)T cells and reduced cancer cell adherence[J].Clin Exp Metastasis,2012,29(6):561-572.
[9]Scaringi C,Minniti G,Caporello P,et al.Integrin inhibitor cilengitide for the treatment of glioblastoma:a brief overview of current clinical results[J].Anticancer Res,2012,32(10):4213-4223.
[10]Singh R,Lillard JW Jr,Singh S.Chemokines:key players in cancer progression and metastasis[J].Front Biosci(Schol Ed),2011(3):1569-1582.
[11]Kim CH,Lee KH,Lee CT,et al.Aggregation of beta2integrins activates human neutrophils through the IkappaB/NF-kappaB pathway[J].J Leukoc Biol,2004,75(2):286-292.
[12]Lee HJ,Jo DY.The role of the CXCR4/CXCL12axis and its clinical implications in gastric cancer[J].Histol Histopathol,2012,27(9):1155-1161.
[13]Tang X.Tumor-associated macrophages as potential diagnostic and prognostic biomarkers in breast cancer[J].Cancer Lett,2013,332(1):3-10.
[14]Schutyser E,Richmond A,Van Damme J.Involvement of CC chemokine ligand 18(CCL18)in normal and pathological processes[J].J Leukoc Biol,2005,78(1):14-26.
