藏药俄色叶中根皮苷、根皮素含量分析△
2014-09-26夏冬梅李敏王道清杨冰月敬勇
夏冬梅,李敏*,王道清,杨冰月,敬勇
(1.成都中医药大学 药学院,四川 成都 611137; 2.中药材标准化教育部重点实验室,四川 成都 611137; 3.中药资源系统研究与开发利用国家重点实验室,四川 成都 611137)
藏药俄色叶中根皮苷、根皮素含量分析△
夏冬梅1,2,3,李敏1,2,3*,王道清1,2,3,杨冰月1,2,3,敬勇1,2,3
(1.成都中医药大学 药学院,四川 成都 611137; 2.中药材标准化教育部重点实验室,四川 成都 611137; 3.中药资源系统研究与开发利用国家重点实验室,四川 成都 611137)
目的:建立测定藏药俄色叶中根皮苷、根皮素含量分析的方法。方法:根皮苷含量采用紫外-可见分光光度法进行测定,以甲醇为提取溶剂。根皮素含量采用HPLC进行含量测定,以40%乙醇为提取溶剂,以乙腈和0.04%磷酸溶液为流动相,梯度洗脱,流速为1 mL·min-1;检测波长为286 nm;柱温为30 ℃。结果:根皮苷与药材提取液的最大吸收波长一致。在此色谱条件下,根皮素色谱峰与其他色谱峰达到基线分离,平均回收率为102.6%,RSD=2.61%。19批俄色叶中根皮苷平均质量分数为22.11%,根皮素平均质量分数为0.51%。结论:该研究建立的方法能快速准确地测定俄色叶中根皮苷、根皮素的含量,可作为该药质量评价的参考依据,为俄色叶的开发利用提供理论基础。
俄色叶;根皮苷;根皮素;含量分析
藏药俄色叶为蔷薇科苹果属陇东海棠系植物变叶海棠Malustoringoides(Rehd.)Hughes或花叶海棠Malustransitoria(Batal.)Schneid的干燥叶,长期以来,在藏区多作保健食品用,常与酥油同煮口服,但关于俄色叶近代药用文献尚无,只在《藏药晶镜本草》和《四部医典》中有记载,具有保肝利胆、除腻涤滞、攻坚化积等功效[1-4]。现代药理研究表明,俄色叶总黄酮具有降血脂、降血糖的功效[5-7]。俄色叶主要含黄酮类成分,以二氢查尔酮类为主,如根皮素、根皮苷[8],其中根皮素是首次从俄色叶原植物中分离得到,根皮素具有抗癌[9]、抑制葡萄糖转运[10]、预防骨质疏松[11]、保护心血管等活性[12];根皮苷具有明显的降血糖、降血脂[13]和保肝作用[14],其二者药理活性与俄色叶总黄酮的药理作用相符。
目前,俄色叶已收载于《四川省藏药材标准》中,本研究以根皮苷、根皮素作为俄色叶质量评价的指标,建立其含量测定方法,这将有助于合理开发俄色叶资源,同时为这一民族药的质量控制提供科学依据。
1 仪器与材料
1.1 仪器
Agilent technologies 1200 高效液相色谱仪(四元梯度泵、1260 Infinity标准自动进样器、1260 DAD检测器);UV-1100型紫外可见分光光度计(上海天美科学仪器有限公司);KQ-500DB数控超声波清洗器(昆山市超声仪器有限公司);BP-12l s精密电子天平(浙江精密仪器有限公司)。
1.2 材料
19批俄色叶药材样品均为2011年从四川省甘孜州采集而得,经成都中医药大学中药鉴定教研室李敏教授鉴定为蔷薇科苹果属植物变叶海棠Malustoringoides(Rehd.)Hughes和花叶海棠Malustransitoria(Batal.)Schneid 的干燥叶,除2011年5月采集样品均为幼嫩的小叶外,其余样品均为大叶。俄色叶样品信息见表1。
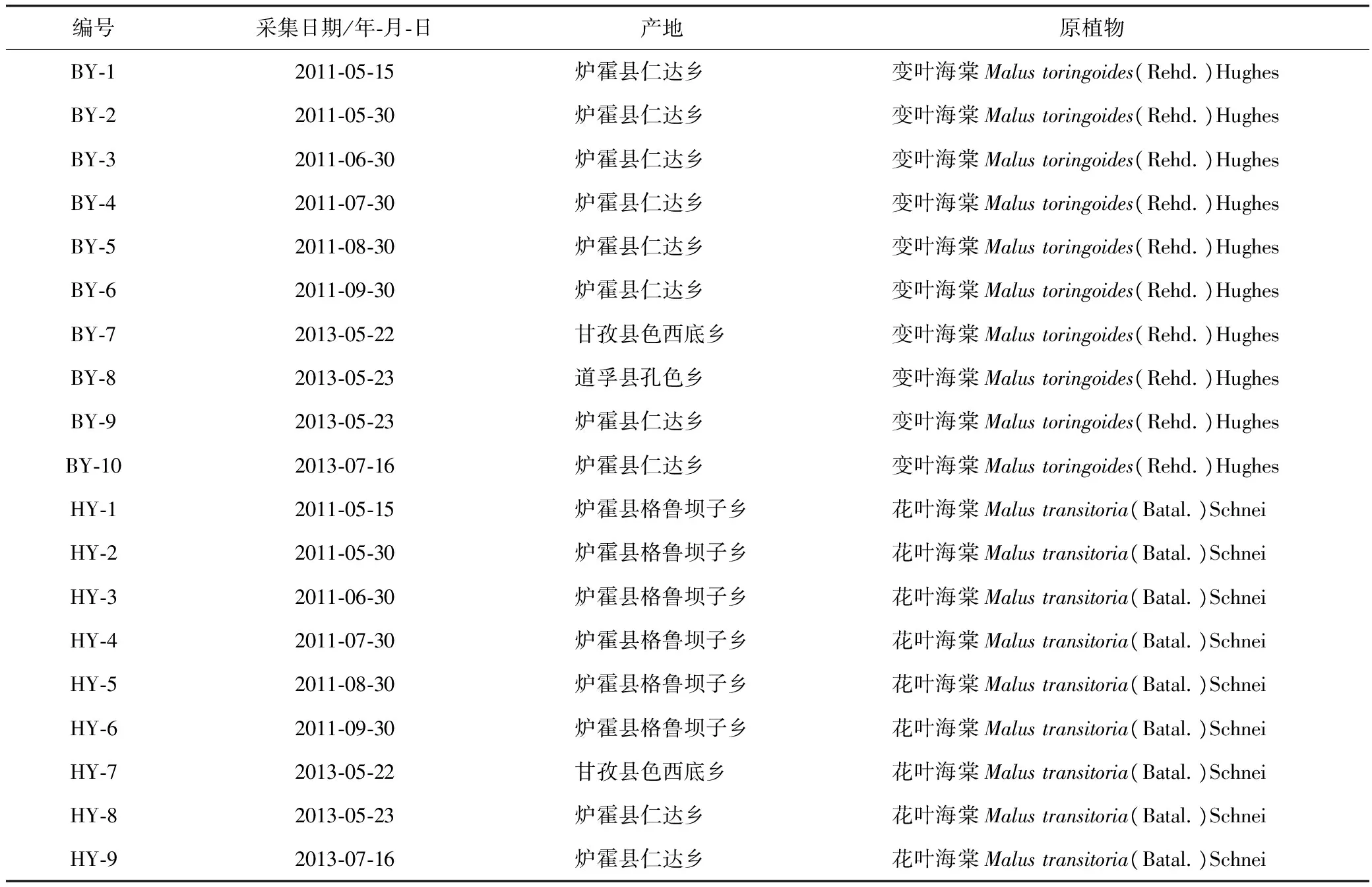
表1 不同产地及不同采收时间的俄色叶样品信息
根皮素对照品(自制,纯度99.7%);根皮苷对照品(曼思特生物有限公司,批号:MUST-12032102,纯度为98%);乙腈为色谱纯,水为超纯水,其余试剂均为分析纯。
根皮素对照品:为俄色叶的乙酸乙酯部位分离所得,并经MS和NMR鉴定;按照本方法的色谱条件归一化法测得其纯度为99.7%。理化数据如下:浅粉红色粉末(甲醇),TLC紫外灯下喷三氯化铝显色剂显亮蓝色。盐酸镁粉反应显阳性,初步判断为黄酮类或黄酮醇类化合物,分子式:C15H14O5。1H-NMR(600 MHz,DMSO-d6)δ:2.78(2H,d,J=7.6 Hz,β-H),3.23(2H,d,J=7.6 Hz,α-H),5.82(2H,s,H-3′,5′),6.68(2H,d,J=8.5Hz,H-3,5),7.03(2H,s,H-2,6),9.12(1H,s,4-OH),10.33(1H,s,4′-OH),12.23(2H,s,2′,6′-OH);13C-NMR(150 MHz,DMSO-d6)δ:30.0(C-β),45.9(C-α),94.4(C-3′,C-5′),103.9(C-1′),114.7(C-3,C-5),128.9(C-2,C-6),132.5(C-1),155.0(C-4),164.4(C-2′,C-6′),164.7(C-4′),205.0(C=O)。经与文献数据对比鉴定为根皮素(Phloretin)[15],结构式见图1。
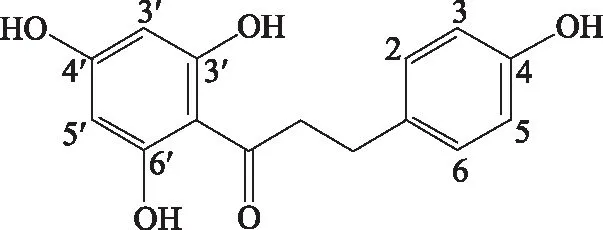
图1 根皮素化学结构
2 方法与结果
2.1 根皮苷含量测定
2.1.1 对照品溶液的制备 取根皮苷对照品适量,精密称定,加甲醇制成每1 mL含200 μg的溶液,即得。
2.1.2 供试品溶液的制备 精密称取俄色叶药材细粉0.1 g,置具塞锥形瓶中,精密加入甲醇50 mL,摇匀后,称定重量,超声提取30 min,甲醇补足减失的重量,摇匀,滤过。精密吸取续滤液0.2 mL,置10 mL容量瓶中,加甲醇稀释至刻度,摇匀,即得。
2.1.3 测定波长的选择 吸取根皮苷对照品溶液及供试品溶液各适量,以甲醇作空白对照,在紫外分光光度计200~600 nm波长下扫描,结果显示根皮苷对照品及供试品均在286 nm波长处有最大吸收,故选择286 nm作为测定波长。
2.1.4 方法学考察
2.1.4.1 标准曲线的绘制 精密量取对照品溶液0.2,0.4,0.6,0.8,1.0 mL,分别置10 mL容量瓶中,加甲醇稀释至刻度,摇匀。在285 nm处测定吸光度,以甲醇为空白对照。以根皮苷质量浓度为横坐标(X),吸光度A为纵坐标(Y),绘制标准曲线,得回归方程:Y=0.042 3X+0.001 5(r=0.999 0),表明根皮苷质量浓度在4.0~20.0 μg·mL-1与吸光度呈良好线性关系。
2.1.4.2 精密度试验 对同一份对照品溶液,连续测定吸光度6次。经计算根皮苷的RSD=0.30%(n=6),结果表明仪器精密度良好。
2.1.4.3 稳定性试验 对同一供试品溶液(HY-9)在第0,1,2,4,8,12 h依法测定吸光度,计算根皮苷的RSD=1.26%(n=6),结果表明供试品溶液在12 h内稳定。
2.1.4.4 重复性试验 精密称取6份样品(HY-9)细粉,各约0.1 g,照2.1.2项下的方法制备供试液,测定吸光度,经计算根皮苷的平均质量分数为20.01%,RSD=2.65%(n=6),结果表明重复性良好。
2.1.4.5 加样回收率试验 精密称取俄色叶药材细粉约0.1 g(HY-9),共6份,分别加入10 mg的根皮苷对照品,照2.1.2项下的方法制备供试液,测定吸光度,计算回收率,结果见表2。
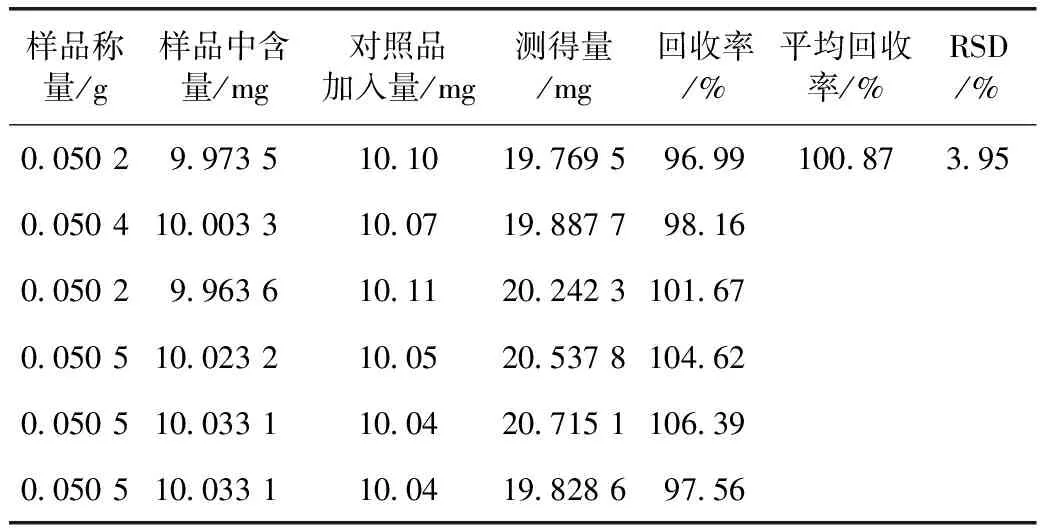
表2 俄色叶中根皮苷加样回收试验
2.1.5 样品中根皮苷的测定 精密称取俄色叶样品0.1 g(过5号筛),按2.1.2项下方法制备供试品溶液,测定其吸光度,计算根皮苷质量分数,结果见表3。
2.2 根皮素含量测定
2.2.1 色谱条件 色谱柱:Agilent Eclipse plus C18柱(250 mm×4.6 mm,5 μm);以乙腈(A)-0.04%磷酸溶液(B)为流动相进行梯度洗脱:0~10 min,22% A;10~20 min,22%~30% A;20~30 min,30% A;30~50 min,30%~50% A;50~55 min,50%~22% A。流速为1 mL·min-1;进样量为5 μL;柱温为30 ℃;检测波长为286 nm。理论板数按根皮素峰计算应不低于3 000。对照品及供试品溶液色谱图见图2。
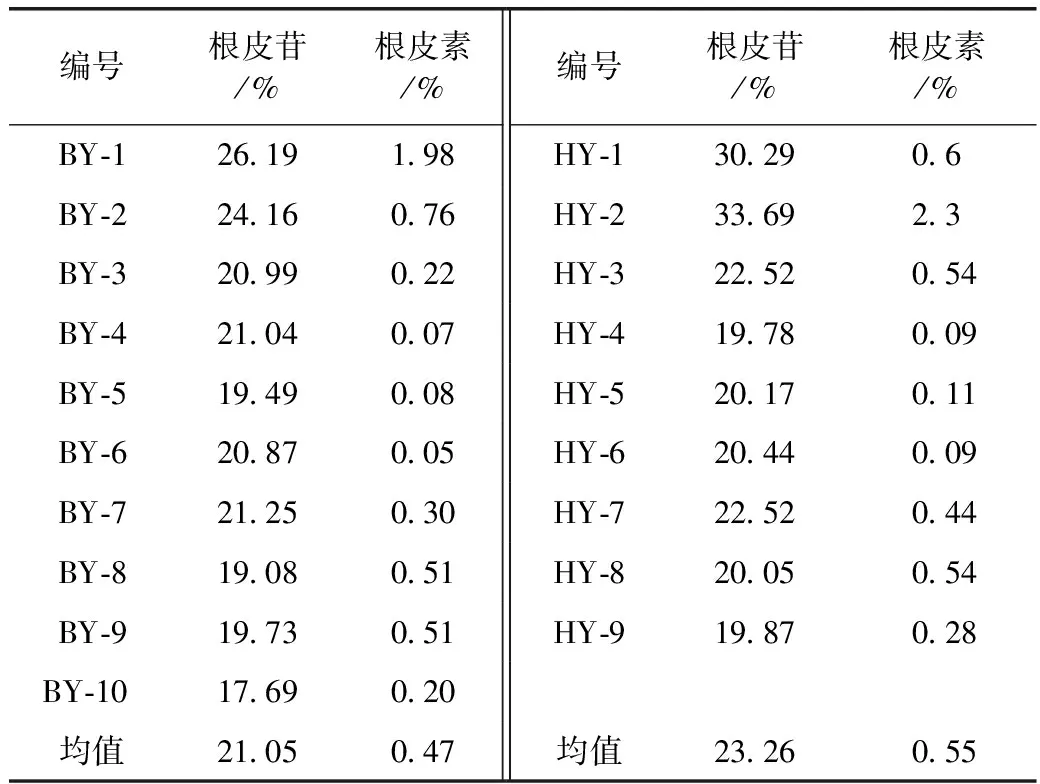
表3 不同产地及不同采收时间俄色叶中根皮苷、根皮素的测定(n=3)

A.根皮素对照品 B.变叶海棠(BY-4) C.花叶海棠(HY-9)图2 根皮素对照品及俄色叶供试品HPLC图
2.2.2 对照品溶液的制备 取根皮素对照品适量,精密称定,加甲醇制成每1 mL含40 μg的溶液,即得。
2.2.3 供试品溶液的制备 取本品细粉约0.5 g,精密称定,置具塞锥形瓶中,精密加入40%乙醇25 mL,密塞,称定重量,超声提取30 min,静置,用40%乙醇补足减失的重量,离心,取上清液用微孔滤膜(0.45 μm)过滤,即得。
2.2.4 方法学考察
2.2.4.1 标准曲线及线性关系考察 精密吸取对照品溶液2,5,10,20,30 μL注入液相色谱仪,按2.2.1项下色谱条件测定峰面积,以质量浓度(μg·mL-1)为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,得回归方程:Y=17.735 5X+5.297,r=0.999 9,表明根皮素质量浓度在17.26~252.0 μg·mL-1与峰面积呈良好的线性关系。
2.2.4.2 稳定性试验 取供试品溶液(BY-4),分别于0,2,4,8,12,24 h进行测定,测得其峰面积,经计算根皮素的RSD=2.2%,表明供试品液室温下放置24 h稳定。
2.2.4.3 精密度试验 精密吸取对照品溶液5 μL,重复进样5次,测得其峰面积,经计算根皮素的RSD=0.64%,表明该仪器精密度良好。
2.2.4.4 重复性试验 精密称取俄色叶样品(BY-4)5份,按2.2.3项下方法制备供试品溶液,按2.2.1色谱条件测得其峰面积,经计算根皮素的平均质量分数为0.75%,RSD=3.3%,表明该方法重复性良好。
2.2.4.5 加样回收率试验 精密称取俄色叶药材细粉约0.25 g(BY-4),共6份,分别加入1 mL根皮素对照品溶液(0.4 mg·mL-1),按2.2.3项下方法制备供试品溶液,按2.2.1色谱条件测定根皮素含量,计算回收率,结果见表4。

表4 俄色叶中根皮素加样回收试验
注:根皮素对照品加入量均为400 μg
2.2.5 样品中根皮素的测定 精密称取俄色叶样品0.5 g(过5号筛),按2.2.3项下方法制备供试品溶液,按2.2.1色谱条件测定峰面积,计算根皮素质量分数,结果见表3。
3 结论与讨论
3.1 含量测定方法
课题组前期对俄色叶的化学成分进行了系统预实验,表明该药含大量的黄酮类成分,并对其进行了提取分离,得到根皮素和根皮苷单体。本实验运用HPLC初步测定俄色叶不同提取溶剂中根皮苷、根皮素含量,根皮苷以甲醇为提取溶剂最佳,根皮素则以40%乙醇提取溶剂最佳。由于根皮苷的含量高,是根皮素的几十倍,无法同时测定,但根皮素抗氧化活性高,是根皮苷的几十倍[16-17],而且以甲醇作为提取溶剂中根皮素含量只有以40%乙醇作为提取溶剂的1/17,因此采用紫外-可见分光光度法所测定甲醇提取液中根皮苷含量受根皮素含量的影响极小,故本研究采用HPLC进行根皮素(C15H14O5)的含量测定,而根皮苷(C24H24O10)含量测定则采用紫外-可见分光光度法进行。
3.2 流动相的选择
分别考察了不同比例甲醇-水和乙腈-水的流动相,发现流动相为乙腈-水能获得较好的分离效果,但根皮素与之相邻的峰有时呈肩峰或一个峰的形式存在,在考察梯度洗脱程序中发现增加10 min的30%乙腈进行洗脱,效果最好,且分离度良好,两个峰的出峰时间间隔长。
3.3 小结
俄色叶中根皮苷平均含量为22.11%,根皮素平均含量为0.51%,其中变叶海棠的根皮苷平均含量为21.05%,根皮素平均含量为0.47%;花叶海棠的根皮苷平均含量为23.26%,根皮素平均含量为0.55%。花叶海棠的根皮苷、根皮素含量均比变叶海棠略高。在对比不同叶片大小方面,以小叶药材中的根皮苷、根皮素含量最高,且明显高于大叶药材。
本研究所建立的方法,稳定性、重复性及回收率好,结果可靠,可以准确、快捷地测定俄色叶中根皮苷和根皮素的含量。
[1] 嘎务.藏药晶镜本草[M]北京:民族出版社,1995:551-553.
[2] 宇妥宁玛·云丹贡波.四部医典[M].德格印经院木刻版.公元八世纪.
[3] 帝玛尔·丹增彭措.晶珠本草[M].北京:北京民族出版社,1986.
[4] 王道清,李敏,石万银.藏药俄色叶的资源调查及生药学研究[J].中药与临床,2011,2(3):14-16.
[5] 毛羽.苹果属花楸苹果组植物的新用途:中国,CN200810170831.8[P].2008-10-17.
[6] 毛羽.苹果属花楸苹果组植物的新用途:中国,CN200810170833.7[P].2008-10-17.
[7] 李燕,谢晓芳,李丹,等.俄色叶总黄酮对糖尿病的药理作用研究[J].中外医疗,2013,32(14):25-27.
[8] 赵军宁.四川民族药资源与开发利用[M].成都:四川科学与技术出版社,2010:384-389.
[9] 陈玲,刘军权,周忠海,等.根皮素对K562细胞增殖、凋亡和细胞周期的影响[J].中华血液学杂志,2011,32(12):876-877.
[10] Chih-Hsiung Wu,Yuan-Soon Ho,Chia-Yi Tsai,In vitro and in vivo study of phloretin-induced Apoptosis in human liver cancer cells involving inhibition of typeⅡglucose transporter [J].Int J Cancer,2008,124(9):2210-2219.
[11] Jung-Lye Kim,Min-Kyung Kang,Ju-Hyun Gong,et al.Novel antiosteoclastogenic activity of phloretin antagonizing RANKL-induced osteoclast differentiation of murine macrophages [J].Mol Nutr Food Res,2012,56(8):1223-1233.
[12] 焦鹏飞.根皮素对心血管的保护作用[J].现代医药卫生,2012,28(9):1284-1286.
[13] 冯天燕,方荣,邓改改,等.根皮苷对小鼠CCl4急性肝损伤的保护作用[J].中药药理与临床,2010,26(5):47-50.
[14] 张世阳,高海青.根皮苷药理研究进展[J].国际老年医学杂志,2011,32(6):281-285.
[15] 朱智勇,罗金花,张兵锋,等.马醉木的化学成分研究[J].中药材,2008,31(5):687-688.
[16] Bashir M Rezk,Guido R M M,Haenen.The antioxidant of phloretin:the disclosure of a new antioxidant pharanacophore in flavonoids[J].Biochem Bioph Res Co,2002,295:9-13.
[17] 杨昌英,王鋆植,代忠旭,等.以中性红为电化学探针考察根皮苷、根皮素与DNA的作用[J].天然产物研究与开发,2009,21(2):221-224.
QuantificationAnalysisofPhloridzin,PhloretininTibetanMedicine“Eseye”
XIADongmei1,2,3,LIMin1,2,3*,WANGDaoqing1,2,3,YANGBingyue1,2,3,JINGYong1,2,3
(1.CollegeofPharmacy,ChengduUniversityofTraditionalChineseMedicine,Chengdu611137,China;2.TheMinistryofEducationKeyLaboratoryofStandardizationofChineseHerbalMedicine,Chengdu611137,China; 3.StateKeyLaboratoryBreedingBaseofSystematicResearch,DevelopmentandUtilizationofChineseMedicineResources,Chengdu611137,China)
Objective:In the present study,the methods were established for detection and quantification analysis of phloridzin,phloretin in tibetan medicine “Eseye”.Methods:Phloridzin was extracted with methanol and determinated by UV.Phloretin was extracted by 40% ethanol and determinated by HPLC.Mobile phase was acetonitrile and 0.04% phosphoric acid with gradient elute.Flow rate was 1 mL·min-1.Detection wavelength was 286 nm.Column temperature was 30℃.Results:The maximum absorption wavelength of phloridzin is the same as “Eseye” extract.In this chromatographic conditions,the chromatographic peak of phloretin with other chromatographic peak can be achieved baseline separation,the method has good reproducibility,and the average recovery was 102.6%,RSD was 2.61%(n=6).This method determined phloridzin and phloretin in “Eseye”(19 batches)For the frist time,the average determination of phloridzin is 22.11%,and phloretin is 0.51%.Conclusion:This method can determine the content of phloridzin and phloretin in “Eseye” quickly and accurately.It can be used as a reference for quality evaluation,and provide theoretical basis for the exploitation and utilization of tibetan medicine “Eseye”.
Eseye;Phloridzin;Phloretin;Quantification analysis
10.13313/j.issn.1673-4890.2014.08.004
2014-02-28)
第四次全国中药资源普查(2012-H-100),2013年四川省藏药材标准制定
*
李敏,教授,博士生导师,研究方向:中药品种、质量及资源;E-mail:028limin@163.com
