高效液相色谱法测定稻米中二甲戊灵残留的研究
2014-09-24周天倚杨仁斌龙智勇
周天倚,杨仁斌,龙智勇
(1.湖南农业大学农业环保研究所,湖南 长沙 410128;2.湖南大学环境科学与工程学院,湖南 长沙 410082)
二甲戊灵,又名二甲戊乐灵,化学名称:N-1-(乙基丙基)-2,6-二硝基-3,4-二甲基苯胺[N-(1-ethylpropy)-3,4-dimethyl-2,6-dinitrobenzenamine],分子式C13H19N3O4,分子量为281.3,结构式见图1[1];其在水中的溶解度为 0.5 mg/L,熔点为54~58℃;该药在130℃以下的环境下化学性质稳定,挥发性小,不易光解,易溶于丙酮、二甲苯等大多数有机溶剂,属于二硝基苯胺类除草剂[2]。
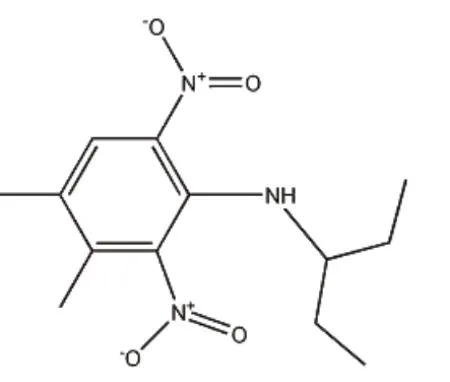
图1 二甲戊灵结构式Fig.1 The chemical structure of Pendimethalin
二甲戊灵是一种新型的低毒高效旱田除草剂,主要适用于防除玉米、大豆、小麦、花生和棉花等多种旱地作物的马唐、狗尾草、金狗尾草等1年生禾本科和阔叶杂草[3];其作用机理主要是通过抑制杂草芽和根的分生组织分裂,使其不能生长而死亡[4]。目前,该除草剂也在多种蔬菜和果树上使用[5]。
近年来,由于该除草剂的广泛使用,因而对其分析研究也日渐增多。例如:二甲戊灵在豆类[6-7]、青菜[8]、大蒜[9]及水果[10]中的残留分析研究,以及二甲戊灵的药理作用[11-15]和毒理作用[16-17]研究等。目前,用于二甲戊灵残留分析的主要方法有固相分离反相液相色谱法[15]、高效液相色谱法[18-20]、毛细管气相色谱法[21]和气相色谱法[22]等,但二甲戊灵在稻米中的残留分析方法还未见报道。试验采用高效液相色谱法检测稻米中的二甲戊灵,旨在建立一种适用于我国实验室条件的稻米中二甲戊灵的残留检测分析方法,为开展二甲戊灵在水稻中的残留毒理研究提供参考。
1 材料与方法
1.1 试验材料与仪器
试验主要试剂:二甲戊灵标准样品(纯度为99.6%,农业部农药鉴定所),甲醇(色谱纯和分析纯),丙酮、石油醚、二氯甲烷(均为分析纯),无水硫酸钠(600℃条件下烘8 h,分析纯),弗罗里硅土(60~100目,分析纯)。供试稻米为先农1号,采自湖南农业大学实验基地。
试验主要仪器:SPD-20A高效液相色谱仪(配紫外检测器和工作站,自带安捷伦Exlend C18不锈钢柱,5 μm×250 mm×4.6 mm,美国Agilent科技有限公司);AEU-210万分之一分析天平(厦门欣锐仪器仪表有限公司);KQ-100E超声波洗涤仪(昆山市超声波仪器有限公司);KYC-1102C恒温振荡仪(上海福玛实验设备有限公司);RE-2000旋转蒸发仪(上海亚荣生化仪器厂);棕色容量瓶(100 mL)及具塞三角瓶(250 mL)等实验室常用仪器设备。
1.2 试验方法
1.2.1 二甲戊灵的提取与净化 准确称取10 g稻米于250 mL具塞三角瓶中,准确加入50 mL分析纯甲醇,在恒温振荡仪上30℃振荡提取1 h后取出冷却至室温;经减压抽滤过滤,提取液经旋转蒸发仪浓缩至近干;加少量淋洗液(V石油醚︰V二氯甲烷= 75︰25)在超声波作用下溶解;再定量转移到层析柱(层析柱从下至上依次填有棉花、2 cm无水硫酸钠、5 g弗罗里硅土、2 cm无水硫酸钠,填充好的柱子先用10 mL石油醚润湿淋洗柱子)上,用40 mL淋洗液(同上)淋洗层析柱;收集全部淋出液在旋转蒸发仪中浓缩至近干,用色谱甲醇溶解并过0.22 μm有机膜后定容至5 mL,待HPLC测定。
1.2.2 二甲戊灵标准溶液的配制 准确称取0.526 g二甲戊灵标准样品,用色谱甲醇溶解并转至100 mL棕色容量瓶中,配成500 mg/L的母液备用;用梯度稀释法分别配制2.500、1.250、0.500、0.250、0.125、0.050 的mg/L系列二甲戊灵标准溶液。
1.2.3 HPLC检测条件 (1)检测波长:用SPD-20高效液相色谱仪在200~400 nm波长范围内对0.5 mg/L的二甲戊灵标准溶液进行紫外扫描,综合考虑分离度、峰形、保留时间等因素来选择最佳测试波长。(2)流动相:固定高效色谱仪的柱温(30℃)、检测波长(238 nm)、流速(1 mL/min)等条件,在流动相的比例V甲醇︰V水=70︰30~90︰10的范围内选定若干个不同体积比的流动相,对浓度为0.5 mg/L的二甲戊灵标液进行检测,综合考虑分离度、峰形、保留时间等因素来选择最优的流动相配比。(3)柱温:固定高效色谱仪的检测波长(238 nm)、流动相比例(V甲醇︰V水=85︰15)及流速(1 mL/min)等检测条件,在20~40℃范围内依次递增5℃对0.5 mg/L的二甲戊灵标液进行检测,综合考虑分离度、峰形、保留时间等因素来确定最优的检测温度。
1.2.4 标准曲线绘制 将不同浓度的二甲戊灵标准溶液,在最佳检测条件下测定,以二甲戊灵进样浓度与相对应的色谱峰面积作标准曲线。
1.2.5 检测方法精密度的测定 在最佳检测条下对添加了0.5 mg/L二甲戊灵标准溶液的稻米样品连续测定5次,对峰面积数据进行统计分析,根据变异系数来衡量方法的精密度。
1.2.6 添加回收试验 在空白稻米样品中加入0.1、0.2、2.0 mg/kg 的二甲戊灵标准溶液,按上述方法提取、净化、浓缩、定容、检测,每个添加浓度重复5次,计算添加回收率,并作统计分析。
2 结果与讨论
2.1 最佳检测波长
由图2可知,波长在238 nm和248 nm时,干扰较小,峰形较完整;但波长为238 nm时峰面积大于波长为248 nm时的峰面积,因此选择238 nm为该方法的最佳检测波长。
2.2 最佳流动相比例
根据出峰的时间和与杂质的分离程度,从图3中可看出,在甲醇与水的体积比为75︰25和80︰20时,二甲戊灵不能出峰(峰面积几乎为零);而比例为85︰15和90︰10时,峰的分离程度较好,但比例为85︰15时的峰面积明显比90︰10时的大,表明在V甲醇︰V水=85︰15时,对二甲戊灵的灵敏度较高,更有利于低浓度二甲戊灵的检测;同时,V甲醇︰V水=90︰10时,出峰时间在6.4 min,容易受到样品中杂质峰的干扰,影响到测定结果。因此,选择V甲醇︰V水=85︰15作为该方法的最佳流动相比例。
2.3 柱温的确定
从表1中看出,在不同柱温条件下,出峰时间和峰面积有一定的差异,其中以20和25℃时,峰面积较大,但是其出峰时间较迟,容易与杂质峰重叠。因此,综合考虑之后确定30℃为最佳柱温。该试验结果与李永新等[19]的研究结果一致。
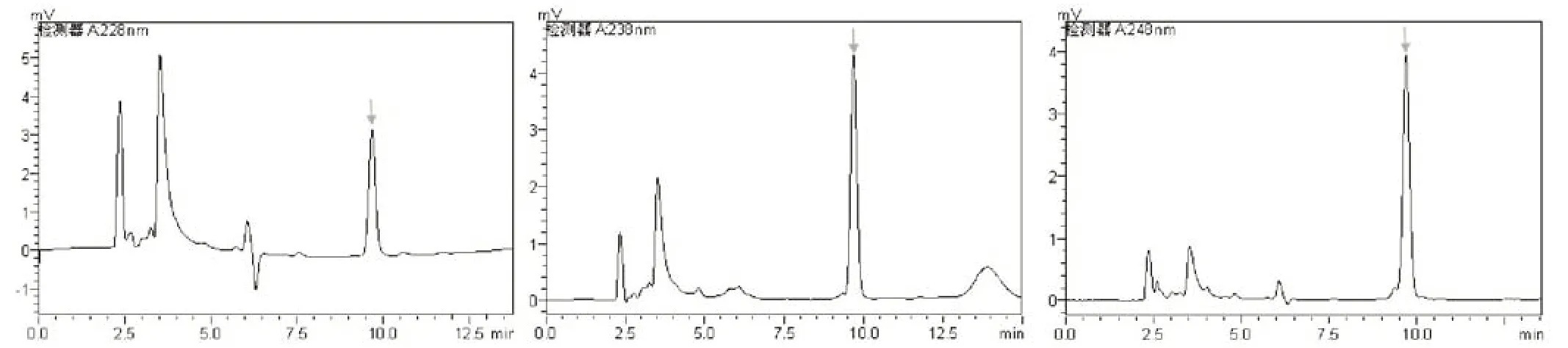
图2 在不同检测波长下二甲戊灵标准液的色谱图Fig.2 Chromatography of Pendimethalin under different wavelength
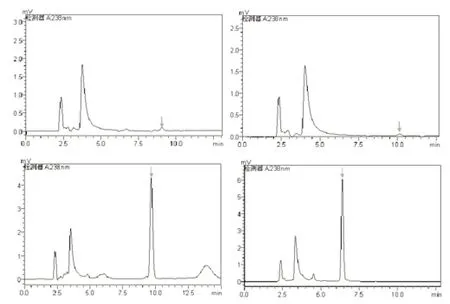
图3 流动相比例不同时二甲戊灵的色谱图Fig.3 Chromatography of Pendimethalin under different percentages of mobile phase
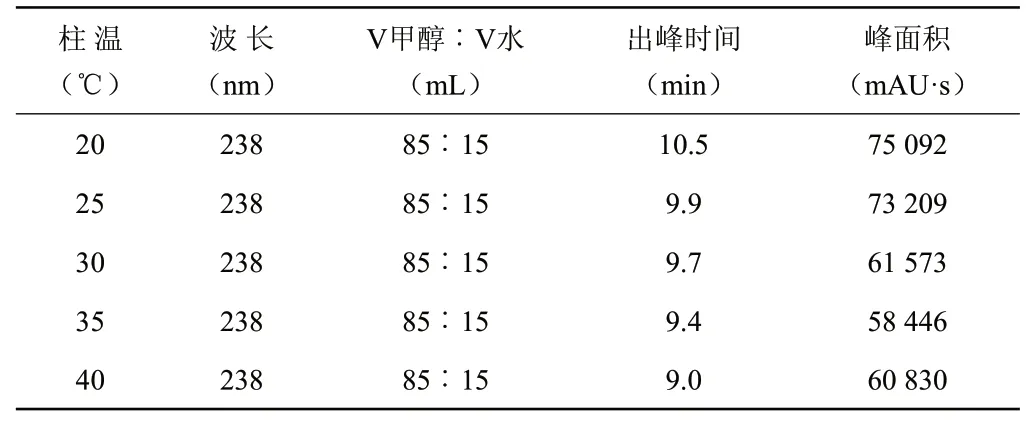
表1 色谱柱温对二甲戊灵的影响Table 1 Effects of different temperatures of chromatogram columnon Pendimethalin
2.4 标准曲线
将不同浓度的二甲戊灵标准溶液,在流动相V甲醇︰V水= 85︰15 、流速1 mL/min、检测波长238 nm、柱温30℃、进样量20 μL的检测条件下进行测定,以二甲戊灵进样浓度与相对应的色谱峰面积作标准曲线(图4)。结果表明,二甲戊灵的浓度与峰面积呈现良好的线性关系,线性回归方程为:Y = 111 826 x+990.32,相关系数为0.999 8。这说明该检测条件可以满足0~2.500 mg/L范围内二甲戊灵的检测。在此条件下,二甲戊灵的检测图谱清晰、分离度较好、峰形完整(图5)。
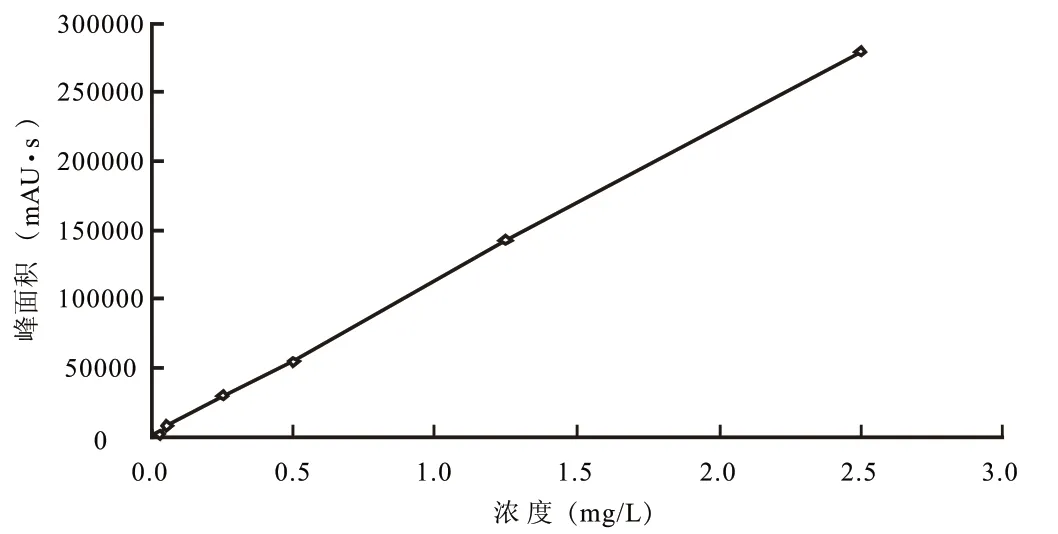
图4 二甲戊灵的标准曲线Fig.4 Standard curve of Pendimethalin
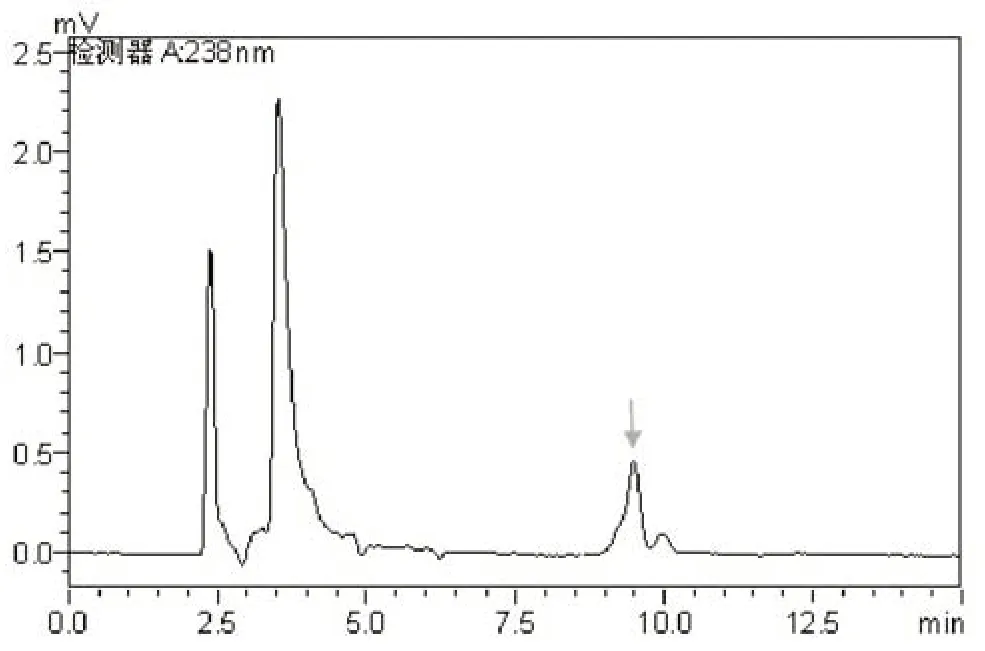
图5 二甲戊灵标样的色谱图Fig.5 Chromatogram of standard Pendimethalin sample
2.5 方法精密度
在最佳检测条下,对添加了0.5 mg/L二甲戊灵标准溶液的稻米样品连续测定5次,其峰面积分别为60 988、61 293、60 553、61 078和61 573 mAU·s,变异系数为0.619%。这表明该方法精密度较好,仪器的稳定性和重现性较高。
2.6 添加回收率测定
从表2中看出,当二甲戊灵在稻米中添加浓度为0.1、0.2、2.0 mg/kg 时,添加回收率为87.40%~ 94.16%,变异系数为3.38%~6.70%,仪器最小检出限为9.14×10-12g,方法最低检出浓度为0.005 mg/kg,符合农药残留量分析方法的技术要求[4]。
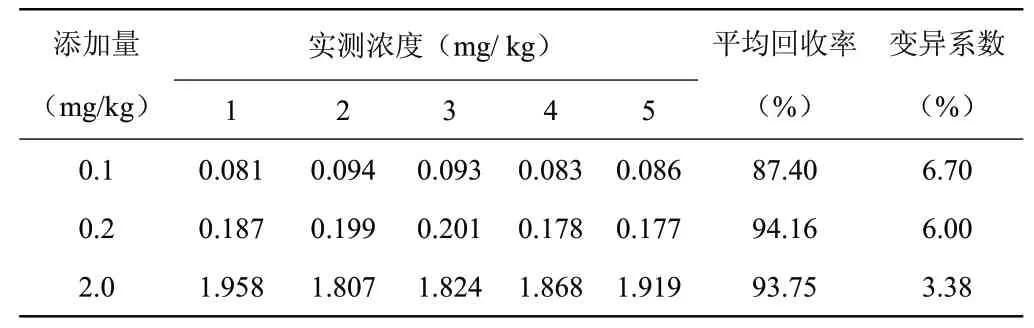
表2 二甲戊灵在稻米中添加的回收率Table 2 Recoveries of Pendimethalin in rice
3 结论与讨论
使用HPLC检测稻米中二甲戊灵的方法有灵敏度高、稳定性好等优点。试验结果表明,最佳检测条件为:检测波长238 nm,流动相比例V甲醇︰V水= 85︰15,柱温30℃,流速1 mL/min,进样量20 μL。在该检测条件下,对稻米添加标准样品的回收率为87.40%~94.16%,变异系数为3.38%~6.70%,仪器最小检出限为9.14×10-12g,方法最低检出浓度为0.005 mg/kg,符合农药残留检测要求。这表明该方法可用于稻米中的二甲戊灵残留检测。
在提取和净化稻米样品中的二甲戊灵时,采取了过层析柱的措施,大大降低了稻米中杂质对提取结果的影响。该措施充分利用了二甲戊灵的水溶性较低、易被有机溶剂萃取的特性,同时对抽滤过程中进入滤液的米粒起到了过滤作用,对其他杂质也有较好的分离效果,大大提高了检测样品中的二甲戊灵纯度,有效避免了杂质的干扰。
[1]张 宇.二甲戊灵在马铃薯和土壤中的残留及吸附研究[D].吉林:吉林农业大学硕士学位论文,2005.
[2]王振荣,李布青.农业商品大全[M].北京:中国商业出版社,1996.543-651.
[3]高 明,万建兵.45%二甲戊灵微胶囊剂防除冬小麦田杂草试验[J].现代农药,2011,10(3):55-56.
[4]农业部农药检定所.农药残留量实用检测方法手册第3卷[M].北京:中国农业出版社,2005.528-530.
[5]王 军,朱鲁生,林爱军,等.二甲戊灵的残留毒理研究现状[J].农药,2001,40(6):8-11.
[6]Shobha S.Dissipation of Pendimethalin in Soil and Its Residues in Chickpea (Cicer arietinum L.) Under Field Conditions [J].Bull Environ Contam Toxicol,2012,89:1032-1036.
[7]杨 挺,朱 勇,赵 健,等.豆类蔬菜中二甲戊乐灵残留检测方法研究[J].食品科技,2006,(10):246-248.
[8]潘康标,黄 彧,徐炜枫,等.青菜中二甲戊灵的残留分析方法[J].南京晓庄学院学报,2010,6(13):47-49.
[9]张丽芬.二甲戊乐灵在大蒜中残留分析方法的研究[J].四川教育学院学报,2005,(7):91-92.
[10]陈其勇,郑文杰,肖亚兵,等.果蔬中二甲戊乐灵、氟乐灵、双丁乐灵残留测定[J].食品研究与开发,2011,32(9):155-158.
[11]刘自友,郭洪伟,肖圣乾,等.30%二甲戊灵·扑草净悬浮剂防除棉花田杂草试验[J].安徽农学通报,2010,16(13):141-142.
[12]张学文,刘亦学,张丽华,等.50%乙草胺微乳剂防除大豆田杂草及其安全性[J].农药,2006,(5):342-343.
[13]胡春明.3 30 g/L二甲戊灵EC防除水稻旱育秧田杂草试验[J].安徽农学通报,2011,17(9):144-145.
[14]许秀杰,张相权.18%二甲戊灵·异恶草松可湿性粉剂防除移栽稻田杂草药效试验研究[J].现代农药,2007,6(3):45-47.
[15]孙福生,董 杰.基质固相分散—反相液相色谱法测定蔬菜中二甲戊灵乐农药残留[J].分析试验室,2010,(2):69-72.
[16]Danion M,Le F S,Castric J,et al.Effect of chronic exposure to pendimethalin on the susceptibility of rainbow trout,Oncorhynchus mykiss L.,to viral hemorrhagic septicemia virus (VHSV)[J].Ecotoxicology and Environmental Safety,2012,79:28-34.
[17]Undeğer U,Schlumpf M,Lichtensteiger W.Effect of the herbicide pendimethalin on rat uterine weight and gene expression and in silico receptor binding analysis [J].Food and Chemical Toxicology,2010,48(2):502-508.
[18]宋 钰,孙泰威.18%二甲戊灵·异恶草松可湿性粉剂的高效液相色谱分析[J].化学工程师,2009,165(6):56-57.
[19]李永新,李 倩,潘红梅,等.高效液相色谱法测定水中二甲戊乐灵[J].现代预防医学,2006,33(5):786-789.
[20]吴兵兵,胡 敏,张 强,等.二甲戊灵的GC和HPLC分析方法研究[J].化工中间体,2008,(7):7-9.
[21]张 强,胡 敏,李二虎,等.毛细管气相色谱法定量分析二甲戊灵[J].现代农药,2007,6(1):27-28.
[22]李 闯,侯志广,刘建国,等.气相色谱法测定大蒜中二甲戊乐灵·乙氧氟草醚·乙草胺3种除草剂的残留[J].安徽农业科学,2011,39(22):13429-13430,13433.
