Lck-Cre×Perpflox/flox条件敲除小鼠的繁育及基因型鉴定
2014-09-21冷潇周艳唐海明张祥刘佳杨佩王衍堂
冷潇,周艳,唐海明,张祥,刘佳,杨佩,王衍堂*
(1.成都医学院基础医学院免疫教研室,成都 610083;2.四川大学华西第二医院急诊医学科,成都 610041)
伴随动物转基因技术近半个世纪以来的飞速发展,基因敲除动物已经成为生物医学研究领域极为重要的工具之一[1]。由于小鼠与人类遗传基因高达85%的同源性,小鼠成为除人类以外的第二个完成全基因组测序的哺乳动物。同时,大量的基因敲除小鼠品系已建立,并应用于基因功能研究[2]。但因为整体敲除动物易发生胚胎致死突变,以及基因在多个器官系统敲除后,出现生物学功能的相互干扰,影响基因敲除效应分析的准确性等问题,对敲除动物在基因功能研究中的深入应用产生了相当的困扰。条件性基因敲除技术的出现完美地规避了以上问题,其通过将某种细胞特异性表达重组酶的转基因小鼠和靶基因钳制小鼠杂交,得到在该种特定类型的细胞靶基因特异性敲除且敲除阶段完全可控的转基因小鼠,从而为靶基因在特异组织或器官的功能研究提供了一个极为优秀的平台[3,4]。
本课题组研究的目标基因Perp,在外周T淋巴细胞发育以及自身免疫性疾病的发生发展中均起着重要作用。但Perp全身敲除的纯合子小鼠因为皮肤上皮细胞桥粒功能的缺陷,极易自发广泛且严重的表皮内松解性大疱,极少能存活至成年期,在出生2w内即出现大量死亡[5,6]。因此,笔者从美国Jackson实验室引进了Perp基因条件敲除鼠(conditional knock out mic,cKO mice)以及 Lck-Cre转基因小鼠[7],借助Cre-LoxP位点特异性重组酶系统,构建Perp基因在免疫系统中特异性敲除的工具小鼠,并以此为基础进一步在整体动物水平研究Perp基因在T细胞发育以及在自身免疫疾病发病中的作用。
1 材料与方法
1.1 实验材料
1.1.1 实验动物PerpcKO杂合子型(Perpfl/+)小鼠及Lck-Cre杂合子小鼠均购自美国Jackson实验室。小鼠引进后在成都医学院科研实验中心SPF级实验动物房进行实验与繁殖。
1.1.2 主要实验试剂 基因组DNA提取纯化试剂盒(Wizard);PCR试剂盒(Fermentas);荧光定量PCR试剂盒(TaKaRa);兔抗鼠Perp多克隆抗体(Santa Cruz)。
1.2 实验方法
1.2.1Perp条件基因敲除小鼠的建立 由于引进的Perp条件敲除小鼠均为杂合子,所以采用1只雄鼠与1只雌鼠进行合笼繁殖,其F1子代小鼠可能出现野生型(Perp+/+)、杂合子(Perpfl/+)和纯合子(Perpfl/fl)3种表型。故需应用PCR以及电泳法在子代3~4w时进行Perp基因loxp位点的鉴定。将鉴定为纯合子(Perpfl/fl)的F1代小鼠继续采用1只雄鼠与1只雌鼠进行合笼繁殖,F2代小鼠则只会出现纯合子(Perpfl/fl)表型。继续将Perpfl/fl纯合子小鼠与Lck-Cre杂合子小鼠雌雄合笼,应用PCR以及电泳法进行Perp基因loxp位点以及表达Cre重组酶的鉴定,筛选得到Perpfl/+×LckCre/+小鼠,即为实验需要的Perp基因T淋巴细胞特异性敲除小鼠。
1.2.2 聚合酶链反应(PCR)及水平电泳 PCR反应引物由上海生工合成,引物序列见表1。采用PCR扩增仪(ABI)进行Perptm2Att序列和Generic Cre序列的循环扩增,设置的反应条件分别见表2、表3。取PCR反应终产物3μL在1%琼脂糖凝胶电泳,DL2000作为DNA分子量标记物,10V/cm进行电泳,全自动凝胶图像系统(Bio-rad)分析成像并保存。
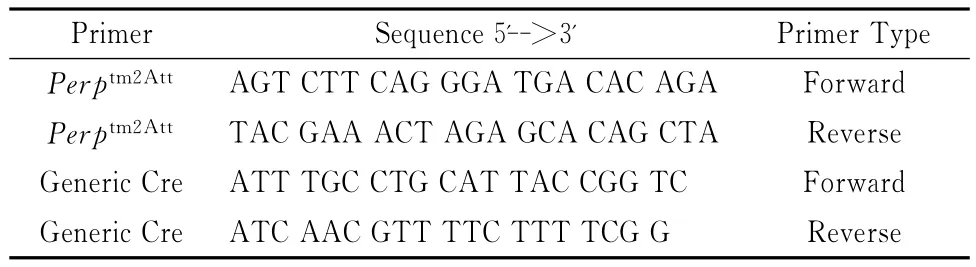
表1 PCR反应引物序列

表2 Perptm2Att序列的PCR反应条件
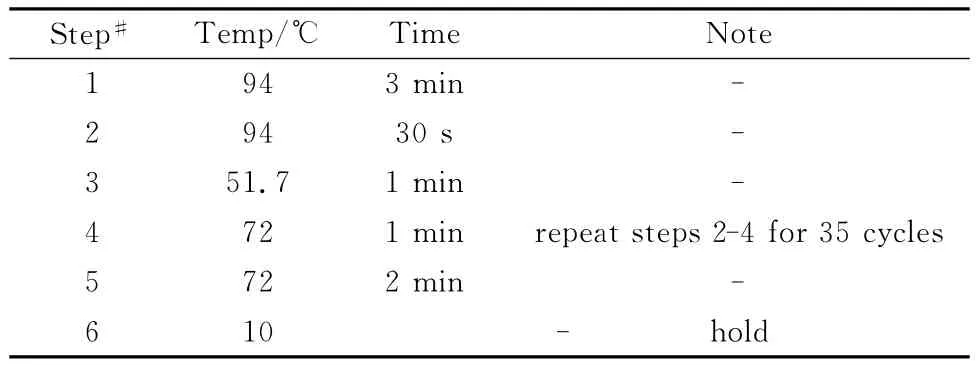
表3 Generic Cre序列的PCR反应条件
1.2.3 qPCR以及Western Blot检测Perp表达水平 脱臼处死小鼠,取出脾脏,制备脾细胞悬液。注入尼龙毛柱(日本和光公司),37℃,5%CO2孵箱孵育1h,得到纯化的T细胞。应用Trizol法抽提细胞RNA,以此为模板,借助逆转PCR试剂盒(TAKARA),通过PCR反应逆转录为cDNA。设计Perp基因的实时荧光定量PCR反应引物序列:Perpforward,5`-GACCCCAGATGCTTGTTTTC-3`;Perpreverse,5`-ACCAG-GGAGAT GATC TGGAA-3`。应用 qPCR 试剂盒 (TAKARA),在Real-time PCR仪(Bio-rad)上分析Perp基因在脾脏T淋巴细胞中的表达水平。
应用细胞裂解及蛋白抽提试剂盒(碧云天)从脾脏T细胞中提取总蛋白,BCA法(Termo)测定蛋白浓度后,应用Western Blot法测定在脾脏T淋巴细胞中Perp蛋白的表达水平。全自动凝胶图像系统(Bio-rad)分析成像并保存。
1.3 统计学方法
所有数据采用Graphpad Prism 6.0软件进行统计学分析,实验结果用均数±标准差(±s)表示,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Perpflox小鼠的繁殖、生长及鉴定
Perpflox杂合子小鼠雌雄合笼繁殖出F1子代小鼠,子代小鼠基因型鉴定结果见图1。筛选出的F1代Perpflox纯合子小鼠,继续雌雄合笼繁殖出F2子代小鼠,经鉴定全部为Perpflox纯合子小鼠。

图1 Perpflox小鼠基因型的鉴定结果
2.2 表达Cre重组酶小鼠的繁殖、生长及鉴定
T淋巴细胞特异性表达Cre重组酶的小鼠与Perpflox纯合子小鼠雌雄合笼繁殖。对F1代小鼠进行基因型鉴定,筛选得到表型为Lck-Cre×Perpfl/+的杂合子小鼠。将Lck-Cre×Perpfl/+的杂合子小鼠继续雌雄合笼繁殖。对F2代小鼠进行基因型鉴定,筛选得到表型为 Lck-Cre×Perpfl/fl的Cre重组酶阳性的纯合子小鼠即为实验需要的小鼠基因型。部分小鼠的鉴定结果见图2。
2.3 Lck-Cre×Perpflox/flox小鼠脾脏T细胞中Perp的表达水平
应用荧光定量PCR及Western Blot法检测发现Lck-Cre×Perpflox/flox小鼠脾脏T细胞的Perp基因的RNA及蛋白表达水平与Lck-Cre×Perp+/+小鼠相比显著降低(见图3)。
3 讨论
条件性基因敲除(conditional knockout)是将某个基因在生物特定类型的细胞或发育的某一特定阶段静默的基因打靶方法,是在常规基因敲除的基础上,利用重组酶介导的位点特异性重组技术,在生物基因敲除的范围和时间上均处于一种可控状态。借助这一新型的条件打靶技术,实现了基因在时间和空间上特异性敲除的效果,从而可以避免关键基因在完全性敲除(complete knockout)后的胚胎致死以及发育缺陷等问题[8,9]。条件性基因敲除的实现则主要依赖Cre-LoxP和FLP-frt重组系统,这两个系统是真核细胞内染色体位点特异性重组酶的同源系统。其主要原理为在待敲除的一段目标DNA序列的两端各放置一个loxP(或Frt)序列,得到flox(flanked by loxP)小鼠。将flox小鼠与带有细胞特异性表达的Cre(或Flp)的小鼠交配繁殖,以获得在特定细胞里把目标基因敲除掉的小鼠,即条件性基因敲除小鼠[10]。与 FLP/frt重组系统相比,Cre/LoxP重组系统在构建条件性基因敲除小鼠的应用中更为广泛,主要有以下原因:1)Cre酶的活性较Flip酶更高,且Cre酶的最适反应温度在37℃左右,与哺乳动物的体温非常接近,而Flip酶的最适温度是30℃,优化后的活性依然不如Cre酶。2)Cre-LoxP系统经过20多年的发展和应用,尤其在免疫学领域已经研发了大量的Cre酶工具鼠,以至于目前绝大部分应用于条件敲除的工具鼠都是Cre酶工具鼠,因此借助Cre-LoxP系统可以将flox小鼠与更多的工具鼠交配,将极大地拓展笔者研究的广度[11,12]。
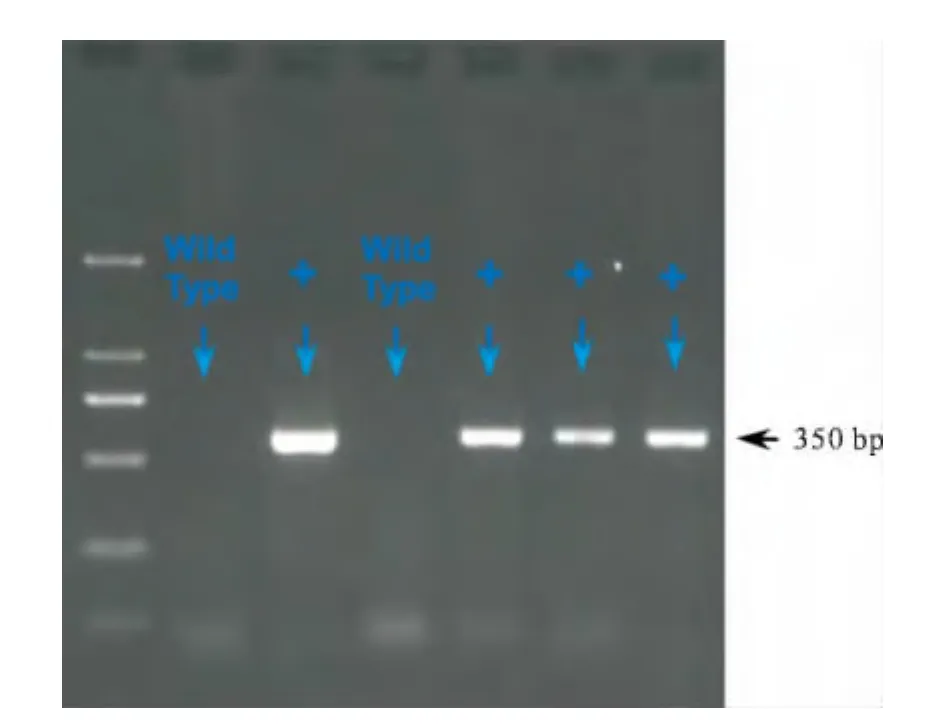
图2 表达Cre重组酶的小鼠基因型的鉴定结果
本课题组研究的目标基因Perp位于6号染色体6q24区域。由于Perp基因是凋亡调控中的关键基因,与上皮细胞桥粒功能以及皮肤肿瘤的发生密切相关。因此,Perp基因的完全性敲除小鼠在幼年期病死率极高,难以进行该基因功能的相关性研究。本课题组通过引进Perp基因条件敲除鼠以及Lck-Cre转基因小鼠,利用Cre-LoxP重组酶系统,构建Perp基因在免疫系统中特异性敲除的工具小鼠,并借助PCR扩增以及琼脂糖电泳法对Perpflox小鼠和表达Cre重组酶的转基因小鼠进行基因型鉴定,保证了应用Cre-LoxP系统进行条件敲除前的flox小鼠和Cre小鼠是预想的基因型背景(见图1、2)。在构建完成 Lck-Cre×Perpfl/fl的条件敲除小鼠后,进一步应用荧光定量PCR反应和western blot法验证了小鼠脾脏T淋巴细胞中Perp基因mRNA和蛋白的表达水平(见图3),证实在Perp基因条件敲除后,在目标类型的细胞上静默效果完全符合预期。

图3 Lck-Cre×Perpflox/flox小鼠脾脏T细胞中Perp的表达分析
综上所述,Lck-Cre×Perpfl/fl的条件敲除小鼠成功构建,将有利于我们在整体动物水平研究Perp基因在T细胞发育以及在自身免疫疾病发病中的作用。
[1]Miao X.Recent advances in the development of new transgenic animal technology[J].Cell Mol Life Sci,2013,70(5):815-828.
[2]Dean S.Transgenic animal mutation models:a review of the models and how they function[J].MethodsMol Biol,2012,817:377-397.
[3]Zhang J,Zhao J,Jiang WJ,etal.Conditional gene manipulation:Cre-ating a new biological era[J].J Zhejiang Univ Sci B,2012,13(7):511-524.
[4]Lin FY,Yang X.[Issues and solutions of conditional gene targeting][J].Yi Chuan,2011,33(5):469-484.
[5]Dusek RL,Bascom JL,Vogel H,etal.Deficiency of the p53/p63targetPerpalters mammary gland homeostasis and promotes cancer[J].Breast Cancer Res,2012,14(2):R65.
[6]Beaudry VG,Jiang D,Dusek RL,etal.Loss of the p53/p63 regulated desmosomal proteinPerppromotes tumorigenesis[J].PLoS Genet,2010,6(10):e1001168.
[7]Boo K,Baek SH,Lee H.Pontin is required for pre-TCR signaling at theβ-selection checkpoint in T cell development[J].Biochemical and Biophysical Research Communications,2014,447(1):44-50.
[8]Sun X,Fu X,Li J,etal.Heterozygous deletion of Atbf1by the Cre-loxP system in mice causes preweaning mortality[J].Genesis,2012,50(11):819-827.
[9]Reinert RB,Kantz J,Misfeldt AA,etal.Tamoxifen-Induced Cre-loxP Recombination Is Prolonged in Pancreatic Islets of Adult Mice[J].PLoS One,2012,7(3):e33529.
[10]Peng Z,Zhao Z,Nath N,etal.Generation of long insert pairs using a Cre-LoxP Inverse PCR approach[J].PLoS One,2012,7(1):e29437.
[11]Tan X,Liang F,Cai K,etal.Application of the FLP/FRT recombination system in cyanobacteria for construction of markerless mutants[J].Appl Microbiol Biotechnol,2013,97(14):6373-6382.
[12]Leprince A,Janus D,de Lorenzo V,etal.Streamlining of a Pseudomonas putida genome using a combinatorial deletion method based on minitransposon insertion and the Flp-FRT recombination system[J].MethodsMol Biol,2012,813:249-266.
