乙醇在浓硫酸催化下,温度不同产物不同之因探析
2014-09-20
(天津市第一轻工业学校,天津 300131)
乙醇在浓硫酸的催化下,发生脱水反应,这是消去反应的一个很好的例子。但要讲清道理与原因,对初学者来讲还是有一定的难度,单从反应的机理上来讲,对于学生还是存在不好理解的问题,还有必要说明为什么会在不同温度下形成不同产物的原因。笔者试着讨论分析如下。
一、反应方程式

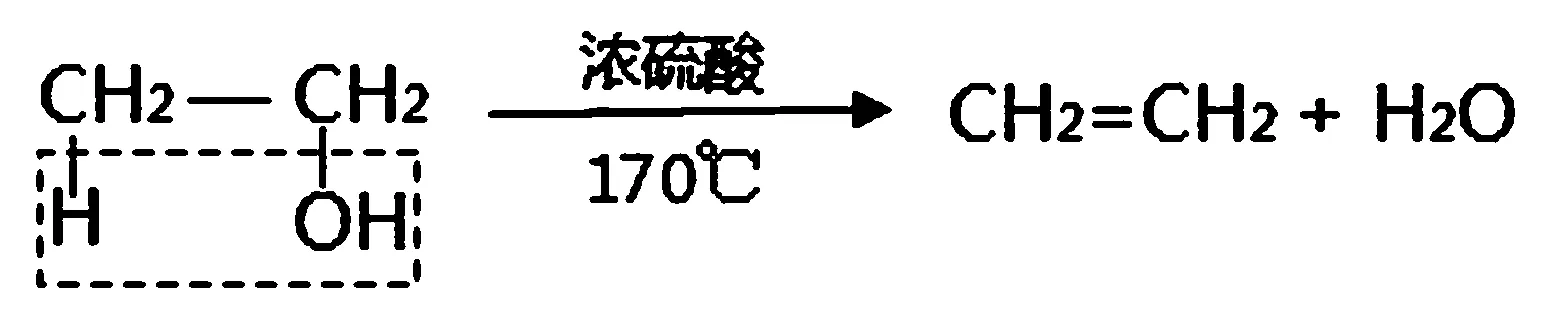
二、反应机理
1.乙醇分子间脱水反应是按照SN2机理进行的,具体过程如下:
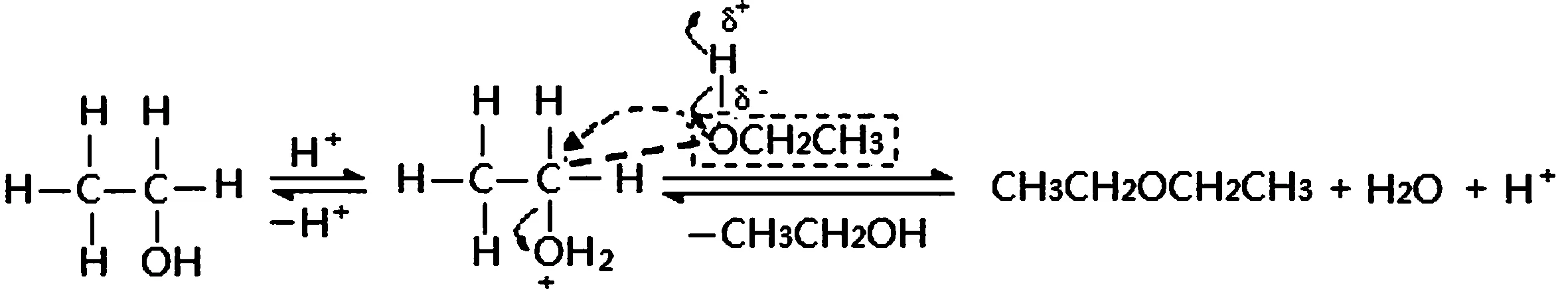
2.乙醇分子内脱水反应是按照E1机理进行的,具体过程如下:
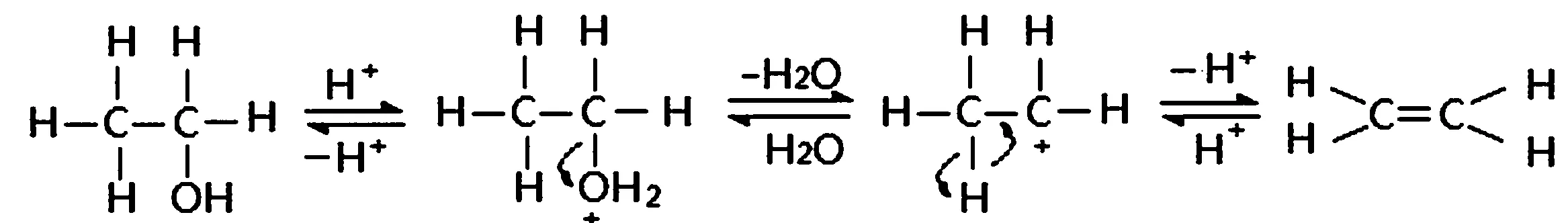
上述反应都是脱水反应,所不同的是分子间脱水和在分子内脱水。从反应的条件上看,反应1所需的能量低些;而反应2所需的反应能量要高些。那么为什么会有如此之不同,原因何在呢。
三、乙醚、乙烯的形成与原因
1.乙醚的形成
乙醚是由两个乙醇分子间脱水而得。相当于一个乙醇分子提供―OH基团、另一个乙醇分子上的―OH基团提供H+离子而形成一分子醚与一分子水。
2.乙烯的形成
乙烯是由一个乙醇分子在其分子内脱去一分子水而得。其反应的机理与醚的形成基本相同,只是再释放出H+基团的不是由另一个乙醇分子的―OH基团提供,而是由与其相连的CH3―基团上的―H以H+基团的形式脱下来的,恢复催化剂的活力的。
3.乙醚、乙烯形成原因探析
(1)乙醚的形成原因探析
首先是浓硫酸催化剂中的H+对乙醇分子上的―OH基团进行质子化,形成―OH2+基团,加大乙醇分子上的―OH基团离去的能力。在质子化的过程中,造成与其相连接的C原子产生正电性,另一个乙醇分子的―OH基团的O向离去―OH2+基团的显正电性的C发生亲核进攻,同时把自己身上的―H在逐渐进攻正电性碳的过程中,逐渐形成C—O键的同时,以H+形式释放出来,恢复催化剂的能力。这里另一个乙醇分子羟基上的O进攻正电性的C,对―OH2+基团的离去起到帮助与促进作用,因为O的孤电子对消弱了C的正电性,减弱了对―OH2+基团离去的吸引力,大大帮助了―OH2+基团的离去。可以讲,这个反应的重要一环是另一乙醇分子中的羟基O对正电性C的进攻,实现了反应的结果。当―OH2+基团逐渐带着C—OH键上的电子远离时,醚键(C―O)也同时在逐渐形成,而在醚键逐渐形成的同时,羟基上的―H也逐渐以离子形态进入水中。在离去与进攻的相互作用下,形成H2O的同时,醚分子也就诞生了,H+离子也被恢复。应该讲这个反应的难度,是―OH基团的断开离去的过程,是需要进攻基团的帮助,才能容易实现的;而从另一个乙醇分子的―OH基团上脱离下H+要相对容易。为此,乙醇分子间脱水的温度低一些,就能形成了乙醚分子。
(2)乙烯的形成原因探析
在乙醇分子内进行脱水反时,是从乙醇分子上脱去―OH团时,也是先在乙醇分子的羟基上发生质子化,形成离去―OH2+基团;在该乙醇分子的CH3―基团上脱下一个―H+基团。这个过程是由于温度的升高,造成分子的活动能力增强,使得―OH2+基团的离去能力提高,与其相连的C原子的正电性加大,对C—C间的σ键电子对吸引力加大,造成CH3―基团上的C—H键极性进一步增强,使得H以离子(H+)形式脱下,变得容易。同时由于温度的升高,组成分子的原子活动能力也大大增强,使得C―H键上的电子对活动能力与范围也会加大,再加上正电性C的强力吸引,进一步促进了CH3―基团上C—H键的极性,使H以H+离子的形式离开进入溶液,恢复催化剂的活性与功能。这个反应的难点是从CH3―基团上脱下一个―H+基团的过程。由于升高温度使得组成分子的各个基团活性提高,离去―OH2+基团造成的相连C的正电性提高,使得与其相连C-H键的极性增强,使得CH3―基团上C-H分离变得容易,这才能得到反应产物。
从CH3―基团上脱下一个―H+基团的难度要大于从另一个乙醇分子上的―OH基团提供的―H+基团。
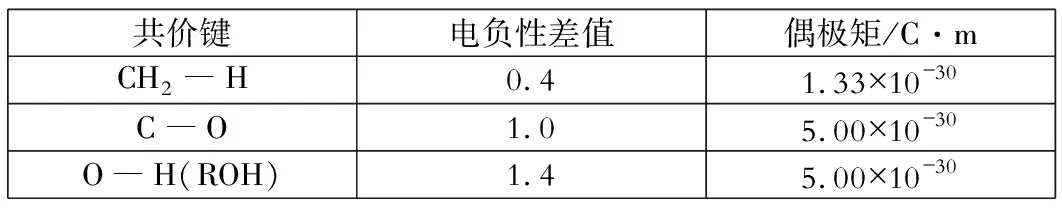
共价键电负性差值偶极矩/C·mCH2―H0.41.33×10-30C―O1.05.00×10-30O―H(ROH)1.45.00×10-30
共价键极性的大小取决于成键原子的电负性。比较成键两原子之间的电负性差值,可以得出它形成共价键极性的大小。C―H或O―H键的共价键极性越大,相对应的以H+形式离去就容易。从上述反应的―H基团离去的形式(H+)看,键的极性(偶极矩)大小起决定性作用。当有使其极性增大的因素存在时,C―H或O―H键,以H+形式离去的机会就大大增加。也就是说,以H+形式离去就容易了。
由于反应温度的提高,造成参加反应的分子活动能力加大,分子间的距离也增大,从而使得另一个乙醇分子的―OH基团的O,向离去―OH2+基团相连的正电性C发生进攻机会增多,但由于其活性增大,结合成C—O键的牢固程度大大降低;且由于温度的提高,使得与正电性C结合的其它基团的活性加剧,而对进攻正电性C的位阻也加大;而且由于反应温度的提高,使得形成―OH2+基团的离去活力提高,造成与其相连的C原子的正电性加大,对C—C间的σ键电子对吸引力加大,造成CH3―基团上的C—H键极性进一步增强,使得―H以离子形式脱下,变得容易。即从CH3―基团上脱下一个―H+基团能力与机会也大大提高;在―OH2+基团渐渐脱离的过程中,使得与其相连的C原子正电性逐渐加强,对其周围原子间的成键电子对的吸引力加大;由于温度的升高,也使得C—H键的电子对运动活性、范围提高,造成正电性C对其的吸引成键成为可能;综上之因,在这些因素的相互竞争较量中,成就了乙烯分子的形成。
催化剂浓硫酸的作用,主要是在乙醇分子的―OH基团上发生质子化,增加―OH基团的离去能力。在―OH基团逐渐离去的过程中,与羟基相连的C正电性对其它基团的电子对吸引会很强烈,在环境温度提高的帮助下,离去基团与进攻基团的竞争,就要根据其自身的能力与其方便的条件(如离得远进)决定了相对稳定的结果——产物分子。同时浓硫酸起到吸收水分的作用,改变反应的平衡,也是脱水剂,对反应正向进行有利。
乙醇在浓硫酸催化下的脱水反应之不同反应机理,即在分子间与分子内的脱水反应,其形成的原因主要是由反应温度的高低而造成。也就是说,形成上述不同产物的主要原因是温度,即由于温度高低的不同控制,决定了产物分子的结果。
四、结束语
综上所述,乙醇分子脱水反应的关键是羟基被质子化后,其离去的能力,决定了乙醇分子的脱水反应是分子内、还是分子间进行脱水。低温下―OH2+基团离去难,在另一羟基O的进攻帮助下,进行分子间脱水,形成乙醚;而高温下―OH2+基团离去容易,使得与其相连的C正电性对与其相连的C原子吸引力加大,使得C―H极性加大,造成H以离子的(H+)形式离去成为现实,成就了乙醇分子内脱水,得到乙烯分子。乙醇分子的脱水反应,发生在分子间还是分子内,在浓硫酸的存在下,完全由温度控制。温度是决定离去基团与进攻基团之间的能力与相互作用的关键因素;从而形成乙醚分子还是形成乙烯分子,不取决于乙醇分子本身。可见化学反应发生之要——是外界条件。虽然乙醇能够发生脱水反应,但如何发生脱水反应并不取决于乙醇本身,而要由外界条件来决定。内因虽是变化的依据,但外因确是发生变化的决定因素。所以,化学反应发生的条件是同学在学习化学反应时必须要记清楚的,也是教师必须讲清楚的重要要点之一。
参考文献:
[1]邓苏鲁.有机化学[M].北京:化学工业出版社,2006.
[2]恽魁宏.有机化学[M].北京:高等教育出版社出版,1990.
