中亚热带山区深层土壤有机碳库对土地利用变化的响应
2014-09-19宋迪思张杨珠
盛 浩,周 萍,李 洁,宋迪思,张杨珠,*
(1. 湖南农业大学资源环境学院, 长沙 410128;2. 中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室, 长沙 410125)
土地利用/覆被变化(LUCC:land-use and land-cover change)是陆地碳损失的主要碳源。据估计,在1959—2010年间,全球因LUCC向大气排放的净碳量高达(1±0.5) Pg/a,主要源自热带毁林和天然林改为人工林、经济林和农业用地[1]。从全球看,热带林地土壤容纳了约30%的土壤碳储量(2 344 Pg),还贮存了约18%的细根(直径≤2 mm)生物量(78.2 Gg),在全球碳平衡中扮演重要的角色[2- 3]。在热带亚热带地区,天然林砍伐转为次生林/人工林地、园地和坡耕地是当地典型的土地利用方式转变,常造成土壤碳储量的大幅降低,以表土层降幅最为明显[4- 5]。以往研究普遍认为,碳含量高、微生物活性强的表层土壤对LUCC的响应非常敏感,而富含惰性有机碳的深层矿质土壤则较少受到LUCC的影响[4- 7]。我国热带亚热带地区土壤蓄积了28.7 Pg的有机碳,且高度风化的土壤土层深厚(如花岗岩红壤),A层以下土层蓄积> 80%的土壤剖面碳储量[8- 9]。了解亚热带地区巨大的深层土壤碳库对LUCC的响应,对于精确预测区域土壤碳库变化具有重要意义。
土地利用显著改变地上植被,影响土壤碳输入的途径和数量。以C3植物为主的天然林砍伐后,适应能力更强的C4植物可能入侵并提高对土壤碳输入的贡献,从而改变土壤碳的来源。植物细根主要集中在表土层,是根系中最具活性的组分,亦是土壤碳输入的主要来源之一和立地生产力的重要指标。细根动态对土地利用变化可能极为敏感。有研究报道,亚热带天然林改为人工林地、园地后细根生物量和周转均大幅降低[10- 11],但经过短期的人工林生长或次生演替,细根生物量即可能恢复到原有水平[12- 13]。不过也有研究报道,天然林改为人工林地后,乔木细根生物量经过33a的人工林生长仅恢复到天然林的33%—70%[14]。因此,了解土地利用变化后土壤碳库来源和细根的变化对于评价土壤生产力和碳吸存能力具有重要意义。
“空间换时间”是研究土壤性质对土地利用变化响应的有效手段之一。此前,有关亚热带山区土地利用变化对表层土壤有机碳储量和质量、土壤呼吸和CO2排放的影响已有过一些研究报道[5,11,15]。本文选择中亚热带丘陵山区(湖南省浏阳市)本底条件基本一致、土地利用史清晰的天然常绿阔叶林、杉木人工林、板栗园和坡耕地的典型土地利用序列,以“空间换时间”的方法研究不同土地利用方式对深层土壤碳储量、土壤δ13C值和细根生物量的影响,目的在于(1)了解深层(40—100 cm)矿质土壤碳库对土地利用变化的响应;(2)明确土地利用变化后土壤有机碳来源组成的变化;(3)了解植物细根生物量及其垂直分布对土地利用变化的响应。
1 研究区概况与方法
1.1 研究区概况
本研究的试验地设在湖南省浏阳市大围山国家森林保护区(28°21′—26′N, 114 °02′—12′E)附近,地处湘江支流浏阳河流域,东北接幕阜山脉,西南临雪峰山脉,典型低丘地貌,海拔150—165 m。区域气候为典型中亚热带季风湿润气候,年均温17.7 ℃,年均相对湿度83%,年降雨量1 800—2 000 mm,年均蒸散量1 445.1 mm[16]。地带性植被为亚热带常绿阔叶林,但原生植被破坏怠尽,多转变为次生林、人工林、经济林和果园(图1)。土壤为古老的中元古代(8亿年前)雪峰晚期中粒堇青石二云母花岗闪长岩高度风化后发育的花岗岩红壤[17],土层深厚,剖面发育良好,土体构型为典型的A-B-BC-C型,良好植被的矿质土壤上还覆盖2—3 cm厚的枯枝落叶层(O)。

图1 试验地周边土地利用方式现状(2009年)
天然林人为干扰少,自然演替时间>300 a,优势种为樟树(Cinnamomumcamphora(L.) J. Presl),林下灌木层明显,地面草本稀少。毗邻的杉木(Cunninghamialanceolata(Lamb.) Hook)人工林、板栗(CastaneamollissimaBlume)园和坡耕地皆由次生杂木林经砍伐、炼山后转变而来,各土地利用方式相距不超过1 km。2003年开始营造杉木人工林,其林下灌木和草本覆盖度低,水土流失严重;土地平整后,基于坡改梯技术营建果园和坡耕地,果树品种为板栗,果园定期施用化肥、除草和杀虫;坡耕地为菜地,夏季种辣椒,下半年种一季红薯。季节性干旱时,定期人工浇灌。所有样地分布在浏阳河支流大溪河流域南侧。样地和表层土壤基本理化性质参见表1。

表1 不同利用方式样地基本特性和表层土壤(0—20 cm)基本性状
1.2 研究方法
1.2.1 土壤和细根样品采集
2012年12月,在每种土地利用方式内随机设置3块25 m×25 m样地,采用自制钢制土钻(内径2.8 cm)在每块样地随机内钻取深度1 m的土芯8—10根,分层采集0—20、20—40、40—60、60—80和80—100 cm土样,按土层混合成1个样品。同时在每块样地采用自制钢制根钻(内径6.8 cm)随机钻取深度60 cm的土芯6—8根,按0—20、20—40、40—60 cm分割土芯。采集的混合土样和土芯编号后用保鲜袋封好,带回实验室供分析用。在坡耕地样地单独设置3个1 m × 1 m的样方,作物收获时分别收集0—20 cm和20—40 cm土层内所有细根,带回实验室。挖掘土壤剖面,采用钢制环刀采集原状土,用于测定各土层容重。鲜土样品在室内拣去可见石砾、植物根系和碎屑后,自然风干,过0.149 mm 孔径尼龙筛。
1.2.2 样品分析与测定
土壤有机碳含量:采用重铬酸钾外加热法测定[18]。
土壤δ13C值:土样在石英管内干烧获取CO2,经酒精液氮法纯化处理后,采用稳定性同位素质谱仪(Thermo Scientific MAT 253,Finnigan公司,德国)测定CO2气体的δ13C值,采用PDB标准,测量精度≤0.01‰。用酪氨酸(Tyrosine)校正仪器,其碳含量59.6%,氮含量7.9%,δ13C值-23.25‰。
细根生物量:带回室内土芯和细根样品,经自来水浸泡,漂洗并过0.25 mm孔径钢筛,采用放大镜、剪刀、镊子等工具手工拣出>2 mm的根,仅保留≤2 mm的细根。先用油标卡尺准确计量直径为2 mm的细根制成径级标准样,再根据标准样进行目视分出≤2 mm的细根。细根样品在80℃烘箱中烘干至恒重,称重。
1.2.3 数据计算方法
土壤有机碳储量基于各土层有机碳含量、土壤容重计算得到,公式如下:
(1)
式中,Corg为剖面土壤有机碳储量 (t/hm2);SOCi为i层土壤有机碳含量(g/kg);ρi为i层土壤容重 (g/cm3);hi为i层土层厚度 (cm)。
细根生物量(包括乔木层细根和林下植被细根)的计算公式如下:
B=W÷(π ×r2)× 10-2
(2)
式中,B为细根生物量(t/hm2);W为根钻内土芯细根重量(g);r为根钻内径(cm),本文为3.4 cm。
1.2.4 数据统计与分析
所有的数据统计和分析均在Excel 2003和SPSS 13.0软件平台下实现。采用单因素方差分析方法比较不同土地利用类型和不同土层的差异(P<0.05),多重比较采用Turkey HSD检验。
2 结果与分析
2.1 土壤剖面有机碳储量的分布
土地利用变化强烈影响土壤有机碳储量及其剖面分布,改变土壤质量状况和碳吸存能力。所选天然林1 m深土壤有机碳储量为112.03 t/hm2,转变为杉木人工林后,土壤有机碳储量降至82.40 t/hm2,降幅为26.4%,转变为板栗园后有机碳储量为78.83 t/hm2,降幅为29.6%,而转为坡耕地土壤有机碳储量仅为72.29 t/hm2,降幅高达35.5%(图1)。
4种土地利用方式土壤有机碳储量均随土层加深显著降低,两者呈显著负指数函数关系(R2介于0.70—0.91)。土地利用变化后,不仅表层土壤(0—40 cm)有机碳储量明显降低,降幅为27%—34%,深层土壤(40 cm 以下土层)碳库储量亦大幅降低,降幅达到19%—45%(图1)。天然林改为人工林和板栗园后,随土层加深有机碳储量降幅减小,但改为坡耕地后,降幅扩大。
2.2 土壤δ13C值
土地利用变化改变植被组成和土壤有机碳的来源,土壤δ13C值能反映植被的变化。不同土地利用方式土壤δ13C值以表层土壤相对最低,随土层加深到40—60 cm,δ13C值有约1‰—4‰的快速升幅,土层加深到100 cm,δ13C值呈降低趋势。就整个剖面而言,天然林改为杉木人工林后,土壤剖面δ13C值无明显变化,但改为板栗园和坡耕地,剖面δ13C平均值明显升高(表2),反映出地表植被光合类型的转变。
2.3 细根生物量
土地利用变化强烈影响植被生物量和分布,长远上影响土壤碳储量和立地生产力。天然林0—60 cm深细根生物量为8.78 t/hm2,改为杉木人工林后,细根生物量锐减到3.23 t/hm2,降幅高达63.2%,改为板栗园后降低49.9%,而改为坡耕地后细根生物量降到不足天然林的2%(图3)。土地利用变化后,细根生物量的降低主要集中在0—40 cm土层,而40 cm以下土层细根生物量已较为接近(坡耕地除外)。并且,土地利用变化后,细根生物量趋于向表土层集中,林地和果园0—40 cm土层集中了87.0%—89.7%的细根生物量,而坡耕地95.3%的细根生物量分布在0—20 cm土层。

图2 不同利用方式土壤有机碳储量的剖面分布

表2 不同土地利用方式土壤δ13C值的剖面分布/‰
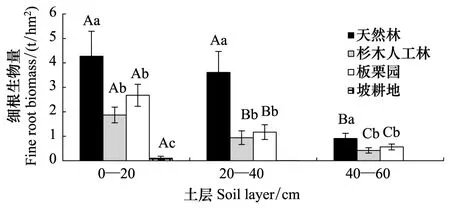
图3 不同利用方式土壤细根生物量的剖面分布
3 讨论
土壤有机质和细根是地下碳储量的主要分室,亦是土地生产力和环境健康的重要指标。亚热带天然常绿阔叶林经砍伐、炼山后,改为人工林、果园和坡耕地,常造成植物碳输入大量减少,地表枯枝落叶和表土有机质的大量烧失,地表水土肥严重流失,表土有机碳加速分解,再叠加上当地脆弱的自然环境(暴雨和陡坡),极易导致土壤碳储量和质量大幅下降[5,11]。本研究中,天然林改为人工林后,土壤碳储量降低26%,远高出全球平均水平(13%);然而,天然林改为果园、坡耕地后,土壤碳储量降低30%—36%,落入全球平均范围(20%—42%)[4],但略低于邻近的天然林改为农用地19 a后土壤碳储量的降幅(32%—51%)[5]。这可能和本文中坡耕地利用时间较短(仅7 a)和采用等高梯作一定程度削减水土流失有关。据模型模拟,温带天然林改农用地后,随着土地利用时间延长,土壤碳储量呈指数式下降,直到23 a后才达到稳定[19]。另据浙江低丘第四纪红色粘土红壤的野外观测,等高农作能削减88%的泥沙流失量[20]。
通常,土地利用活动集中在表土层,很少显著影响到40 cm以下的深层矿质土壤[19, 21]。但是,本文中天然林改为其它土地利用方式后,深层土壤碳库也出现不同程度的降低,尤以坡耕地降幅最为明显(图2)。天然林转变后,40 cm以下深层土壤碳储量降低了19%—45%。这反映出本区天然林改为人工林、果园和坡耕地7 a内,活化了很大一部分的深层土壤碳库,并导致其大量损失。据报道,热带森林改为草地后,亦能活化约20%的深层土壤碳储量[22]。本区土地利用变化后,深层土壤碳库大量损失的原因有三:首先,天然林改为人工林、板栗园和坡耕地后,地上枯枝落叶和表土层的有机碳数量锐减(表1),可能减少了从枯枝落叶层、表土层至深层土壤的可溶性有机碳的迁移量;加上天然林转变后,林分密度降低(表1),深根性的乔木数量减少,浅根性的灌木、草本和作物增加,地下深根系数量明显减少(图3),也可能减少了深层土壤中源自根系周转、分泌物和脱落物的有机碳输入量[10,23];其二,土地利用变化后,开垦、耕作输入的新鲜、易分解的活性碳对深层土壤中埋藏的老的、难分解的惰性碳可能产生激发效应[24],加速深层土壤中有机碳的矿化损失。最后,本区丘多坡陡,暴雨集中在3—6月份,当地天然林经砍伐,传统的清理采伐剩余物、火烧炼山、造林整地、灌溉除草和耕种一系列经营管理措施,强烈扰动了表土层,极易造成表土严重的水土流失和碳损失。加上花岗岩发育的红壤砂性重、松散易碎、抗蚀性差,在天然林改为人工林、果园的前几年里,地面幼树覆盖度低,强烈的地表水土流失能持续数年之久。特别是干扰强烈的坡耕地,持续强烈的土壤侵蚀能将表土和密度较轻的有机物冲刷怠尽,深层心土出露,随后的翻耕易破坏土壤团聚体,加速团聚体物理保护碳的快速分解和矿化损失[9]。据报道,本区林地经皆伐炼山后6 a内,水蚀引起的土壤流失量高达38 t/hm2[25],由此看来,在地形复杂的中亚热带山区,土地利用变化后,减少了深层土壤碳输入和增加碳流失、矿化,导致深层土壤碳大量损失。
土地利用改变地上植物组成,从而可能改变其光合类型并影响土壤δ13C值。土壤δ13C值主要与输入土壤中有机物的来源植物类型(C3、C4)有关,C3和C4光合途径植物的δ13C值范围分别介于-23‰—-33‰和-9‰—-16‰[26]。天然林改为杉木林后,土壤剖面δ13C平均值无明显变化,反映出植物群落主要以光合效率较低的C3植物为主。但天然林改为板栗园、坡耕地后,土壤δ13C平均值明显升高,很可能与C4草本入侵有关。部分C4草本的入侵引起输入土壤中的有机物成为C3和C4植物残体的混合物。尤其是板栗园,C4草本可能增加了对土壤有机碳的贡献。据报道,巴西热带雨林砍伐后引入C4牧草,表层土壤的δ13C值在10 a中升高到-9.4‰[27]。
细根约占30%的地下生物量和40%—85%的净初级生产力,它是地下碳输入的主要途径[2]。天然林改为杉木人工林后,0—60 cm细根生物量大幅降低50%,改为板栗园后降低63%,而改为坡耕地后,细根生物量已不足天然林的2%。本文中土地利用变化后,细根生物量降幅高出土壤碳储量降幅(26%—36%),反映出细根生物量对土地利用变化的响应比土壤碳储量更为敏感。综合热带亚热带研究表明,天然林改为人工林后细根生物量降幅(39±19)%低于天然林改园地、坡耕地的细根生物量的降幅(71±19)%(表3)。这很可能与干扰强度有关。据报道,尼泊尔热带森林经人工择伐后,细根生物量减少约52%,而印度热带森林在中等和强烈人为干扰下,细根生物量锐减36%—72%[28- 29]。天然林转变后,细根生物量明显向0—40 cm表土层聚集。热带森林强烈干扰后改为农用地,亦有细根向表土层明显汇聚的现象[29- 30]。
土地利用变化后,细根生物量锐减并向表土层集中的现象,主要与强烈的人为干扰导致土壤生产力退化和植物状况转变有关。一方面,土地利用变化后,土壤理化性状劣化,土壤资源有效性大幅降低,致使细根生物量锐减。天然林转变后,表土层容重增加7%—26%(表1),减少了土壤孔隙度和通气孔隙数量和比例,而土壤通气状况、土壤呼吸和根系活性随之降低[11]。加上土壤交换性酸量呈升高趋势(表1),铝毒害可能增加,进而抑制植物细根生长。此外,土地利用变化后,土壤剖面碳储量降低26%—36%,表土层养分指标全氮含量降低4%—27%(表1)。更有研究表明,本区天然林转换后,表土层水分显著减少[11]。细根生物量与氮含量、水分密切相关,而养分、水分资源有效性的降低,是导致土地利用变化后细根生物量减少的重要原因之一。另一方面,天然林经皆伐、炼山后,改成人工纯林、板栗园和坡耕菜地后,在1 a内前茬残留细根的分解损失量可高达68%—80%,数年即可分解怠尽[14]。较之天然林,人工纯林、板栗园栽植、生长时间短(仅7 a),林木幼小,根系尚未完全成熟,加上林分密度较低(表1),林下灌木稀少,导致细根生物量锐减。杉木人工林、板栗园地面草本密度较高,坡耕地则以一年生作物为主,细根生物量集中在表土层。随着乔木的成熟,细根生物量将逐渐增加,土层分布也将逐渐加深[34]。树种也可能有显著影响。印度热带天然林改为柚木人工林后,细根生物量无明显变化,但改为橡胶、马占相思和合欢人工林后,细根生物量降低32%—56%。由此看来,土壤资源有效性降低和植物生长状况变差直接导致细根生物量减少,反映出土地利用变化后立地生产力的降低。

表3 热带亚热带天然林改为人工林地、园地和耕地对细根生物量的影响/%
土地利用变化后,伴随着人工林、果树林下植被的生长和林龄的增加,细根生物量将逐渐恢复并达到新的平衡。细根生物量恢复到天然林水平更有赖于植物多样性和土壤资源有效性的恢复,但这是长期的过程。随着植物碳输入的增加和水土流失的减缓或控制,土壤碳储量也可能缓慢的恢复。据报道,人工林生长5 a后,0—10 cm表土层有机碳仅恢复到初始水平的85%[35]。天然林改为坡耕旱地后,更为强烈的干扰(频繁翻耕、浇溉)将使土壤有机碳降到更低的水平并达到新平衡,而维持坡耕地的生产力唯有施用大量外源有机肥和化肥,以补充损失的有机质和养分。
4 结论
综上所述,本区土地利用变化后严重的水土流失、人为扰动和植物种组成的变化,引起深层土壤植物碳输入减少和碳流失、矿化损失增加,是导致深层土壤碳储量大幅下降的主因。土地利用变化后,土壤理化性状劣化,土壤资源有效性大幅降低,加上天然林转变后植被幼龄化,导致细根生物量锐减并向表土层集中的现象。中亚热带丘陵山区自然脆弱性高,应加强天然林的保育和退化坡地的生态恢复。在山地开发、利用和土地性质/用途转变过程中,应创新减轻坡土扰动的农艺措施,严控水土流失,加强中幼林抚育和陡坡耕地退耕力度,科学施用有机肥、化肥和绿肥上山以补充损失的有机质和养分。这对于维系山地土地生产力和促进山区可持续经营具有长远意义。
:
[1] Le Quéré C, Andres R J, Boden T, Conway T, Houghton R A, House J I, Marland G, Peters G P, van der Werf G R, Ahlström A, Andrew R M, Bopp L, Canadell J G, Ciais P, Doney S C, Enright C, Friedlingstein P, Huntingford C, Jain A K, Jourdain C, Kato E, Keeling R F, Klein Goldewijik K, Levis S, Levy P, Lomas M, Poulter B, Raupach M R, Schwinger J, Sitch S, Stocker B D, Viovy N, Zaehle S, Zeng N. The global carbon budget 1959—2011. Earth System Science Data, 2013, 5(1): 165- 185.
[2] Jackson R B, Mooney H A, Schulze E D. A global budget for fine root biomass, surface area, and nutrient contents. Proceedings of the National Academy of Sciences of the United Stated of America, 1997, 94(14): 7362- 7366.
[3] Jobbágy E G, Jackson R B. The vertical distribution of soil organic carbon and its relation to climate and vegetation. Ecological Applications, 2000, 10(2): 423- 436.
[4] Guo L B, Gifford R M. Soil carbon stocks and land use change: a meta analysis. Global Change Biology, 2002, 8(4): 345- 360.
[5] Yang Y S, Xie J S, Sheng H, Cheng G S, Li X, Yang Z J. The impact of land use/cover change on storage and quality of soil organic carbon in midsubtropical mountainous area of southern China. Journal of Geographical Sciences, 2009, 19(1): 49- 57.
[6] Rumpel C, Kögel-Knabner I. Deep soil organic matter—a key but poorly understood component of terrestrial C cycle. Plant and Soil, 2011, 338(1/2): 143- 158.
[7] Harper R J, Tibbett M. The hidden organic carbon in deep mineral soils. Plant and Soil, 2013, 368(1/2): 641- 648.
[8] Li Z, Zhao Q G. Organic carbon content and distribution in soils under different land uses in tropical and subtropical China. Plant and Soil, 2001, 231(2): 175- 185.
[9] Li J, Sheng H, Zhou P, Yuan H, Liao C L, Huang Y X, Zhang Y Z. The profile of organic carbon and light fraction organic carbon in several types of subtropical hilly woodland soils. Chinese Journal of Soil Science, 2013, 44(4): 851- 857.
[10] Hertel D, Harteveld M A, Leuschner C. Conversion of a tropical forest into agroforest alters the fine root-related carbon flux to the soil. Soil Biology and Biochemistry, 2009, 41(3): 481- 490.
[11] Sheng H, Yang Y S, Yang Z J, Chen G S, Xie J S, Guo J F, Zou S Q. The dynamic response of soil respiration to land-use changes in subtropical China. Global Change Biology, 2010, 16(3): 1107- 1121.
[12] Raich J W. Fine roots regrow rapidly after forest felling. Biotropica, 1980, 12(3): 231- 232.
[13] Olesinski J, Lavigne M B, Kershaw J A Jr, Krasowski M J. Fine-root dynamics change during stand development and in response to thinning in balsam fir (AbiesbalsameaL. Mill.) forests. Forest Ecology and Management, 2012, 286: 48- 58.
[14] Yang Y S, Chen G S, Lin P, Huang R Z, Chen Y X, He Z M. Fine root distribution, seasonal pattern and production in a native forest and monoculture plantations in subtropical China. Acta Ecologica Sinica, 2003, 23(9): 1719- 1730.
[15] Sheng H, Li X, Yang Z J, Xie J S, Chen G S, Yang Y S. Impact of land use/cover change on soil CO2efflux in mid-subtropical mountainous area of southern China. Scientia Geographica Sinica, 2010, 30(3): 446- 451.
[16] Xu H C, Lu A G. The Annals of Daweishan Town of Liuyang City, Hunan Province: 1922—2002. Liuyang: Local Chronicles Compilation Committee of Liuyang City, 2002: 34- 35.
[17] The People′s Government of Liuyang City. Application Book of Daweishan National Geopark in Liuyang City of Hunan Province. Liuyang: Provincial Geopark of Mount Daweishan, 2012: 1- 15.
[18] Lu R K. Analytical Methods of Soil and Agricultural Chemistry. Beijing: China Agricultural Science and Technology Press, 2000: 106- 109.
[19] Poeplau C, Don A, Vesterdal L, Leifeld J, van Wesemael B, Schumacher J, Gensior A. Temporal dynamics of soil organic carbon after land-use change in the temperate zone - carbon response functions as a model approach. Global Change Biology, 2011, 17(7): 2415- 2427.
[20] Yuan D H, Wang Z Q, Chen X, Guo X B, Zhang R L. Properties of soil and water loss from slope field in red soil in different farming systems. Journal of Soil and Water Conservation, 2001, 15(4): 66- 69.
[21] Murty D, Kirschbaum M U F, Mcmurtrie R E, Mcgilvray H. Does conversion of forest to agricultural land change soil carbon and nitrogen? A review of the literature. Global Change Biology, 2002, 8(2): 105- 123.
[22] Veldkamp E, Becker A, Schwendenmann L, Clark D A, Schulte-Bisping H. Substantial labile carbon stocks and microbial activity in deeply weathered soils below a tropical wet forest. Global Change Biology, 2003, 9(8): 1171- 1184.
[23] O′Brien S L, Iversen C M. Missing links in the root-soil organic matter continuum. New Phytologist, 2009, 184(3): 513- 516.
[24] Fontaine S, Barot S, Barré P, Bdioui N, Mary B, Rumpel C. Stability of organic carbon in deep soil layers controlled by fresh carbon supply. Nature, 2007, 450(7167): 277- 280.
[25] He Z Y. Influences of silvicultural measures on soil and water loss in young Chinese fir plantation. Journal of Soil and Water Conservation, 1995, 9(2): 64- 69.
[26] Zhu S F, Liu C Q, Tao F X. Use ofδ13C method in studying soil organic matter. Acta Pedologica Sinica, 2005, 42(3): 495- 503.
[27] Desjardins T, Andreux F, Volkoff B, Cerri C C. Organic carbon and13C contents in soils and soil size-fractions, and their changes due to deforestation and pasture installation in eastern Amazonia. Geoderma, 1994, 61(1/2): 103- 118.
[28] Gautam T P, Mandal T N. Effect of disturbance on fine root biomass in the tropical moist forest of eastern Nepal. Nepalese Journal of Biosciences, 2012, 2: 10- 16.
[29] Barbhuiya A R, Arunachalam A, Pandey H N, Khan M L, Arunachalam K. Fine root dynamics in undisturbed and disturbed stands of a tropical wet evergreen forest in northeast India. Tropical Ecology, 2012, 53(1): 69- 79.
[30] Pibumrung P, Gajaseni N, Popan A. Profiles of carbon stocks in forest, reforestation and agricultural land, Northern Thailand. Journal of Forestry Research, 2008, 19(1): 11- 18.
[31] Sundarapandian S M, Chandrasekaran S, Swamy P S. Variations in fine root biomass and net primary productivity due to conversion of tropical forests into forest plantations. Tropical Ecology, 1999, 40(2): 305- 312.
[32] Mendoza-Vega J, Karltun E, Olsson M. Estimations of amounts of soil organic carbon and fine root carbon in land use and land cover classes, and soil types of Chiapas highlands, Mexico. Forest Ecology and Management, 2003, 177(1/3): 191- 206.
[33] Leuschner C, Wiens M, Harteveld M, Hertel D, Tjitrosemito S. Patterns of fine root mass and distribution along a disturbance gradient in a tropical montane forest, Central Sulawesi (Indonesia). Plant and Soil, 2006, 283(1/2): 163- 174.
[34] Yang L Y, Luo T X, Wu S T. Fine root biomass and its depth distribution across the primitive Korean pine and broad-leaved forest and its secondary forests in Changbai Mountain, northeast China. Acta Ecologica Sinica, 2007, 27(9): 3609- 3617.
[35] Guo J F, Yang Y S, Chen G S, Xie J S, Lin P. Soil C and N pools in Chinese fir and evergreen broadleaf forests and their changes with slash burning in mid-subtropical China. Pedosphere, 2006, 16(1): 56- 63.
参考文献:
[9] 李洁, 盛浩, 周萍, 袁红, 廖超林, 黄运湘, 张杨珠. 亚热带丘陵几种林地土壤剖面有机碳和轻组有机碳的分布. 土壤通报, 2013, 44(4): 851- 857.
[14] 杨玉盛, 陈光水, 林鹏, 黄荣珍, 陈银秀, 何宗明. 格氏栲天然林与人工林细根生物量、季节动态及净生产力. 生态学报, 2003, 23(9): 1719- 1730.
[15] 盛浩, 李旭, 杨智杰, 谢锦升, 陈光水, 杨玉盛. 中亚热带山区土地利用变化对土壤CO2排放的影响. 地理科学, 2010, 30(3): 446- 451.
[16] 徐和初, 卢安国. 湖南省浏阳市大围山镇志(1922- 2002年). 浏阳: 浏阳市地方志编纂委员会, 2002: 34- 35.
[17] 浏阳市人民政府. 湖南浏阳大围山国家地质公园申报书. 浏阳: 大围山省级地质公园, 2012: 1- 15.
[18] 鲁如坤. 土壤农业化学分析方法. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000: 106- 109.
[20] 袁东海, 王兆骞, 陈欣, 郭新波, 张如良. 不同农作措施红壤坡耕地水土流失特征的研究. 水土保持学报, 2001, 15(4): 66- 69.
[25] 何智英. 杉木幼林地水土流失及其防治的研究I. 营林措施对杉木幼林地水土流失的影响. 水土保持学报, 1995, 9(2): 64- 69.
[26] 朱书法, 刘丛强, 陶发祥.δ13C方法在土壤有机质研究中的应用. 土壤学报, 2005, 42(3): 495- 503.
[34] 杨丽韫, 罗天祥, 吴松涛. 长白山原始阔叶红松(Pinuskoraiensis)林及其次生林细根生物量与垂直分布特征. 生态学报, 2007, 27(9): 3609- 3617.
