斯钙素蛋白-1和缺氧诱导因子-1α的相互作用对肾癌细胞线粒体膜电势稳定的影响
2014-09-19杨清滔张永春朱致晖杨永安祝庆亮
杨清滔,谷 江,张永春,朱致晖,杨永安,王 楠,祝庆亮
1贵阳医学院附属医院泌尿外科,贵阳 550004
2江都人民医院泌尿外科,江苏扬州 225200
·论 著·
斯钙素蛋白-1和缺氧诱导因子-1α的相互作用对肾癌细胞线粒体膜电势稳定的影响
杨清滔1,谷 江1,张永春1,朱致晖1,杨永安1,王 楠1,祝庆亮2
1贵阳医学院附属医院泌尿外科,贵阳 550004
2江都人民医院泌尿外科,江苏扬州 225200
目的研究斯钙素蛋白-1(STC-1)和缺氧诱导因子-1α(HIF-1α)相互作用后的调钙功能对肾癌细胞线粒体膜电势稳定的影响。方法构建高表达HIF-1α的肾癌细胞模型,采用不同浓度STC-1蛋白分别干预荷基因肾癌细胞和单纯肾癌细胞,MTT法检测细胞增殖,RT-PCR和ELISA法检测细胞内HIF-1α和STC-1的基因及蛋白表达情况,荧光探针检测细胞内Ca2+变化,荧光分光光度计检测线粒体膜电位 (Δψm),紫外分光光度计检测线粒体通透性转换孔(mPTP)。结果HIF-1α基因转染、STC-1干预及基因转染后再STC-1干预3种方式均可提高Δψm,降低细胞内Ca2+和mPTP水平,促进细胞增殖 (P均<0.05),以上结果可随着STC-1浓度的增加而逐渐增强,但细胞增殖率的升高趋势却逐渐减缓。结论HIF-1α可能通过促进STC-1表达,下调Ca2+水平,从而稳定线粒体膜电势来参与肾癌细胞的恶性增殖,但此作用亦因外源性STC-1对HIF-1α的抑制而逐渐减弱。
肾癌细胞;斯钙素蛋白-1;缺氧诱导因子-1α;线粒体
Acta Acad Med Sin,2014,36(1):12-19
肿瘤细胞侵袭性、异型性的生理特性可导致细胞内相对乏氧环境产生,同时,乏氧亦能下调呼吸链电子传递速度,促氧化磷酸化解偶联,最终影响线粒体供能[1]。线粒体膜电位 (mitochondrion membrane potential,Δψm)与线粒体通透性转换孔 (mitochondrion permeability transition pore,mPTP)不仅可衡量线粒体结构和功能的正常与否,亦与肿瘤发生发展相关[2]。研究显示,肿瘤细胞在乏氧刺激下可反应性促进缺氧诱导因子-1α (hypoxia-inducible factor 1α,HIF-1α)的表达[3],使其适应乏氧环境,而HIF-lα又是低氧诱导斯钙素蛋白-1(stanniocalcin1,STC-1)表达的关键调节因子[4]。STC-1是一种高表达于肾小管上皮细胞,作用于细胞线粒体,调节细胞内Ca2+平衡的糖蛋白,在多种实体瘤组织内高表达[5]。Ca2+作为重要的第二信使,与线粒体离子平衡、阴离子蛋白交换、电荷转移等密切相关并影响mPTP,调控Δψm[6]。本研究采用外源性STC-1干预高表达HIF-1α的肾癌细胞模型,研究了STC-1与HIF-1α的相互作用,探讨了两者的调钙功能对线粒体膜电势稳定性的影响。
材料和方法
质粒、细胞和菌株pcDNA3.0-HIF-1α质粒由本实验室构建,大肠杆菌DH5α菌种为贵阳医学院干细胞实验室保存,人肾癌GRC-1细胞株由上海弗雷堡生物公司提供。
主要试剂MTT(美国Sigma公司),RPMI1640(美国Hyclone公司),胎牛血清 (杭州四季青公司),STC-1(以色列 Prospec公司),G418(北京 Solarbio公司),总RNA提取试剂盒、逆转录试剂盒、PCR MasterMix(加拿大 Fermentas公司),ELISA试剂盒(美国R&D公司),Fura-2/AM钙离子探针 (碧云天生物技术研究所),脂质体LipofectamineTM2000转染试剂 (美国Invitrogen公司)。
细胞培养GRC-1细胞置于25 cm2培养瓶中,用含10%胎牛血清及1%青霉素、链霉素的RPMI1640培养液于5%CO2、37℃下培养。
HIF-1α重组质粒的鉴定由本实验室构建重组质粒后,取pcDNA3.0-HIF-1α阳性克隆经BamHⅠ和XbarⅠ酶切后,琼脂糖凝胶电泳回收扩增片段,并由大连宝生物公司经3730XL型DNA自动测序仪检测基因序列。
HIF-1α克隆细胞的筛选质粒序列鉴定吻合后,采用脂质体LipofectamineTM2000转染试剂,按照说明书将pcDNA3.0-HIF-1α、空载体分别转染GRC-1细胞株,37℃培养48 h,待细胞汇合度约80% ~90%时弃培养基,加800 μg/ml G418筛选培养基,每4 d更换1次筛选培养基,待单克隆细胞团形成后传代培养,分别命名为转染组 (pcDNA3.0-HIF-1α-GRC-1)、空载体组 (pcDNA3.0-GRC-1),未转染细胞命名为正常组(GRC-1)。
细胞干预及分组 正常组与转染组细胞分别使用0、0.1、0.5、1.0 nmol/L的 STC-1浸染细胞培养基对细胞进行干预,分别命名为相应的对照组、低剂量组、中剂量组、高剂量组。
RT-PCR检测HIF-1α、STC-1基因表达提取各组细胞总RNA,取1 μg RNA进行逆转录并合成cDNA。引物序列:(1) β-actin:正向:5’-CCCTGGACTTCGAGCAAGAGAT-3’,反向:5’-GTTTTCTGCGCAAGTTAGG-3’,片段长度531 bp;(2)HIF-1α:正向:5’-TCCAGCAGACTCAAATACAAGAAC-3’,反向:5’-GTATGTGGGTAGGAGATGGAGATG-3’,片段长度130 bp;(3)STC-1:正向:5’-TGAGGTCGTCCAGCTCCCAATC-3’,反向:5’-GGCACAGTGGTCTGTCTGCAGGATG-3’,片段长度142 bp。反应条件:预变性94℃ 3 min;变性94℃ 30 s,退火30 s,退火温度均为53℃,延伸72℃ 1 min,35个循环;终止反应72℃ 5 min。以 β-actin作为内参照,PCR产物于2%琼脂糖凝胶进行电泳。所得条带经Im-ageJ软件进行灰度分析,以目的基因与β-actin光密度比值代表目的基因的相对表达量。
ELISA检测HIF-1α、STC-1蛋白表达采用苯甲基磺酰氟 (phenylmethanesulfonyl fluoride,PMSF)与细胞裂解液裂解各组细胞,12 000 r/min(r=8.5 cm)离心5 min,取上清滴加于酶标包被板中,50 μl/孔,分别设空白孔、标准孔、待测样品孔。按照试剂盒说明书操作。
MTT检测细胞的增殖活性细胞接种于96孔板中,每组设6个复孔,培养24 h后每孔加入80 μl无血清培养基和20 μl MTT溶液,37℃孵育4 h后弃去孔内液体,加入150 μl二甲亚砜,低速震荡10 min后,用酶标仪检测490 nm处的OD值。
荧光探针检测细胞内Ca含量2+取生长良好的细胞接种于6孔板中,待细胞汇合度约80%,分组处理并消化成细胞悬液,1000 r/min(r=10.4 cm)离心5 min弃上清,用D-Hanks液重悬细胞,再加入Fura-2/AM,37℃避光孵育45 min,再用D-Hanks液洗涤细胞2次,3 ml D-Hanks液重悬细胞。荧光分光光度计激发波长分别为340、380 nm,发射波长510 nm双波长测定负载探针细胞的荧光强度。
线粒体的提取及形态学鉴定依据Sailaja等[7]的方法稍加改进,具体为:细胞接种于25 cm2细胞培养瓶中,培养至细胞汇合度约80%,分组处理后,消化离心收集细胞,使用细胞裂解液裂解细胞,4000 r/min(r=9.3 cm)离心10 min取上清,10 000 r/min(r=8.9 cm)离心15 min弃上清,收集沉淀为线粒体。将刚提取的线粒体均匀涂于载玻片上,加0.02%詹纳斯绿B染液,覆盖玻片浸染10 min,用高倍镜 (10×40)观察线粒体形态。实验全程均于冰面进行,重复3次。
紫外分光光度计检测mPTP同样方法备线粒体悬液。各组线粒体悬液各加3 ml测定介质P摇匀,对照组为4 ml测定介质P,各组于540 nm 752N型紫外分光光度计测定其吸光度值,mPTP开放程度与吸光度值呈负相关。
荧光分光光度计检测Δψm同样方法备线粒体悬液。各组线粒体悬液各加6.6 μl Rh123,37℃水浴箱中避光孵育30 min,于荧光分光光度计下测激发光为480 nm,发射光为525 nm的荧光强度,Δψm与荧光强度呈负相关。
统计学处理采用SPSS 19.0统计软件,计量资料以均数±标准差表示,不同处理因素对GRC-1细胞内Ca2+、Δψm、mPTP等的影响均采用单因素方差分析,P<0.05为差异有统计学意义。
结 果
HIF-1α重组质粒的测序DNA测序结果显示,HIF-1α重组质粒的基因序列符合Genebank上的序列(图1)。
质粒转染GRC-1效率评价质粒转染GRC-1细胞48 h后,RT-PCR检测结果显示,转染组HIF-1α的相对表达量为 0.702±0.090,明显高于正常组的0.414±0.080 和空载体组的 0.442 ± 0.050(P 均 <0.05),且转染组约为正常组的1.7倍;空载体组与正常组相比,差异无统计学意义 (P>0.05)(图2)。
转染HIF-1α的GRC-1细胞中HIF-1α和STC-1的基因及蛋白表达情况转染组细胞的HIF-1α和STC-1基因及蛋白表达水平明显高于正常组 (P均<0.05)(图3、4)。
图1 pcDNA3.0-HIF-1α质粒部分测序图Fig 1 Part of the sequencing map of pcDNA3.0-HIF-1α plasmid
STC-1干预转染组和正常组细胞后HIF-1α和STC-1的基因及蛋白表达情况 与对照组相比,HIF-1α和STC-1基因表达在转染组与正常组分别随STC-1蛋白给药浓度的增加而逐渐降低 (P均<0.05);各转染组均显著高于相同剂量正常组 (P均<0.05) (图5、6)。HIF-1α和STC-1蛋白表达在转染组与正常组分别随STC-1蛋白给药浓度的增加而逐渐降低,在中、高剂量组出现显著降低 (P均<0.05);各转染组均显著高于相同剂量正常组 (P<0.05)(图7、8)。
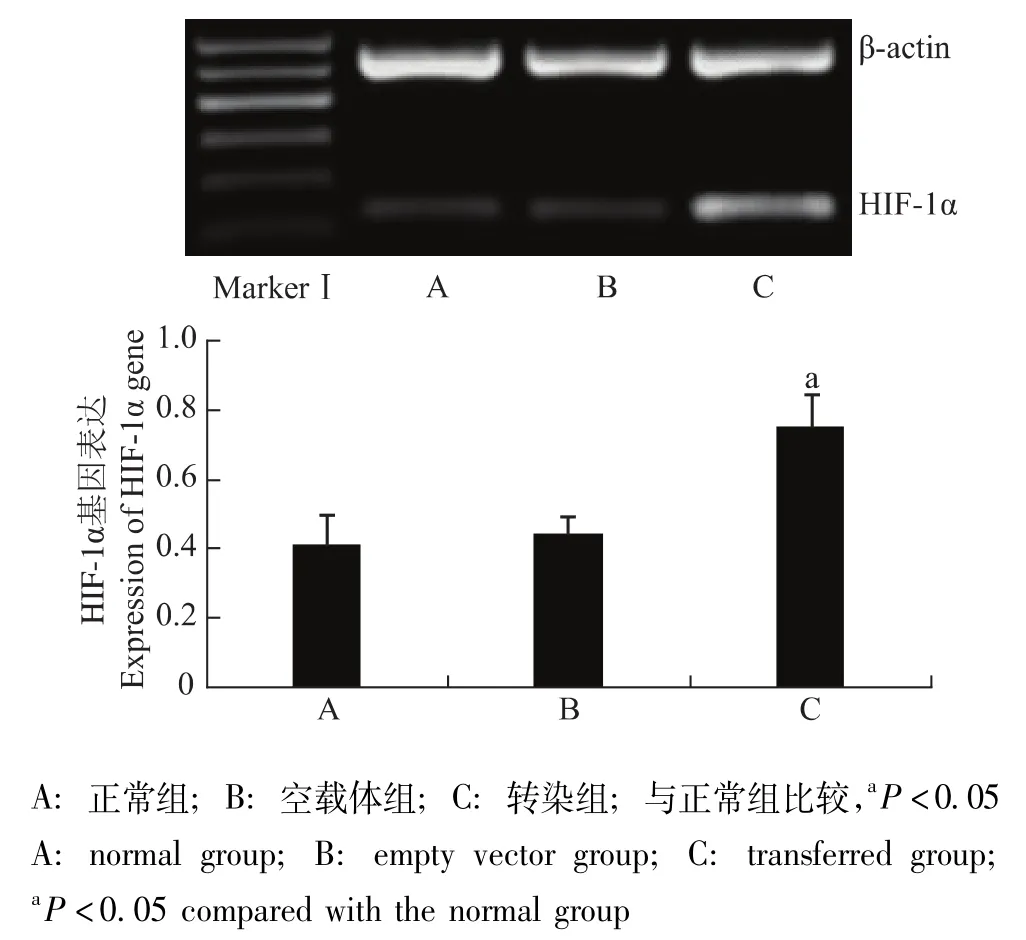
图2 各组细胞HIF-1α基因表达Fig 2 Expression of HIF-1α gene in each group
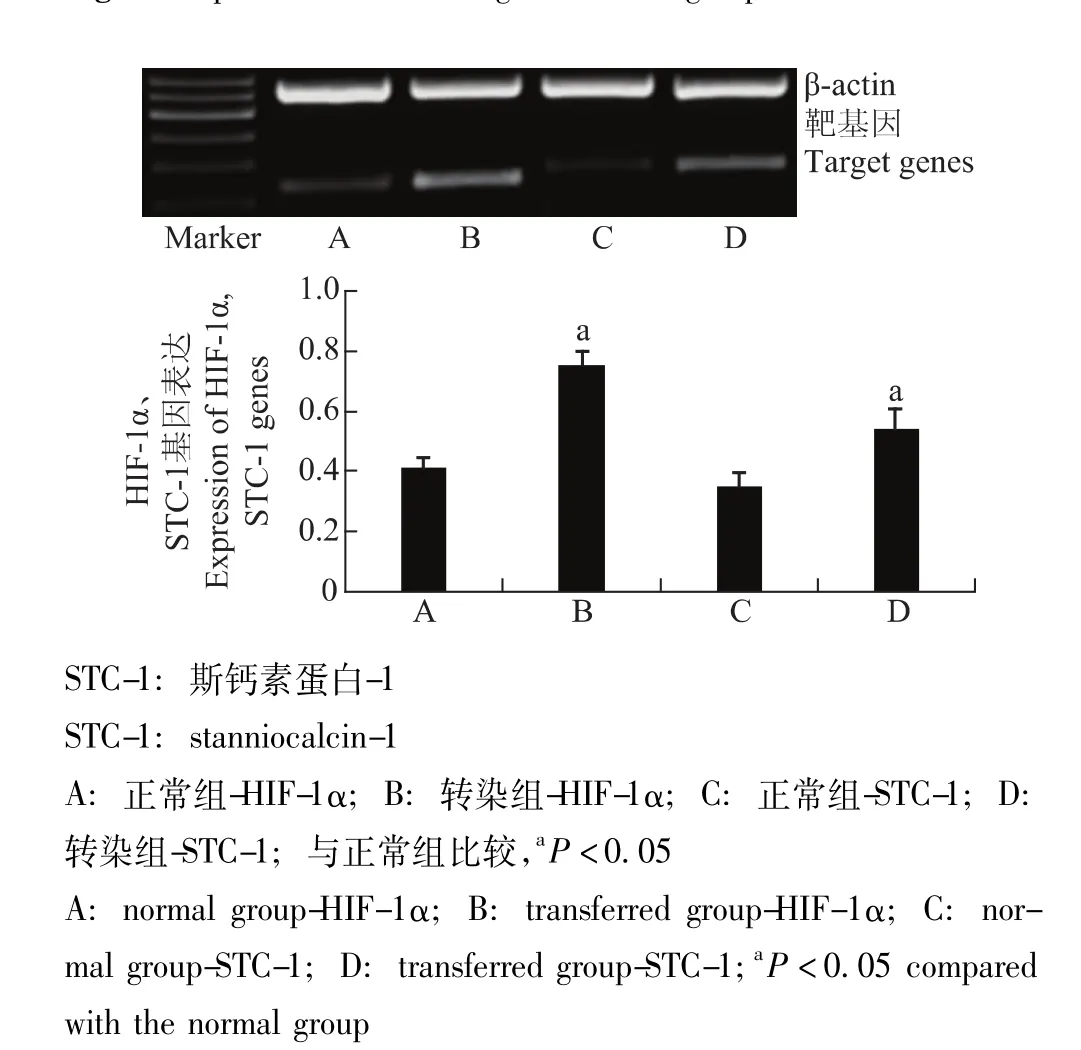
图3 各组细胞HIF-1α和STC-1的基因表达Fig 3 Expressions of HIF-1α and STC-1 genes in each group
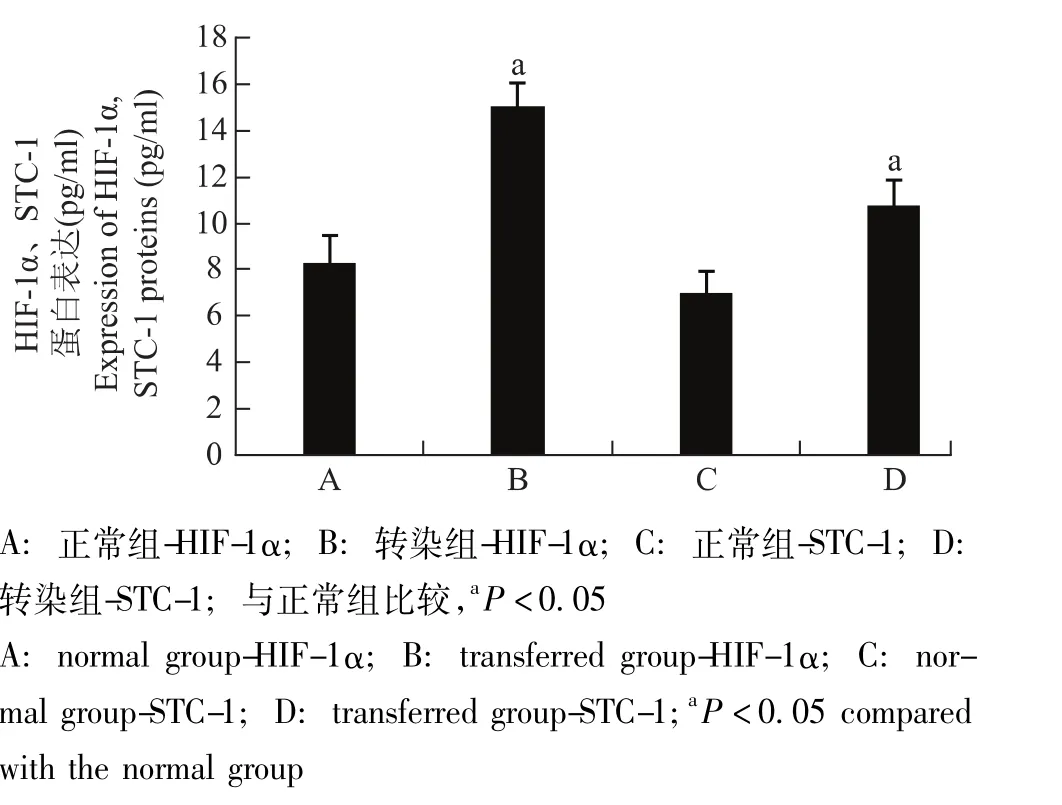
图4 各组细胞HIF-1α和STC-1蛋白表达Fig 4 Expressions of HIF-1α and STC-1 proteins in each group
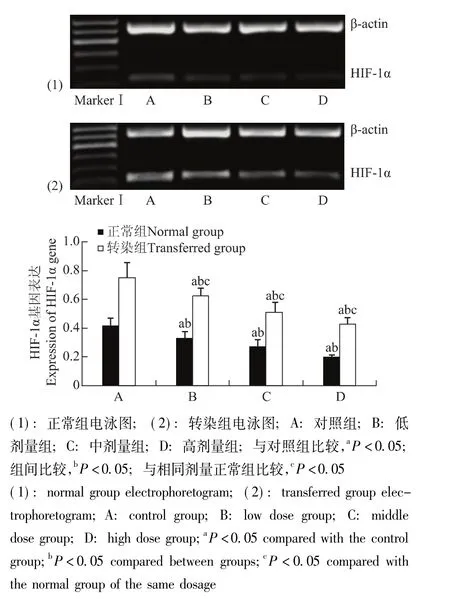
图5 各组细胞HIF-1α基因表达Fig 5 Expression of HIF-1α gene in each group
STC-1干预转染组和正常组GRC-1细胞48h后的Ca2+含量低、中、高剂量组细胞内Ca2+含量显著低于对照组 (P均<0.05),且随着STC-1蛋白浓度增高而逐渐降低;各转染组Ca2+含量显著低于相同剂量正常组 (P均<0.05)(图9)。
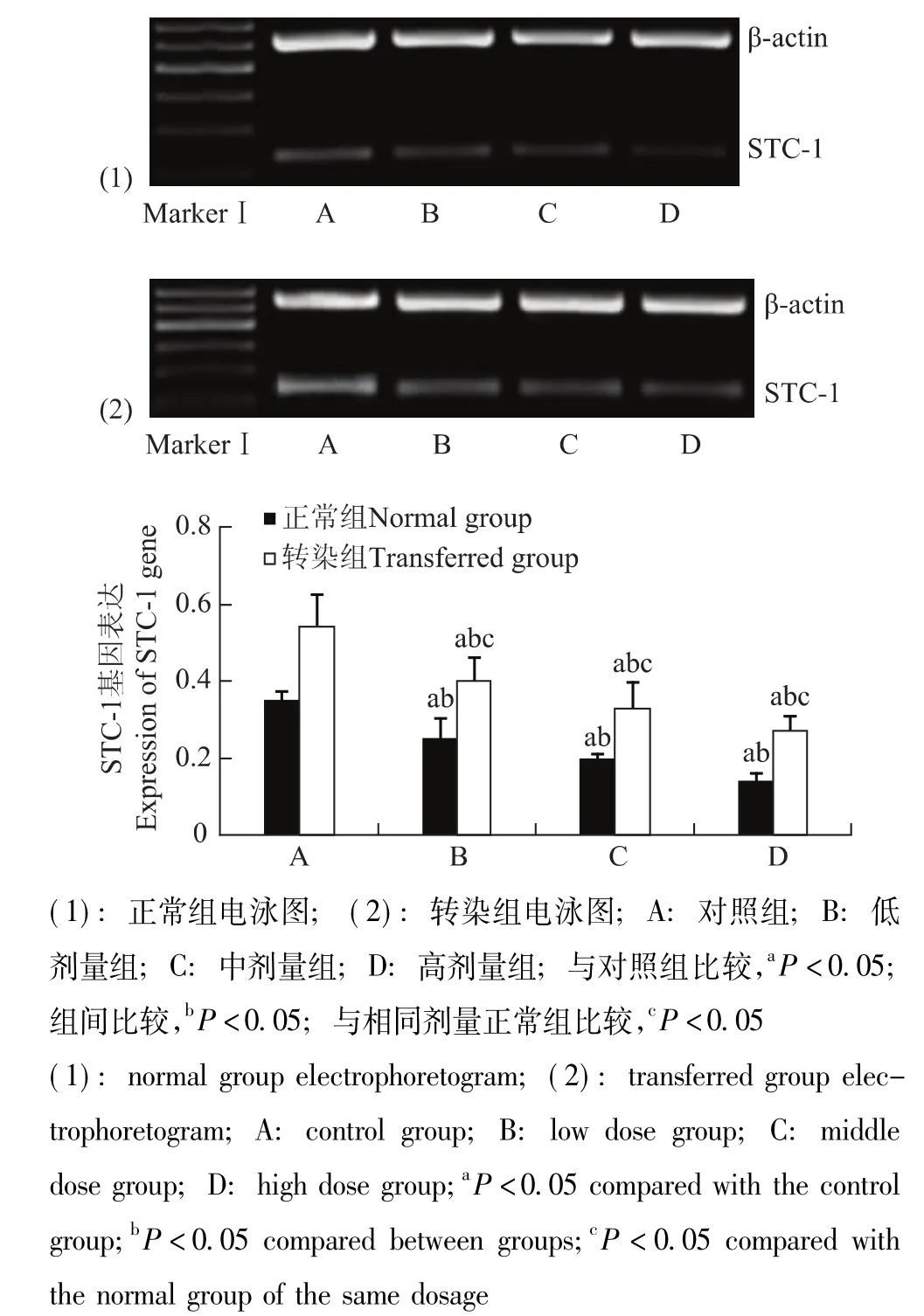
图6 各组细胞STC-1基因表达Fig 6 Expression of STC-1 gene in each group
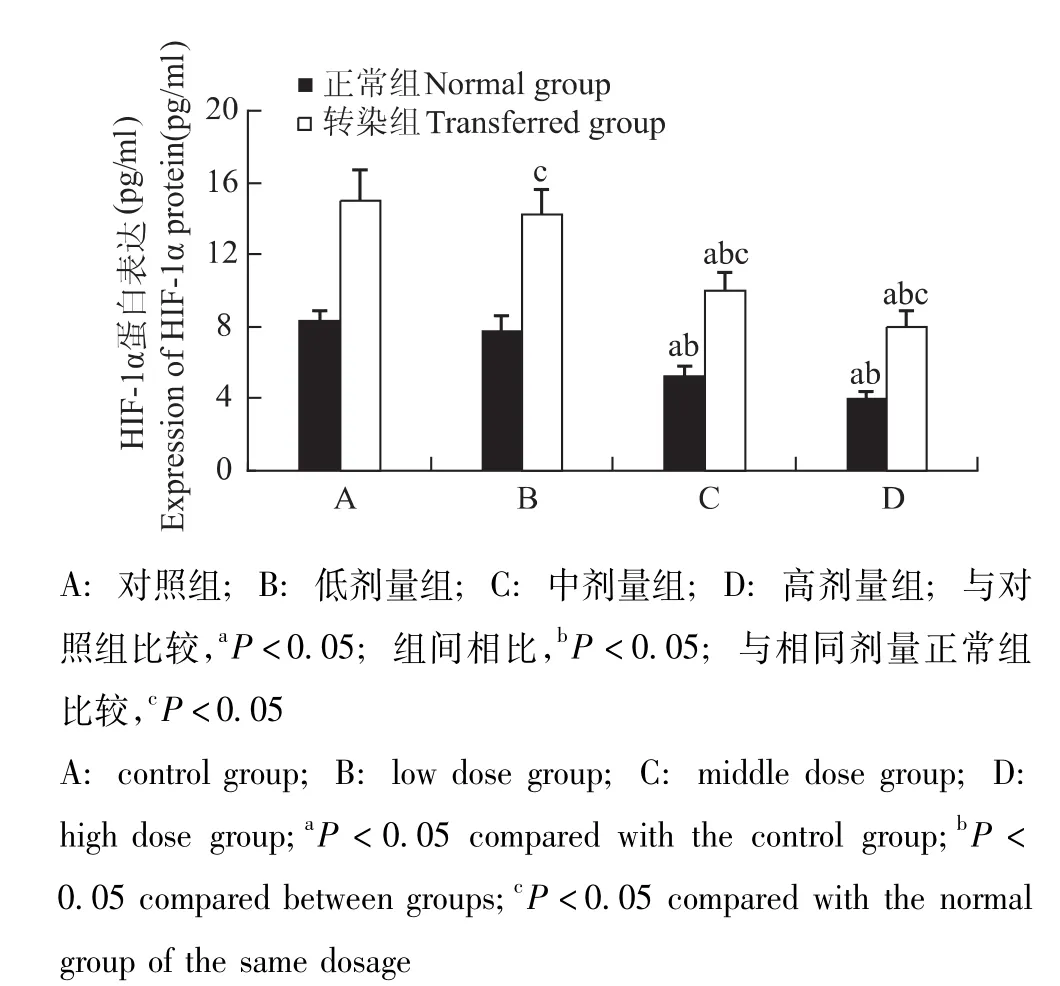
图7 各组细胞HIF-1α蛋白表达Fig 7 Expression of HIF-1α protein in each group
线粒体形态学鉴定詹纳斯绿B染色结果显示,提取的线粒体呈现圆形、椭圆形和杆状的蓝绿色物质(图10)。
STC-1干预转染组和正常组GRC-1细胞后mPTP的变化情况与对照组相比,随着STC-1给药浓度的逐渐增加吸光度逐渐升高,在中、高剂量组差异有统计学意义 (P均<0.05);各转染组吸光度显著高于相同剂量正常组 (P均<0.05)(图11)。
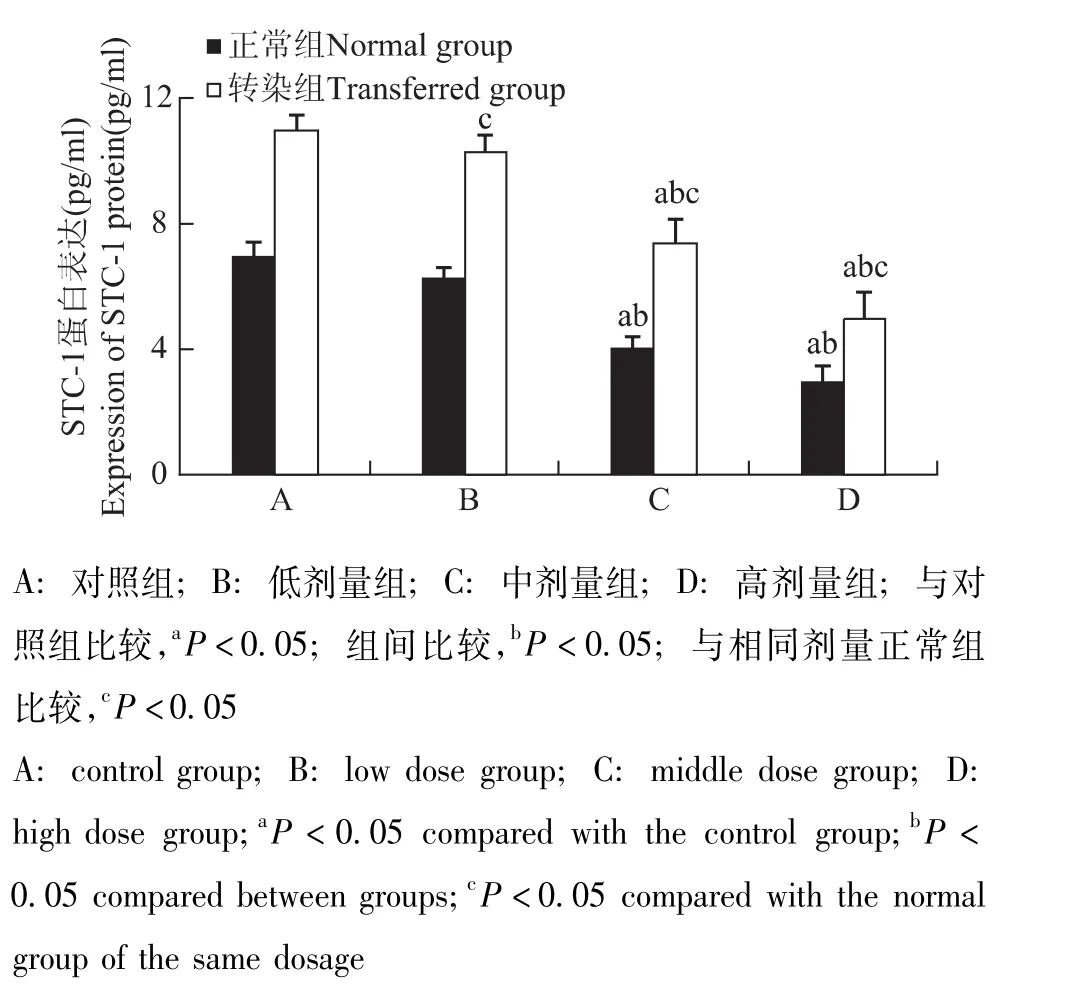
图8 各组细胞STC-1蛋白表达Fig 8 Expression of STC-1 protein in each group
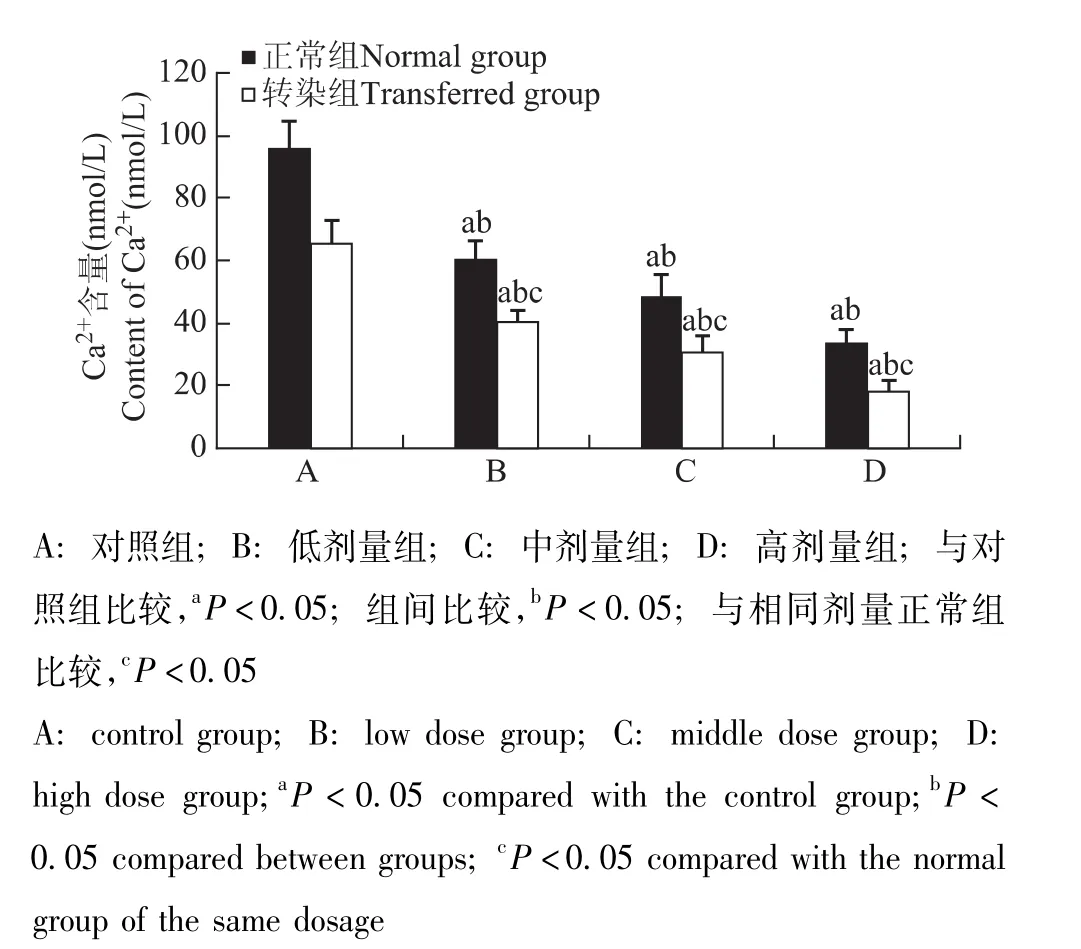
图9 各组细胞内Ca2+水平Fig 9 Level of Ca2+in each group
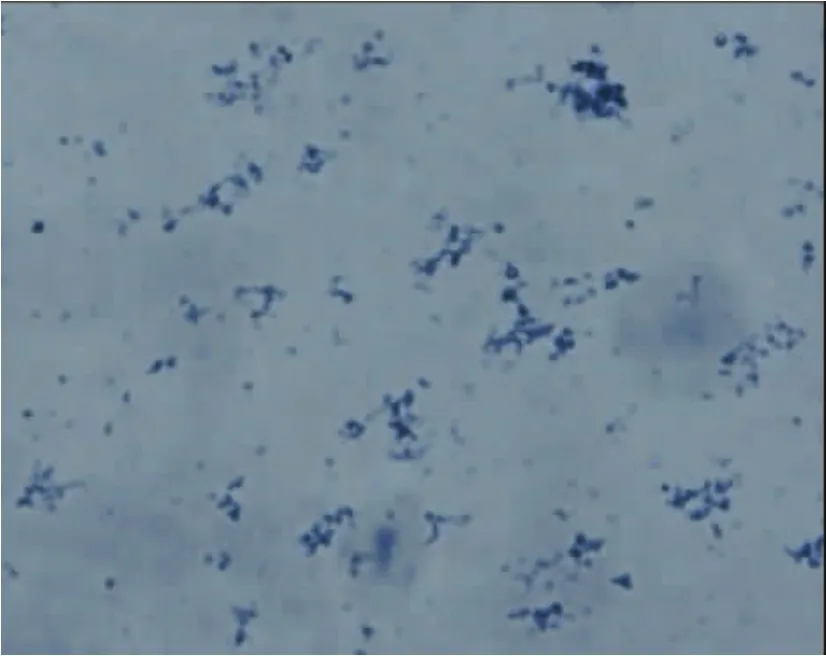
图10 线粒体的詹纳斯绿B染色 (×400)Fig 10 Janus green B staining of isolated mitochondria(×400)
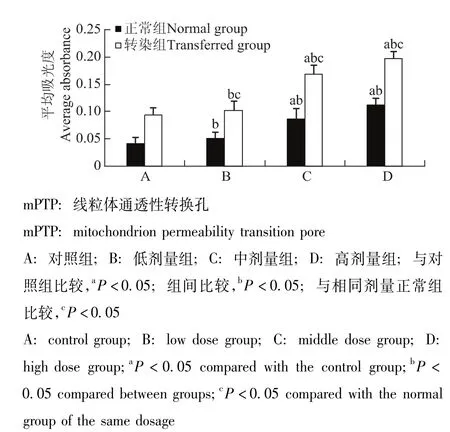
图11 各组细胞mPTP的变化Fig 11 Membrane permeability transition pore in each group
STC-1干预转染组和正常组GRC-1细胞后Δψm的变化情况与对照组相比,随着STC-1给药浓度的逐渐增加荧光强度逐渐降低,在中、高剂量组差异有统计学意义 (P均<0.05);各转染组荧光强度显著低于相同剂量正常组 (P均<0.05)(图12)。
STC-1干预转染组和正常组GRC-1细胞后的细胞增殖情况与对照组相比,低、中剂量组吸光度显著增高 (P均<0.05),但随着STC-1浓度增高而逐渐下降,在高剂量组虽变化不明显,但仍显著高于对照组 (P<0.05);各转染组吸光度显著高于相同剂量正常组 (P均<0.05)(图13)。
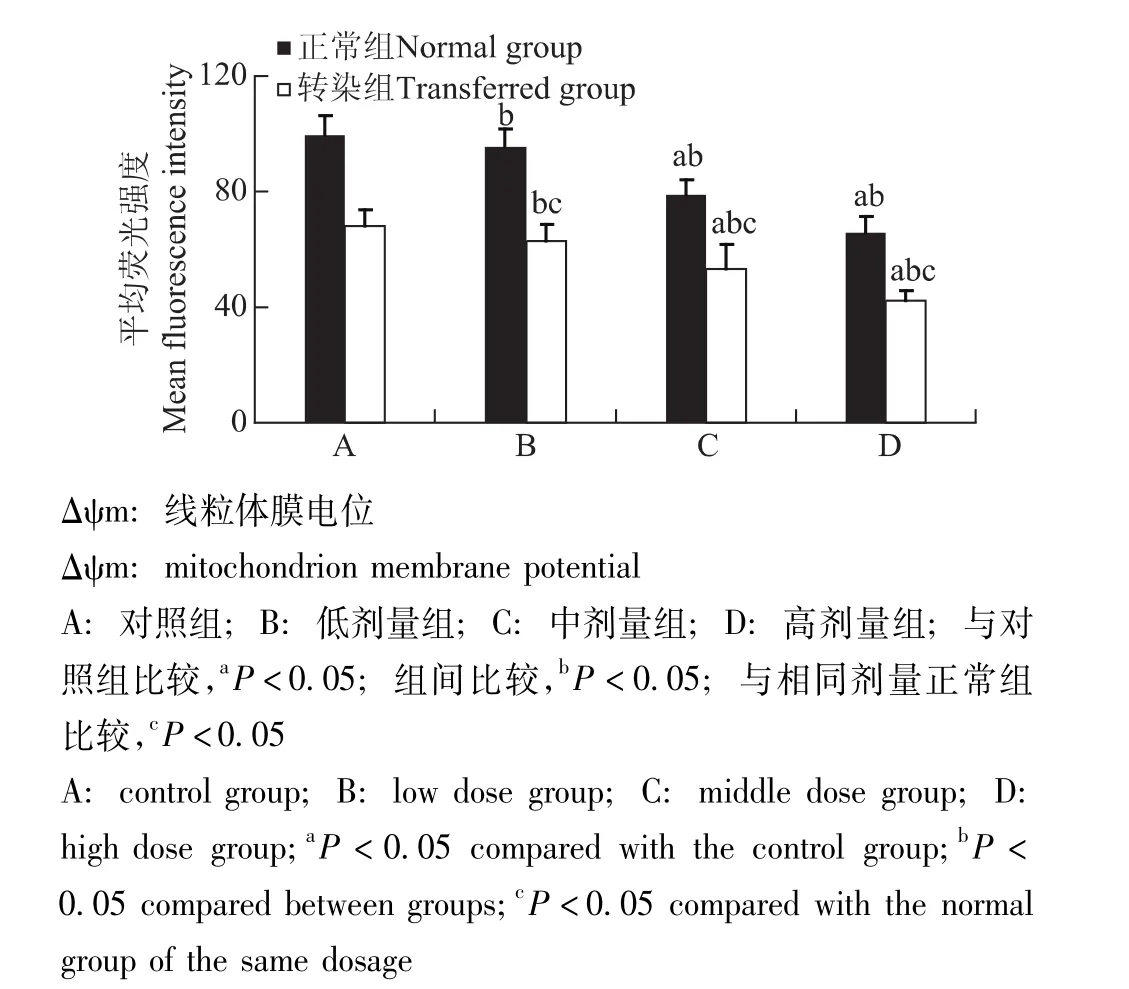
图12 各组细胞Δψm的变化Fig 12 Mitochondrion membrane potential in each group
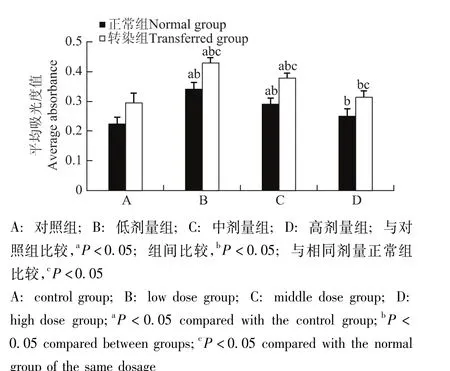
图13 STC-1对肾癌细胞增殖的影响Fig 13 Effect of STC-1 on the proliferation of renal carcinoma cells
讨 论
肿瘤细胞较正常组织细胞生长更为迅速,为了满足其生长代谢,对线粒体供能的需求也更为迫切[8]。作为“能量工厂”的线粒体产能的前提和基础主要取决于线粒体结构和功能的调控枢纽,即mPTP与Δψm的稳定与否[2]。mPTP是位于线粒体内外膜之间的复合性孔道,是线粒体内外信息交流的中心枢纽,正常情况下mPTP只允许相对分子质量小于1500的分子通过,质子可自由通过线粒体膜,形成稳定的Δψm[9]。然而,肿瘤由于细胞自身代谢高、相对乏氧环境等因素使其持续存在氧化应激,导致钙超载,进而诱发mPTP开放[6],但持续开放的mPTP又将导致Δψm降低或丧失,这可能是细胞凋亡级联反应过程中最早发生的事件,线粒体一旦发生崩溃,则细胞凋亡不可逆转[10]。有研究表明,HIF-1α与肿瘤发生发展密切相关,可通过上调细胞内质网钙泵SERCA2蛋白表达及增强线粒体Ca2+缓冲能力,促进细胞内Ca2+向内质网、线粒体转移[11],并下调细胞膜非典型L型钙通道表达,引起Ca2+内流减少,从而避免钙超载[12]。加之HIF-lα是低氧诱导STC-1表达的关键调节因子[3],而STC-1具有调节Ca2+平衡的作用,且属于肾癌的高显基因[4]。本研究因此建立了STC-1蛋白干预高表达HIF-1α的肾癌细胞模型,探讨了STC-1和HIF-1α是否通过影响Ca2+、STC-1、HIF-1α等线粒体膜电势稳定相关指标,参与肾癌细胞的恶性增殖机制。
本研究首先成功构建了过表达HIF-1α的GRC-1细胞系,随后检测了转染组和正常组细胞内HIF-1α和STC-1的基因及蛋白表达,结果发现转染组显著高于正常组,说明GRC-1细胞高表达HIF-1α能够促进自身STC-1的表达,这与HIF-lα是乏氧诱导STC-1表达的关键调节因子[3]这一观点相符。转染组和正常组细胞经不同浓度STC-1蛋白干预后,低、中、高剂量组HIF-1α和STC-1基因及蛋白表达较之相应对照组逐渐降低,推测这可能是STC-1蛋白下调肿瘤细胞内HIF-1α表达[13],进而减弱了HIF-1α刺激STC-1表达的作用,亦可能是外源性STC-1直接作用于细胞后的负反馈调节所致。横向比较,各转染组HIF-1α和STC-1基因及蛋白表达均显著高于相同剂量正常组,原因可能是转染组细胞HIF-1α高表达刺激了STC-1表达,该作用部分拮抗了STC-1蛋白下调肿瘤组织中HIF-1α的表达。从各实验组Ca2+含量的检测结果可推测:STC-1蛋白可降低细胞内Ca2+含量,且随着STC-1蛋白浓度的增加而逐渐降低;横向比较,Ca2+含量在各转染组显著低于相同剂量正常组,这与转染组较正常组中HIF-1α和STC-1基因及蛋白的表达量上升相匹配。结合mPTP和Δψm结果可以发现,与对照组相比,正常组和转染组细胞随STC-1蛋白给药浓度的增加,mPTP开放度逐渐降低,Δψm逐渐升高,且在中、高剂量组出现显著差异;各剂量组细胞内mPTP开放度逐渐降低、Δψm逐渐升高与Ca2+含量逐渐降低相匹配。
此外本研究还发现,STC-1能促进GRC-1细胞增殖,而促增殖作用随着加入STC-1蛋白浓度的增加而降低,推测其原因可能有以下两方面:(1)正常组细胞随着STC-1蛋白给药浓度的增加,HIF-1α、Ca2+水平逐渐下降,STC-1对GRC-1细胞的促增殖作用可能是通过减少细胞内Ca2+含量,抑制mPTP开放,提高Δψm,维持线粒体产能效应而实现;但HIF-1α是使细胞抗乏氧的有利基因,STC-1降低Ca2+的同时也降低HIF-1α,当HIF-1α的表达下降到一定程度时,STC-1对细胞的增殖促进作用逐渐被HIF-1α表达下降所拮抗。(2)转染组细胞内HIF-1α过表达,但随着STC-1蛋白浓度的增加,HIF-1α、Ca2+水平逐渐下降,推测GRC-1细胞增殖活性增高的原因可能是STC-1及HIF-1α通过减少细胞内Ca2+含量,维持线粒体结构和功能的稳定而实现;在低剂量组,STC-1蛋白对HIF-1α表达的抑制作用小于高表达HIF-1α对细胞促增殖的作用,但随着STC-1蛋白浓度的增加,高表达HIF-1α对细胞促增殖的作用逐渐被HIF-1α表达下降所拮抗,故STC-1对细胞促增殖的作用在低剂量组出现一过性增高,在中、高剂量组逐渐降低。
综上,本研究结果提示,细胞增殖活性增高的程度可能主要取决于细胞内STC-1、HIF-1α基因和蛋白的表达程度及Ca2+水平降低,其减缓了mPTP的持续开放,提高了Δψm,保障了线粒体结构和功能的完整,维持了产能效应。但HIF-1α、STC-1对mPTP、Δψm的作用是通过调节细胞内Ca2+间接实现还是通过其他细胞受体途径直接作用于线粒体,尚需深入研究。此外,HIF-1α诱导细胞内STC-1的表达与STC-1蛋白下调细胞内HIF-1α的表达之间是否存在剂量依赖关系,也需要对HIF-1α、STC-1进行基因表达的定量研究。
[1]高文祥,柳君泽,吴利平,等.急、慢性缺氧对大鼠脑线粒体能量代谢的影响 [J].中国病理生理杂志,2000,16(10):879-882.
[2]Giorgi C,Agnoletto C,Bononi A,et al.Mitochondrial calcium homeostasis as potential target for mitochondrial medicine[J].Mitochondrion,2012,12(1):77-85.
[3]杨月霞,黄文新.HIF-1α在缺血缺氧性疾病中的研究进展 [J].山东医药,2010,50(20):111-114.
[4]郝卫刚,张海蓉,段丽平.人类斯钙素与肿瘤相关性研究进展 [J].重庆医学,2011,40(36):3725-3727.
[5]张延涛,王静蓉,李晓燕.人类斯钙素生物学特性的相关研究 [J].医学综述,2009,15(19):2926-2928.
[6]Lemasters JJ,Theruvath TP,Zhong Z,et al.Mitochondrial calcium and the permeability transition in cell death [J].Biochim Biophys Acta,2009,1787(11):1395-1401.
[7]Sailaja R,Setty OH.Protective effect of Phyllanthus fraternus against allyl alcohol-induced oxidative stress in liver mitochondria [J].J Ethnopharmacol,2006,105(1):201-209.
[8] 罗湘建,曹亚.肿瘤能量代谢机制研究进展 [J].生物化学与生物物理进展,2011,38(7):585-592.
[9] 孟文彤,羊裔明,邓承祺,等.丹参酮ⅡA诱导NB4细胞凋亡与线粒体跨膜电位关系的研究[J].中华血液学杂志,2002,6(23):297-300.
[10]陈兰兰,孟明,万琪,等.辅酶Q10能有效抑制鱼藤酮诱导的细胞毒性作用[J].南京医科大学学报:自然科学版,2008,28(5):646-649.
[11]Neumann AK,Yang J,Biju MP,et a1.Hypoxia inducible factor l alpha regulates T cell receptor signal transduction[J].Proc NatlAcad SciUSA,2005,102(47):17071-17076.
[12]Callinan L,McCarthy TV,Maulet Y,et a1.Atypical L-type channels are down-regulated in hypoxia[J].Biochem Soc Trans,2005,33(5):1137-1139.
[13]Ellard JP,McCudden CR,Tanega C,et a1.The respiratory effects of stannioca1cin-1(STC-1)on intact mitochondria and cells:STC-1 uncouples oxidative phosphorylation and its actions are modulated by nucleotide triphosphates[J].Mol Cell Endocrinol,2007,264(1):90-101.
Effects of Stanniocalcin-1 and Hypoxia-inducible Factor-1α on Mitochondrial Membrane Potential Stability in Renal Carcinoma Cells
YANG Qing-tao1,GU Jiang1,ZHANG Yong-chun1,ZHU Zhi-hui1,YANG Yong-an1,WANG Nan1,ZHU Qing-liang2
1Department of Urologic Surgery,Affiliated Hospital,Guiyang Medical College,Guiyang 550004,China
2Department of Urologic Surgery,Jiangdu People’s Hospital,Yangzhou,Jiangsu 225200,China
GU Jiang Tel:0851-6773096,E-mail:gj0851@gmail.com
ObjectiveTo explore the effects of stanniocalcin-1(STC-1)and hypoxia-inducible factor-1α (HIF-1α)on the calcium and thus on the mitochondrial membrane potential(Δψm)in renal carcinoma cells.MethodsWe successfully established the renal carcinoma cell models with high HIF-1α gene expression.After various concentrations of STC-1 solutions were added to the culture medium,the proliferation of cells,expressions of HIF-1α and STC-1,levels of Ca2+,Δψm,and mPTP were detected by MTT,RT-PCR,ELISA,fluorescence spectrophotometry,and ultraviolet spectrophotometry,respectively.ResultsThe prolifer-ation of renal carcinoma cells and Δψm were improved after HIF-1α gene transfection,STC-1 protein intervention,and STC-1 protein intervention after gene transfection.While the intracellular Ca2+level and mPTP were decreased significantly(P <0.05),all the changes were intensified with the gradual increase of STC-1.However,the increasing trend of cell proliferation gradually declined.ConclusionHIF-1α may participate in malignant proliferation of renal carcinoma cells by promoting STC-1 proliferation or down-regulating Ca2+;however,such an effect may be gradually attenuated due to the inhibitory effect of STC-1 on HIF-1α.
renal carcinoma cells;stanniocalcin-1;hypoxia-inducible factor-1α;mitochondria
谷 江 电话:0851-6773096,电子邮件:gj0851@gmail.com
R445.2
A
1000-503X(2014)01-0012-08
10.3881/j.issn.1000-503X.2014.01.003
贵州省科技厅社会攻关计划项目 (黔科合SY字[2011]3060)Supported by the Guizhou Province Science and Technology Department of Social Research Projects(黔科合SY字 [2011]3060)
2013-08-23)
