补片扩大成型术构建猪腹主动脉瘤腔内治疗模型
2014-09-19吴巍巍姜雪莺宋小军刘昌伟
吴巍巍,姜雪莺,刘 暴,宋小军,刘昌伟
1中国医学科学院 北京协和医学院 北京协和医院血管外科,北京 100032
2首都医科大学附属北京同仁医院麻醉科,北京 100730
·论 著·
补片扩大成型术构建猪腹主动脉瘤腔内治疗模型
吴巍巍1,姜雪莺2,刘 暴1,宋小军1,刘昌伟1
1中国医学科学院 北京协和医学院 北京协和医院血管外科,北京 100032
2首都医科大学附属北京同仁医院麻醉科,北京 100730
目的探索使用补片扩大成型技术建立猪腹主动脉瘤模型,验证其作为动脉瘤腔内修复动物模型的可行性。方法实验猪在全身麻醉下接受腹人工血管补片扩大成型术构建腹主动脉瘤模型,随即进行动脉造影,并实施覆膜支架动脉瘤腔内修复术,术后随访3个月复查造影。结果完成腹主动脉瘤模型建立及腔内修复10例,所有模型建立均获得成功,术中测量肾下腹主动脉直径平均为 (10.5±0.4)mm;动脉瘤模型最大直径平均为 (26.3±3.1)mm,直径平均增加(15.7±3.1)mm;动脉瘤模型建立前、后的动脉直径差异有统计学意义 (P<0.001)。除1例因腔内修复时支架遮盖肾动脉于术后24 h死亡,其余实验猪手术过程平稳,术后恢复良好,随访3个月未发生意外死亡,围手术期1个月及术后3个月生存率均为90%。腔内修复发生Ⅱ型内漏1例 (10%),随访3个月造影均无内漏。结论全身麻醉下开腹人工血管补片扩大成型技术构建猪腹主动脉瘤模型安全有效,该模型可作为腹主动脉瘤腔内修复的动物模型。
腹主动脉瘤;模型;猪;腔内修复
Acta Acad Med Sin,2014,36(1):92-97
随着介入治疗技术的进步和医用生物材料的发展,腹主动脉瘤治疗除经典的开腹切除术外,腔内修复术近年来有了长足发展。腔内修复需要使用覆膜血管支架,新型覆膜血管支架的有效性和安全性需要通过合适的动脉瘤动物模型进行评估。由于猪的主动脉在形态、生理、分支血管分布方面与人腹主动脉有相似性[1],因此猪动脉瘤模型是较为理想的腹主动脉瘤研究和评价腔内修复效果的模型[2]。本课题组经过摸索,采取全身麻醉下开腹人工血管补片扩大成型技术建立猪腹主动脉瘤模型,随即经股动脉进行腔内覆膜支架修复,观察了实验猪长期存活情况及介入治疗远期效果,探讨了其作为动脉瘤动物模型的可行性。
材料和方法
实验动物北京郊区当地杂种长白猪10只,雌雄不限,体重40~60 kg。本研究经中国医学科学院北京协和医院伦理审查委员会审核同意。
麻醉实施与围术期管理
术前准备:术前3 d严密观察动物的精神状态、饮食及活动情况,排除有异常的猪,所有猪术前禁食12 h,禁水6 h。
麻醉方法:采取气管插管静脉复合麻醉。
术中转运:猪动脉瘤模型建立成功后,带气管插管,球囊辅助通气转运至导管室后重新连接麻醉机控制呼吸,继续给予药物维持麻醉,进行主动脉造影及动脉瘤腔内修复术。
血压控制:麻醉后解剖显露右侧颈动脉,穿刺置管进行直接动脉压监测。术中根据不同手术阶段,在直接动脉压监测下调节血压。主动脉阻断后用硝酸甘油适当降低血压,重新开放阻断前加快补液并用麻黄素适当提升血压。在腔内修复术中放置主动脉覆膜支架时用硝酸甘油控制性降压,维持收缩压在90~100 mmHg(1 mmHg=0.133 kPa)。
预防感染:静脉输注氨苄青霉素3 g预防感染。
麻醉苏醒:在实验猪自主呼吸恢复良好时,拔除气管导管后将动物置于侧卧位或俯卧位,适当保温直至意识完全恢复。
腹主动脉瘤模型的建立剑突至脐下正中切口进腹,将小肠推向右侧,在肠系膜根部左侧打开后腹膜,仔细结扎腹主动脉前方的淋巴管,显露肾下腹主动脉,套阻断带备用;经静脉通路给予肝素钠200 U/kg,阻断腹主动脉,纵行切开猪腹主动脉中段左前侧壁长约1.5 cm,将涤纶人工血管 (法国Intervascular公司)修剪成椭圆形,长径1.2 cm,短径0.6 cm,长径作为横径与腹主动脉左前侧壁切口连续外翻缝合,使腹主动脉形成向左前方突起的动脉瘤;解除血管阻断,测量腹主动脉直径、瘤体直径,仔细止血,逐层关腹。
腹主动脉造影及腔内修复转运至导管室,向股动脉置入导管鞘;C臂 (GE LCV+,美国通用公司)透视下送入亲水导丝至腹主动脉,经导丝引入猪尾造影导管,正位及右前斜位行腹主动脉造影,测量瘤体直径、瘤颈及瘤体长度,按超过瘤颈直径10%~20%选择支架直径,按瘤颈瘤体长度选择支架长度;撤出导管,保留导丝,拔除导管鞘,尖刀横行切开股动脉前壁约3 mm,沿导丝输送已消毒的自膨式覆膜支架血管 (苏州维科公司)至腹主动脉,支架近端至少超过动脉瘤上缘1.5 cm,远端至少超过动脉瘤下缘1.5 cm,按预定位置释放支架;撤出支架输送系统,更换导管鞘,沿导丝进入猪尾造影导管,复查动脉造影,记录有无内漏;撤出导管鞘,血管缝线关闭股动脉切口,逐层缝合腹股沟切口。
术后随访及病理术后12 h恢复流食,逐渐过渡为正常饮食,观察实验猪复苏、饮食及下肢血运;随访3个月,按上述方法复查腹主动脉造影,记录腹主动脉直径、支架内径、有无内漏;造影后安乐死,取材进行大体及镜下病理检查。
统计学处理采用SPSS 19.0统计软件,计量资料以均数±标准差表示,组间比较采用配对样本t检验,P<0.05为差异有统计学意义。
结 果
一般情况共完成腹主动脉瘤模型建立及腔内修复10例,实验用猪体重 (51.9±4.5)kg,猪龄 (11.3±0.9)个月,手术出血 (352±66)ml。1例因腔内修复时支架遮盖肾动脉于术后24 h死亡,其余实验猪手术过程平稳,麻醉效果满意,术后随访3个月未发生意外死亡,围术期1个月及术后3个月生存率均为90%。
动脉瘤模型建立阻断腹主动脉建立动脉瘤模型时,腹主动脉阻断时间为 (25.6±4.2)min,所有实验猪动脉瘤模型建立均获得成功。术中测量结果显示,正常肾下腹主动脉直径平均为 (10.5±0.3)mm,动脉瘤模型最大直径平均为 (26.3±3.1)mm,直径平均增加(15.8±3.1)mm,动脉瘤模型建立前、后动脉直径差异有统计学意义 (P<0.001)(图1)。
动脉瘤造影及腔内修复腹主动脉造影 (图2)测量近端瘤颈 (瘤体上缘至较低肾动脉下缘)距离平均为 (42±12)mm,远端瘤颈 (瘤体下缘至主动脉分叉)距离平均为 (40±15)mm,选取支架规格统一为直径12 mm,长度60 mm。腔内修复释放覆膜支架时使用硝酸甘油降压,收缩压控制在 (94.6±3.0)mmHg。未发生Ⅰ型内漏,发生Ⅱ型内漏1例 (10%),随诊观察。1例实验猪释放时因技术失误支架遮盖肾动脉,于术后24 h内死亡 (图3)。完成手术后缝合切口(图4)。

图1 猪腹主动脉瘤模型,黑箭头所示为涤纶补片瘤体,白箭头所示为腰动脉Fig 1 An experimental abdominal aortic aneurysm swine model,the black arrow shows a dacron patch and the white arrow shows a lumbar artery

图2 猪动脉瘤模型数字减影造影Fig 2 Digital subtraction angiography of an experimental abdominal aortic aneurysm swine model
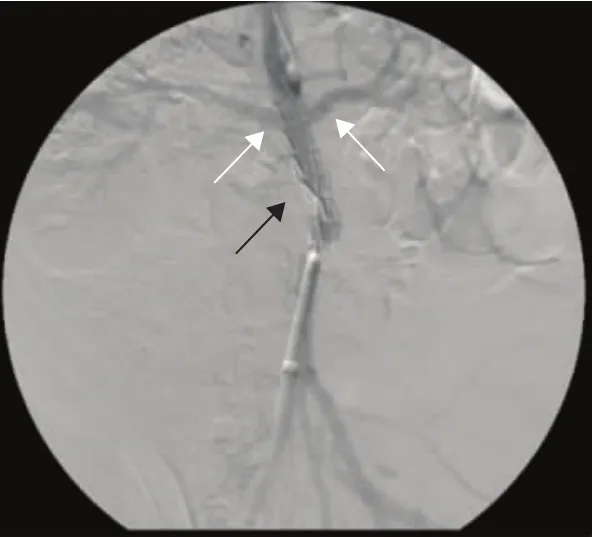
图3 覆膜支架误覆盖肾动脉,黑箭头所示为覆膜支架,白箭头所示为双侧肾动脉Fig 3 The renal arteries of a swine model were covered by the stent graft carelessly,the black arrow shows the stent graft and the white arrows show bilateral renal arteries

图4 猪动脉瘤模型手术切口Fig 4 Surgical incision of a swine model
随访复查造影及病理存活实验猪均在手术后3个月存活良好,经对侧腹股沟切口解剖股动脉,复查造影显示腹主动脉、肾动脉及髂动脉均通畅,支架位置良好,均无内漏。复查造影后安乐死,取材标本,大体病理显示支架没有发生塌陷,全部支架的横截面形态基本保持规则的圆形,支架周围瘤腔内血栓化良好,无内漏;镜下病理显示支架表面被新生内膜覆盖,新生内膜以成纤维细胞为主,动脉壁少量炎性细胞浸润,动脉中层平滑肌无明显断裂。
讨 论
腹主动脉瘤动物模型的构建腹主动脉瘤男性发病率为4% ~9%,女性发病率约为1%[3]。腹主动脉瘤危害巨大,一旦破裂,后果严重,有调查显示,42%的患者甚至都来不及送至医院[4],即使送至医院进行急诊手术,术后30 d内死亡率也高达41%。2003年美国所有死因中死于腹主动脉瘤破裂和主动脉夹层破裂占5.1%[5]。随着社会进入老龄化,腹主动脉瘤的发病率还在逐渐升高。动脉瘤动物模型对于研究腹主动脉瘤的发病机制、治疗和预防具有重要的科研价值。
最早的腹主动脉瘤动物模型始于20世纪50年代。研究者通过喂食大鼠甜豌豆造成大鼠山黧豆中毒,发现可引起大鼠主动脉瘤形成和自发破裂[6]。此后,还有研究者通过喂食实验动物β-氨基丙腈和肼苯哒嗪[7]、乙烯雌酚[8]诱导破裂动脉瘤模型。20世纪70年代,医学家通过诱导大鼠X染色体上基因变异,制作基因缺陷Blotchy大鼠,基因变异导致铜代谢紊乱,使大鼠主动脉壁弹力蛋白和胶原的连接破坏而产生动脉瘤[9]。基质金属蛋白酶 (matrix metalloproteinases,MMP)[10]、MMP 组织抑制蛋白 (tissue inhibitor of MMP,TIMP)[11]、血管紧张素转化酶和血管紧张素Ⅱ受体[12]等也被用作干预靶点制作基因缺陷动脉瘤动物模型。上述药物或基因诱导的动脉瘤动物模型对于研究动脉瘤的发病机制和影响因素具有重要意义,但实验动物体型偏小,成瘤周期长,结果不确切,一般不适于作为动脉瘤外科治疗模型。
基于对动脉瘤发病机制的了解,研究者也尝试通过化学物质直接干预的方法制作腹主动脉瘤动物模型,即采用化学物质浸泡动脉主动脉壁诱导炎症反应来制作动脉瘤模型,如用氯化钙溶液和硫代硫酸浸泡可导致兔主动脉中膜炎症损伤,3周后会形成动脉瘤[13]。弹力蛋白酶灌注动物主动脉可导致动脉壁弹力蛋白降解,诱导形成大鼠动脉瘤[14]。化学物质诱导的动脉瘤动物模型对于研究动脉瘤的发病机制也具有一定意义。主动脉在化学物质作用后至形成动脉瘤需要一定时间,需要通过定期检查监测成瘤效果,形成动脉瘤后也可作为动脉瘤外科治疗模型,但具有一定局限性。
直接通过手术方法制作动脉瘤动物模型具有制作快速、形态可控、效果确切的优点。20世纪50年代,Allen[15]就使用一段下腔静脉间置在肾下腹主动脉制作动脉瘤模型,由于静脉壁薄,不能承受动脉压力,最终移植物破裂导致实验动物死亡。20世纪90年代,研究者使用囊状移植物间置于肾下腹主动脉,切除一段自体腹主动脉,将移植物间置端端吻合在动物腹主动脉间,制作了犬、猪和羊动脉瘤模型,使用的移植物包括涤纶[16]、生物可降解弹力聚氨酯膜[17]、自体颈静脉[18]、胃浆膜[19]和戊二醛处理的异体牛颈静脉[20]等,但间置移植物模型切除了一段自体动脉,创伤较大,而且破坏了腰动脉分支。还有研究者尝试将动物腹主动脉前壁纵行切开,使用生物胶黏合[21]或是激光闭合[22],但成瘤率较低,形成动脉瘤直径也较小。在此基础上,研究者又继续发展出了补片动脉瘤模型,切开主动脉前壁,使用不同材料的补片制作动脉瘤,各种补片材料包括腹膜[23]、髂静脉[24]、空肠[25]、涤纶[26]等。补片动脉瘤模型较间置动脉瘤模型手术创伤小,保留了腰动脉分支,更接近人腹主动脉瘤腔内治疗时的实际情况。上述通过手术方法制作的动脉瘤动物模型大多不能模拟动脉瘤自然生长的特点,一般不适于动脉瘤病因学研究,但由于成瘤确切,可用于大体型实验动物,尤其适于作为人腹主动脉瘤腔内治疗的实验动物模型,特别是用作研究动脉瘤腔内治疗技术。不足之处在于手术具有一定风险,需要麻醉医师的密切配合。
用于研究腹主动脉瘤腔内治疗技术的实验动物模型还需具备主动脉直径、分支分布与人相近的特点。本研究采用的北京郊区当地杂种长白猪体重及主动脉直径与人接近,主要分支分布与人类似,适于用作腹主动脉瘤腔内治疗动物模型。设计该模型时使用涤纶补片,将补片长径垂直于腹主动脉纵行切口作扩大成型,起到了“纵切横缝”的效果,和文献中报道方法相比构建动脉瘤更大,成瘤直径更理想,补片成型法也保留了瘤体周围的腰动脉分支,在后续的腔内治疗中较好地模拟了人腹主动脉瘤腔内治疗。
值得一提的是,本模型构建的动脉瘤是偏心性动脉瘤,猪腹主动脉直径略小于人腹主动脉直径,不适用于现有的分叉型腹主动脉瘤覆膜支架产品,用于验证新型支架时需专门设计较小尺寸的支架;补片材料也可能限制瘤体本身对内漏的病理反应 (如动脉瘤继续扩张)等,分析实验结果时要充分考虑该模型的局限性。
补片扩大成型法构建猪动脉瘤腔内治疗模型的管理要点猪的循环系统结构与人体相似,尤其是主动脉解剖结构及直径均与人主动脉相近,特别适于构建用于检验新治疗方法有效性的动脉瘤模型,但猪的麻醉风险较其他动物大。本研究在静脉诱导后将成人大号直镜片从猪喙左侧置入并尽量伸向口咽部,向上提起后以消毒环钳顺镜片方向向前深入至会厌根部,向上稍施力,即可将会厌尖端从食道开口内挑出,猪的声门可在其后方窥及,此时给予肌松药物后插管,成功率较高。
猪在完成腹主动脉瘤模型建立后,需转运至导管室进行腔内修复。麻醉医师在转运过程中应起到指挥作用,协调手术医师及其他手术室人员运送实验猪。转运前可追加肌松药物和镇静药物,转运过程中应格外注意猪气道的管理,避免各管路脱出,转运过程中需备好各种麻醉药物和急救药品。
开腹人工血管补片扩大成型技术建立猪腹主动脉瘤模型需要在肾动脉水平下方阻断猪腹主动脉 (25.6±4.2)min,维持血流动力学稳定是腹主动脉瘤手术麻醉管理的重点[27-29]。腹主动脉阻断后外周血管阻力增高,近端动脉压增加,左心负荷急剧增加;当腹主动脉开放,阻断远端区域的组织器官血流恢复,重新得到灌注,左心后负荷降低,外周血管阻力降低,加之手术失血,血容量不足,共同作用可引起血压明显下降。阻断或开放主动脉钳夹时速度要慢,需与麻醉医师充分协作,必要时应重新阻断或开放。腹主动脉开放前,应停止使用血管扩张药,开放后为了维持心、脑、肾足够的灌注压,必要时使用血管收缩药。
腔内修复过程中为减少支架释放时受近端血流冲击而移位,需在麻醉医师配合下使用小剂量硝酸甘油控制性降压,将收缩压降至90~100 mmHg。支架释放过程通常为数秒钟,小量的硝酸甘油即可满足控制血压的要求。
[1]Kosmas IP,Dimitri PM,Despina P.Experimental models of abdominal aortic aneurysms:an overview [J].Current Pharmaceutical Design,2008,14(4):325-337.
[2]Molácek J,Treska V,Kobr J,et al.Optimization of the model of abdominal aortic aneurysm-experiment in an animal model[J].J Vasc Res,2009,46(1):1-5.
[3]Cowan JA Jr,Dimick JB,Henke PK,et al.Epidemiology of aortic aneurysm repair in the United States from 1993 to 2003[J].Ann N Y Acad Sci,2006,1085(1):1-10.
[4]Bengtsson H,Bergqvist D.Ruptured abdominal aortic aneurysm:a population-based study [J].J Vasc Surg,1993,18(1):74-80.
[5]Hoyert DL,Heron MP,Murphy SL,et al.Deaths:final data for 2003 [J].Natl Vital Stat Rep,2006,54(13):1-120.
[6]Ponseti IV,Baird WA.Scoliosis and dissecting aneurysm of the aorta in rats fed with Lathyrus odoratus seeds[J].Am J Pathol,1952,28(6):1059-1077.
[7]Simpson CF,Kling JM,Robbins RC,et al.Beta-aminopropionitrile-induced aortic ruptures in turkeys:inhibition by reserpine and enhancement by monoamine oxidase inhibitors[J].Toxicol Appl Pharmacol,1968,12(1):48-59.
[8]Simpson CF,Harms RH.Aortic ruptures in turkeys induced by diethylstilbestrol and dienestrol diacetate[J].Proc Soc Exp Biol Med,1966,123(2):604-606.
[9]Starcher B,Madaras JA,Fisk D,et al.Abnormal cellular copper metabolism in the blotchy mouse [J].J Nutr,1978,108(8):1229-1233.
[10]Allaire E,Forough R,Clowes M,et al.Local overexpression of TIMP-1 prevents aortic aneurysm degeneration and rupture in a rat model[J].J Clin Invest,1998,102(7):1413-1120.
[11]Eskandari MK,Vijungco JD,Flores A,et al.Enhanced abdominal aortic aneurysm in TIMP-1 deficient mice[J].J Surg Res,2005,123(2):289-293.
[12]Fukamizu A,Sugimura K,Takimoto E,et al.Chimeric renin-angiotensin system demonstrates sustained increase in blood pressure of transgenic mice carrying both human renin and human angiotensinogen genes[J].J Biol Chem,1993,268(16):11617-11621.
[13]Freestone T,Turner RJ,Higman DJ,et al.Influence of hypercholesterolemia and adventitial inflammation on the development of aortic aneurysm in rabbits[J].Arterioscler Thromb Vasc Biol,1997,17(1):10-17.
[14]Boudghene F,Anidjar S,Allaire E,et al.Endovascular grafting in elastase-induced experimental aortic aneurysms in dogs:feasibility and preliminary results [J].J Vasc Interv Radiol,1993,4(4):497-504.
[15]Allen P.The feasibility of autogenous vein grafts in the replacement of aortic aneurysms:a feasibility study [J].Can Med Assoc J,1957,76(11):922-926.
[16]Parodi JC,Palmaz JC,Barone HD.Transfemoral intraluminal graft implantation for abdominal aortic aneurysms[J].Ann Vasc Surg,1991,5(6):491-499.
[17]Hagen B,Harnoss BM,Trabhardt S,et al.Self-expandable macroporous nitinol stents for transfemoral exclusion of aortic aneurysms in dogs:preliminary results[J].Cardiovasc Intervent Radiol,1993,16(6):339-342.
[18]Soula P,Janne d’Othee B,Otal P,et al.Macroporous polyester-covered stent in an experimental abdominal aortic aneurysm model[J].J Endovasc Ther,2001,8(4):390-400.
[19]Uson-Gargallo J,Crisostomo V,Loscertales B,et al.A new model of abdominal aortic aneurysm with gastric serosa patch:surgical technique and short-term evaluation [J].J Invest Surg,2006,19(2):97-104.
[20]Whitbread T,Birch P,Rogers S,et al.A new animal model for abdominal aortic aneurysms:initial results using a multiple-wire stent[J].Eur J Vasc Endovasc Surg,1996,11(1):90-97.
[21]Troup PH,Rinne T.Methyl-2-cyanoacrylate(Eastman 910)in experimental vascular surgery with a note on experimental arterial aneurysms[J].J Neurosurg,1964,21(12):1067-1069.
[22]Quigley MR,Tuite GF,Cozzens JW.Histology and angiography in bifurcation aneurysm model[J].Surg Neurol,1988,30(6):445-451.
[23]Maynar M,Qian Z,Hernandez J,et al.An animal model of abdominal aortic aneurysm created with peritoneal patch:technique and initial results[J].Cardiovasc Intervent Radiol,2003,26(2):168-176.
[24]Eton D,Warner D,Owens C,et al.Results of endoluminal grafting in an experimental aortic aneurysm model[J].J Vasc Surg,1996,23(5):819-829.
[25]Criado E,Marston WA,Woosley JT,et al.An aortic aneurysm model for the evaluation of endovascular exclusion prostheses[J].J Vasc Surg,1995,22(3):306-314.
[26]Verbin C,Donayre C,Kopchok G,et al.Anterior patch aortic aneurysm model for the study of endoluminal grafts[J].J Invest Surg,1995,8(5):381-388.
[27]金立民,仇金鹏,王忠英,等.腹主动脉瘤30例手术的麻醉处理[J].实用心脑肺血管病杂志,2010,18(6):818-819.
[28]张砡,朱波,谭刚.腹主动脉瘤腔内修复与开腹切除术的麻醉管理比较 [J].中国微创外科杂志,2011,11(6):517-519,531.
[29]刘昌伟,刘暴,吴巍巍,等.腹主动脉瘤腔内治疗84例分析 [J].中国实用外科杂志,2009,29(11):913-915.
Open Construction of Experimental Abdominal Aortic Aneurysm Swine Models with Dacron Patch for Evaluating Endovascular Aneurysm Repair Techniques
WU Wei-wei1,JIANG Xue-ying2,LIU Bao1,SONG Xiao-jun1,LIU Chang-wei1
1Department of Vascular Surgery,PUMC Hospital,CAMS and PUMC,Beijing 100032,China
2Department of Anesthesiology,Beijing Tongren Hospitial,Capital Medical University,Beijing 100730,China
LIU Chang-weiTel:010-69158230,E-mail:liucw@vip.sina.com
ObjectiveTo construct an experimental abdominal aortic aneurysm(AAA)swine model with Dacron patch for evaluating endovascular aneurysm repair(EVAR)technique.MethodsThe experimental pigs were generally anesthetized for the open procedure of an aneurysm model creation with Dacron and subsequent arteriography and EVAR with stent graft.Repeat arteriography was performed after 3-month followup.ResultsAAA models were successfully constructed in all 10 experimental pigs.The average aneurysm diameter was(26.3 ±3.1)mm,increasing by(15.7 ±3.1)mm comparing to the primary aorta diameter(10.5 ±0.4)mm.The aorta diameter before and after the experiment showed significant difference(P <0.001).All the animals were survived after the procedure.One swine died 24 hours after the subsequent EVAR because the covering of both renal arteries by the stent graft.The rest 9 animals survived well after the whole operation and 3-month follow-up.The surviving rates at 1 month and 3 months after the operation were both 90%.One typeⅡ endoleak(10%)was observed after the EVAR,which disappeared at 3-month follow-up.Conclusions Open construction of experimental AAA swine models with Dacron patch is safe and feasible.The model can be used in the developing new EVAR techniques and implant training.
abdominal aortic aneurysm;model;swine;endovascular aneurysm repair
刘昌伟 电话:010-69158230,电子邮件:liucw@vip.sina.com
R654.4
A
1000-503X(2014)01-0092-06
10.3881/j.issn.1000-503X.2014.01.017
2013-06-17)
