串联亲和纯化技术筛选Bat3的相互作用蛋白质
2014-09-19李琴山缪时英王琳芳
吴 为,李琴山,宋 伟,缪时英,王琳芳
中国医学科学院 北京协和医学院 基础医学研究所医学分子生物学国家重点实验室,北京 100005
·论 著·
串联亲和纯化技术筛选Bat3的相互作用蛋白质
吴 为,李琴山,宋 伟,缪时英,王琳芳
中国医学科学院 北京协和医学院 基础医学研究所医学分子生物学国家重点实验室,北京 100005
目的寻找与Bat3结合的蛋白质。方法采用串联亲和纯化技术,在Bat3编码序列羧基端融合Strep2和FLAG 2个分子标签,以此为诱饵筛选与其特异结合的蛋白质,最后进行质谱鉴定。结果筛选到1种蛋白质分子,命名为Ubl4A,免疫共沉淀结果显示Ubl4A可与Bat3相互结合。结论成功建立了串联亲和纯化技术平台,分离出可与Bat3相互作用的蛋白质Ubl4A。
Bat3;凋亡;串联亲和纯化
材料和方法
材料与试剂Pfu Taq DNA polymerase、限制性内切酶、T4连接酶购自美国NEB公司,DMEM培养基、胎牛血清购自美国GIBCO公司,转染试剂Lipofectamine 2000购自美国Invitrogen公司;Anti-strep2珠子购自德国IKA公司,Anti-Flag珠子购自美国Sigma公司,Biotin、3x-flag多肽购自美国Sigma公司。根据NCBI中Bat3基因序列,利用PRIMER PREMIER软件设计引物:上游为TAAGCTAGCGCCACCATGGAGCCTAATGATAGTACCAG,下游为 AATACGCGTAGGATCATCAGCAAAGGCC。
载体构建及融合蛋白表达的检测以plentilox 3.7慢病毒表达质粒为母体,去掉其U6启动子区,插入带内部核糖体进入位点-增强型绿色荧光蛋白 (internal ribosome entry site-enhanced green fluorescence protein,IRES-EGFP)的巨细胞病毒启动子,将其改造为适合于过表达的慢病毒载体。改造后质粒的多克隆位点 为 EcoR1-Nhe1-Sma1-Mlu1-BamH1,在 Mlu1和BamH1之间插入Strep2-FLAG这两个标签序列,在Nhe1和Mlu1之间插入Bat3表达序列。通过lipofectamine 2000转染Bat3表达质粒,Western blotting检测Strep2和FLAG标签的表达。
包装病毒及感染293T细胞按照10 μg∶10 μg∶10 μg∶20 μg 的剂量,将慢病毒包装辅助质粒 plp1、plp2、VSVG与慢病毒过表达Bat3质粒转染至1个150 mm培养皿的293T细胞内,转染48、72 h后分别收集1次培养上清。将两次收集的上清超速离心,18 000 r/min离心3 h,得到的病毒沉淀用200 μl PBS溶解。分装,冻于-80℃冰箱。按照1∶50的比例将病毒原液加入到培养上清中感染293T细胞,72 h后荧光显微镜观察表达绿色荧光蛋白的细胞的比例。
串联亲和纯化收集5盘150 mm培养皿稳定表达Bat3的细胞,向细胞沉淀中加入5 ml NTEN裂解液,裂解20 min,14 000 r/min离心30 min。向细胞上清加入400 μl anti-Strep2 beads,孵育1 h,NTEN裂解液洗涤beads 3遍,加入1.2 ml含2 mg/ml的生物素洗脱液,洗脱2次。合并洗脱液,加入100 μl anti-FLAG beads,孵育1 h,NTEN裂解液洗涤beads 3遍,加入300 μl含0.2 mg/ml 3x-flag肽段,洗脱 2次,收集洗脱液,超滤浓缩至30 μl体积。
质谱分析将浓缩后的样品进行SDS-PAGE电泳后行考马斯亮蓝染色,切下与对照组有明显差异的条带,送至清华大学生物医学中心做Malti-TOF蛋白质鉴定,得到的肽段序列与NCBI蛋白质数据库对比检索。
免疫共沉淀按照实验设计将带有FLAG标签的Bat3表达质粒和带有Myc标签的Ubl4A表达质粒转染至293T细胞内,48 h后收集细胞,NTEN裂解液裂解细胞,离心后上清液中加入10 μl anti-FLAG beads和10 μl protein-G beads,孵育1 h,用 NTEN洗涤3遍,加入30 μl 1.2×上样缓冲液,制备免疫共沉淀样品。将样品进行SDS-PAGE,用anti-FLAG和anti-Myc抗体进行免疫杂交,检测Bat3与Ubl4A的相互作用。
结 果
慢病毒Bat3表达质粒的构建及鉴定以人293T细胞cDNA为模板,利用所设计的引物扩增人Bat3编码序列,琼脂糖凝胶电泳结果显示,出现大小约为3400 bp的DNA片段。将Bat3片段克隆到改造的plentilox3.7质粒中,转化,PCR鉴定阳性克隆,结果显示扩增出预计的3.4 kb DNA片段 (图1)。进一步测序分析证实Bat3基因序列完全正确。
融合双标签的Bat3表达通过lipofectamine 2000将构建好的Bat3慢病毒表达质粒转染入293T细胞,48 h后行Western blot检测Bat3融合标签的表达情况,结果显示用anti-FLAG与anti-Strep2一抗孵育后,发现在相对分子质量130 000~170 000之间有1个目的条带,与预期的相对分子质量相符 (图2)。
建立稳定表达Bat3的293T细胞系病毒感染293T细胞72 h后,荧光显微镜可观察到绿色荧光的
表达,表达绿色荧光的细胞约为100%(图3)。

图1 PCR扩增Bat3蛋白编码序列及PCR鉴定plenti-Bat3重组质粒Fig 1 PCR amplification of Bat3 protein coding sequence and PCR identification of recombinant plenty-Bat3 plasmids

图2 Western blot检测重组慢病毒plenti-Bat3融合标签FLAG和Strep2的表达Fig 2 Identification of expression of the fused FLAG and Strep2 tag by Western blot analysis

图3 慢病毒感染后293T细胞发绿色荧光Fig 3 293T cells displaying green fluorescence after lentivirus infection
Bat3相互作用蛋白质的分离及鉴定收集5个150 mm培养皿的表达Bat3的293T细胞,分别用anti-Strep2 beads和anti-FLAG beads亲和纯化两次,将所得的样品进行SDS-PAGE及考马斯亮蓝染色,结果显示,与对照组相比,Bat3组有明显差异的条带。将其中箭头所指的差异条带切胶送去清华质谱中心鉴定,所得的肽段序列与NCBI蛋白数据库比对,显示鉴定的蛋白质为Ubl4A(图4)。
免疫共沉淀验证Bat3与Ubl4A相互作用按照实验设计将表达FLAG标签的Bat3质粒和表达Myc标签的Ubl4A质粒转染293T细胞,48 h后加入FLAG beads,制备免疫共沉淀样品。Western blot检测其中FLAG和Myc的表达,结果显示,Bat3与Ubl4A共转组中可检测到Myc表达,而在Bat3和Ubl4A单独转染组中没有检测到Myc表达 (图5)。
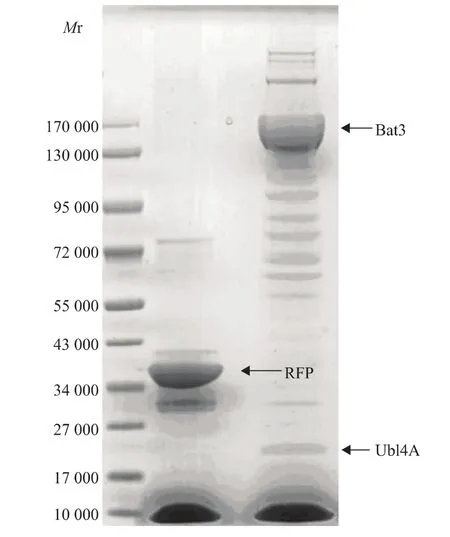
图4 串联亲和纯化后的电泳图Fig 4 SDS-PAGE analysis of TAP products

图5 免疫共沉淀检测Bat3与Ubl4A相互作用Fig 5 Co-immunoprecipitaion detects the interaction between Bat3 and Ubl4A
讨 论
本研究首先在保证读码框正确的前提下,将Bat3蛋白质编码序列与串联的Strep2和FLAG标签序列融合,然后将融合了串联标签的Bat3基因导入到改造的慢病毒表达载体上,通过293T细胞包装产生有活性的慢病毒,以293T细胞为感染对象,获得稳定表达融合双标签Bat3基因的293T细胞系。随后在温和的裂解条件下,经过Strep2 beads和FLAG beads两次亲和纯化,进行SDS-PAGE和考马斯亮蓝染色,得到了与对照组相比清晰的差别条带,经质谱鉴定为Ubl4A分子,最后经免疫共沉淀实验也证实了这种蛋白质-蛋白质相互作用。研究表明,Ubl4A可与Bat3、TRC40形成蛋白质复合物,在尾部锚定膜蛋白的成熟与降解之间发挥关键性作用[6-8]。
与常规的免疫亲和纯化相比,串联亲和纯化通过两步纯化步骤,富集了差异条带,降低了样品中的非特异蛋白质背景,同时由于整个纯化过程都处于类似生理条件下,能够很好的模拟体内状态下的蛋白质相互作用。然而在本研究中,TAP这套系统还是有一些不足。为了获得更加接近于体内的结果,靶蛋白的表达量应该维持或接近于体内正常生理表达水平[9]。Bat3是一个核质穿梭蛋白,在不同生理条件下,Bat3的定位不同。本研究中采用巨细胞病毒启动子驱动Bat3的过表达,CMV是一个十分强大的启动子,促使Bat3蛋白质表达量远远高于体内自然水平。这样,一方面会引起非特异性的蛋白质相互作用,另一方面改变了Bat3的定位,促进了非生理条件下蛋白质相互作用的产生。此外,由于蛋白质之间的相互作用亲和力有强有弱,TAP经过多次漂洗过程,其中亲和力较弱的蛋白质相互作用易在漂洗过程中丢失,不易被扑捉到[10]。为了改进这些问题,本课题组正在尝试腺相关病毒介导的同源重组技术,将Strep2和FLAG双标签导入到细胞的Bat3基因组中,这样就能真正模拟体内的生理条件。同时将细胞用DSS等偶联剂处理,将微弱的蛋白质相互作用固定,大大增加扑捉较弱的相互作用的机会。总之,通过不断的改进,串联亲和纯化技术是一项极具潜力的分离相互作用蛋白质的工具。
[1]Wu YH,Shih SF,Lin JY.Ricin triggers apoptotic morphological changes through caspase-3 cleavage of BAT3 [J].J Biol Chem,2004,279(18):19264-19275.
[2]Desmots F,Russell HR,Lee Y,et al.The reaper-binding protein scythe modulates apoptosis and proliferation during mammalian development[J].Mol Cell Biol,2005,25(23):10329-10337.
[3]Wu W,Song W,Li S,et al.Regulation of apoptosis by Bat3-enhanced YWK-II/APLP2 protein stability [J].J Cell Sci,2012,125(Pt 18):4219-4229.
[4]Rigaut G,Shevchenko A,Rutz B,et al.A generic protein purification method for protein complex characterization and proteome exploration [J].Nat Biotechnol,1999,17(10):1030-1032.
[5]Westermarck J,Ivaska J,Corthals GL.Identification of protein interactions involved in cellular signalling[J].Mol Cell Proteomics,2013,12(7):1752-1763.
[6]Mariappan M,Li X,Stefanovic S,et al.A ribosome-associating factor chaperones tail-anchored membrane proteins[J].Nature,2010,466(7310):1120-1124.
[7]Leznicki P,Clancy A,Schwappach B,et al.Bat3 promotes the membrane integration of tail-anchored proteins[J].J Cell Sci,2010,123(Pt 13):2170-2178.
[8]Hessa T,Sharma A,Mariappan M,et al.Protein targeting and degradation are coupled for elimination of mislocalized proteins[J].Nature,2011,475(7356):394-397.
[9]Li Y.The tandem affinity purification technology:an overview[J].Biotechnol Lett,2011,33(8):1487-1499.
[10]Xu X,Song Y,Li Y,et al.The tandem affinity purification method:an efficient system for protein complex purification and protein interaction identification[J].Protein Expr Purif,2010,72(2):149-156.
Identification of Proteins Interacted with Bat3 Using Tandem Affinity Purification
WU Wei,LI Qin-shan,SONG Wei,MIAO Shi-ying,WANG Lin-fang
National Laboratory of Medical Molecular Biology,Institute of Basic Medical Sciences,CAMS and PUMC,Beijing 100005,China
WANG Lin-fang Tel:010-69156418,E-mail:wang.linfang@imicams.ac.cn
ObjectiveTo identify the specific protein interactions involved in Bat3-mediated apoptosis.MethodsTandem affinity purification(TAP)was utilized to investigate Bat3-protein interactions,during which full-length human Bat3 fused with Strep2 and FLAG tag as a bait was used to screen the specific proteinprotein interactions.The isolated proteins were identified with mass spectrometry.ResultsTAP studies showed that Ubl4A was identified as a Bat3-binding partner.Further investigation using co-immunoprecipitation confirmed that Bat3 was associated with Ubl4A.ConclusionTAP was successfully established and is suitable for isolating the binding partners of Bat3.
Bat3;apoptosis;tandem affinity purification
王琳芳 电话:010-69156418,电子邮件:wang.linfang@imicams.ac.cn
Q-31
A
1000-503X(2014)01-0001-04
10.3881/j.issn.1000-503X.2014.01.001
Acta Acad Med Sin,2014,36(1):1-4
细胞凋亡也称为程序性细胞死亡,在维持机体发育及自身稳态方面可发挥重要作用。细胞凋亡是一个多基因严格调控、高度有序的过程,一旦失控可导致恶性肿瘤、神经退行性病变、自身免疫性疾病等相关疾病。Bat3又名Bag6/Scythe,在细胞凋亡的调控中发挥重要作用[1]。Bat3基因敲除小鼠在胚胎期就已死亡,肺、肝、肾、睾丸等组织明显发育不良,组织切片显示细胞凋亡比例明显增加[2]。目前研究表明,Bat3主要通过与其他蛋白质结合而发挥作用,例如,其可与淀粉前体蛋白样蛋白-2(amyloid precursor-like protein 2,APLP2)相互作用,增加APLP2的表达而拮抗细胞凋亡[3]。然而,由于基因在不同的发育器官、不同的发育阶段存在表达特异性,因此寻找Bat3不同的相互作用蛋白对于深入了解Bat3的生理病理功能具有十分重要的意义。串联亲和纯化是由Rigaut等[4]于1999年建立的,他们通过表达融合两种不同亲和标签分子的靶蛋白,经过两步亲和层析,分离纯化与靶蛋白特异结合的相互作用蛋白质。其优点在于可以模拟体内生理条件,高效、特异地分离蛋白质聚合物。与传统的亲和纯化技术相比,该技术筛选到的相互作用蛋白假阳性率较低,大大降低了后续工作的难度[5]。本研究通过构建串联亲和纯化这个技术平台并结合质谱鉴定技术,分离得到了与Bat3结合的蛋白质,以期为阐述Bat3的生理功能及作用机制提供理论基础。
国家重大研究计划项目 (2011CB944302)和国家重点实验室专项基金 (2060204)Supported by the National Important Research Plan of China(2011CB944302)and the State Key Laboratory Special Fund of China(2060204)
2013-05-17)
