吉非替尼对不同肿瘤患者m iR-21、m iR-155的表达和PI3K/Akt通路的影响
2014-09-19朱剑梅金科
朱剑梅,金科
(四川省医学科学院 四川省人民医院城东病区,血液肿瘤科,四川 成都 610110)
吉非替尼对不同肿瘤患者m iR-21、m iR-155的表达和PI3K/Akt通路的影响
朱剑梅,金科
(四川省医学科学院 四川省人民医院城东病区,血液肿瘤科,四川 成都 610110)
目的 探讨3组不同肿瘤患者血浆中miR-21、miR-155及组织中p-PI3K、p-Akt的表达及吉非替尼干预的影响。方法选取2011年3月~2014年2月在四川省人民医院血液肿瘤科收治的肿瘤患者75例,经病理确诊为食道癌28例(A组),胃癌25例(B组),非小细胞肺癌22例(C组),另选取56例无肿瘤人员作为对照组(分为D1、D2、D3组)。采用RT-PCR和Western blot检测吉非替尼干预前后患者血清及组织中miR-21、miR-155、p-PI3K、p-Akt的表达情况。结果 RT-PCR结果显示:与对照组相比,胃癌及非小细胞肺癌患者血浆中miR-21、miR-155表达明显升高(P<0.01),食道癌患者血浆miR-155表达明显升高(P<0.01),但miR-21表达无差异;采用吉非替尼干预后,胃癌及非小细胞肺癌患者血浆中miR-21、miR-155表达明显下降,差异有统计学意义(P<0.05),食道癌患者血浆中miR-155明显升高(P<0.05),miR-21表达无明显变化。Western blot结果显示:食道癌及胃癌患者组织中p-Akt的表达量明显高于对照组(P<0.01),但非小细胞肺癌患者组织中p-Akt的表达量与对照组相比差异无统计学意义;胃癌、非小细胞肺癌患者组织中p-PI3K的表达量明显高于对照组(P<0.05,P<0.01),但食道癌患者组织中p-PI3K的表达量与对照组相比差异无统计学意义。结论 miR-21、miR-155在3种不同肿瘤患者血浆中均呈高表达,吉非替尼干预后,能明显降低3种癌症细胞患者血浆中miR-21、miR-155 的表达。
miR-21;miR-155;吉非替尼;PI3K/Akt通路;胃癌;食道癌;非小细胞肺癌
微小RNA(microRNA)是一类非编码RNA,长度约为18~25个核苷酸,在RNA的降解以及蛋白抑制方面有着非常重要的作用,microRNA存在于大多数真核生物细胞中,参与细胞的分化、增殖以及凋亡等过程,目前作为肿瘤标志物而被广泛研究。多项研究显示microRNA对于肿瘤的发生发展起着非常重要的作用[1-3]。近年来,食道癌、胃癌及非小细胞肺癌在全球范围内的发病率均有所升高,胃癌的死亡率排在第四位。研究证实microRNA可以在外周血中稳定存在[4]。近年来使用抗肿瘤药物后产生的耐药性是研究的焦点,其中miR-21、miR-155也参与了抗肿瘤药物的耐药性[5-6]。目前,研究显示microRNA可以通过PI3K/Akt信号通路影响癌症细胞的侵袭,蛋白质的合成以及细胞周期等等,microRNA与Akt信号通路构成一个AktmicroRNA的调控网络,共同完成调控细胞的生长,国内外学者证实miR-126、miR-451以及miR-145等微小RNA都与PI3K/Akt通路有关[7-9],但是肿瘤患者在使用抗肿瘤药物初期体内miR-21、miR-155表达如何鲜见报道,此外使用抗肿瘤药物后对microRNA介导的下游通路影响如何,报道也较少,本研究旨在探讨抗肿瘤药物对肿瘤患者体内miR-21、miR-155的影响,进而探讨抗肿瘤药物出现耐药的原因,为临床解决抗肿瘤药物耐药性提供一定的基础理论依据。
1 资料与方法
1.1 一般资料 选取2011年3月~2014年2月四川省人民医院血液肿瘤科收治的肿瘤患者75例,经病理确诊为食道癌28例(A组),其中男性患者16例、女性12例,平均年龄为(58.6±6.8)岁;胃癌25例(B组),其中男性患者13例、女性12例,平均年龄为(62.7±6.5)岁;非小细胞肺癌22例(C组),其中男性患者10例、女性12,平均年龄为(65.6±7.1)岁。另再选取56例无肿瘤人员作为对照组,其中18例因胃部疾病需要切除部分组织(D1组)、20例因肺部疾病需要切除部分组织(D2组)、18例为食道疾病患者(D3组)且切除部分食道组织。本实验所有患者在入选时均签订知情同意书,并经医院医学伦理委员会批准。各组患者在性别、年龄方面差异无统计学意义。
1.2 主要试剂及仪器 RNA提取物试剂盒购于美国ABI公司,反转录试剂盒购于美国LC Science公司;实时荧光定量PCR试剂盒购自大连宝生物有限公司,抗体鼠抗人p-Akt、Akt购于 Bioworlde公司,PI3K以及 p-PI3K均购于 Santa Cruz公司。
7902HT荧光定量PCR仪购于美国ABI公司,-80℃超低温冰箱购于美国Beckman公司,蛋白定量酶标仪及垂直电泳仪购于美国BioRad公司。
1.3 方法
1.3.1 标本采集:75例癌症患者均经癌症切除手术后采用TP方案治疗4周期:第一天静脉滴注多西他赛75mg/m2,第一天~第三天静脉滴注顺铂25mg/m2,每个周期持续21 d;同时每天给予吉非替尼(英国阿斯利康公司)250 mg口服。取所有手术患者术后新鲜组织,并迅速置于液氮中,在-80℃中保存备用。所有实验患者在TP方案治疗前1天早晨及治疗4周后在体检中心于肘静脉采血5 mL,置于真空EDTA-K2抗凝管中,1000 r/min离心获取血小板丰富的血浆,接着以1800 r/min离心7min从而获取血小板贫瘠血浆。3组不同肿瘤患者按照药物干预前后将血浆分为:药物干预前为A1、B1、C1;药物干预后为A2、B2、C2,对照组采用的是2次取血的均值,用D1、D2、D3表示。
1.3.2 血浆RNA提取:取各组患者500μL血小板贫瘠血浆,置于1.5mL EP管中,加入20μL的Proteinase K进行消化,按照Trizol LS试剂盒说明书进行后续操作,使用NanoDrop 1000检测血浆中总RNA的纯度,当比值在1.8~2.0之间时表明纯度较好。
1.3.3 RT-PCRP:配置逆转录反应体系:无RNA酶双蒸水14.75μL,0.5μLRNase抑制剂,1μL逆转录酶。将100 ng总RNA、2μL RT引物以及5μL Buffer加入到上述反应体系中,43℃50min,95℃,5min进行逆转录反应。取逆转录产物上游引物以及下游引物各1μL、12.5μL 2×Master Mix,补充双蒸水至25μL。95℃预变性5min,95℃变性25 s,50℃退火30 s,70℃延伸40 s,35个循环,72℃后延伸5min。RT引物以及PCR引物,其中miR-21基因正向引物5'-TAGCTTATCAGACTGATG-3',反向引物为5'-TGGTGTCGTGGAGTCG-3';miR-155基因正向引物5'-CAAGTTTTGTTGGTTGGTTT-3',反向引物为 5'-GGCAAGGCATTATGTGATAC-3';U6的正向引物5'-CGTGCAGAGGCCATCGCAGAAGACAT-3',反向引物为5'-CACTTCTCAACCAAAATTCTTCAAAG-3',购于广州锐博生物有限公司。记录各个反应管中的荧光信号所设立的阈值时循环数(CT值),将原始数据取3次以上重复扫描后取平均值,以U6作为内参进行归一,计算 miR-21、miR-155相对表达情况。
1.3.4 Western blot:取各实验组患者组织100 mg,直接加入200μL细胞裂解液及15μL PMSF进行匀浆,将匀浆后的液体置于冰上裂解30 m in,4℃下以12000 r/m in离心30 min,去上清,经考马斯亮蓝法经行定量。蛋白质样品同1/4倍量5×SDS上样缓冲液混合均匀,热水煮沸7~8 min,在10%SDS-PAGE 115 V进行电泳,200 mA恒流2 h,湿转至硝酸纤维膜上,再以5%脱脂奶粉TBST缓冲液室温封闭3 h,加一抗(即抗体鼠抗人 p-Akt、Akt以及 PI3K以及 p-PI3K,按照1∶500进行稀释)。TBST洗膜3次,每次10min,然后与结合有辣根过氧化物酶标记的山羊抗小鼠IgG(1∶4000稀释)室温孵育1 h,TBS洗膜3次,每次10min,与化学发光剂ECL反应,X线胶片曝光显影。组织中 p-Akt、Akt以及 PI3K以及p-PI3K蛋白含量的测定采用的是灰度值扫描,通过与β-actin进行比较得出灰度值比。
1.4 统计学方法 分别采用SPSS17.0及ImageJ 4.2对数据及图片进行分析处理。正态计量资料用“±s”表示,组间比较采用t检验;组间对比采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 吉非替尼干预前各组患者血浆中miR-21、miR-155表达比较 RT-PCR结果表明:吉非替尼干预前,胃癌(B1)以及非小细胞肺癌患者(C1)组织中 miR-21、miR-155表达较对照组(D2,D3)明显升高,差异有统计学意义(P<0.01);食道癌组患者(A1)miR-155表达较对照组(D1)明显升高(P<0.01),miR-21表达相对于对照组差异无统计学意义(见图1)。
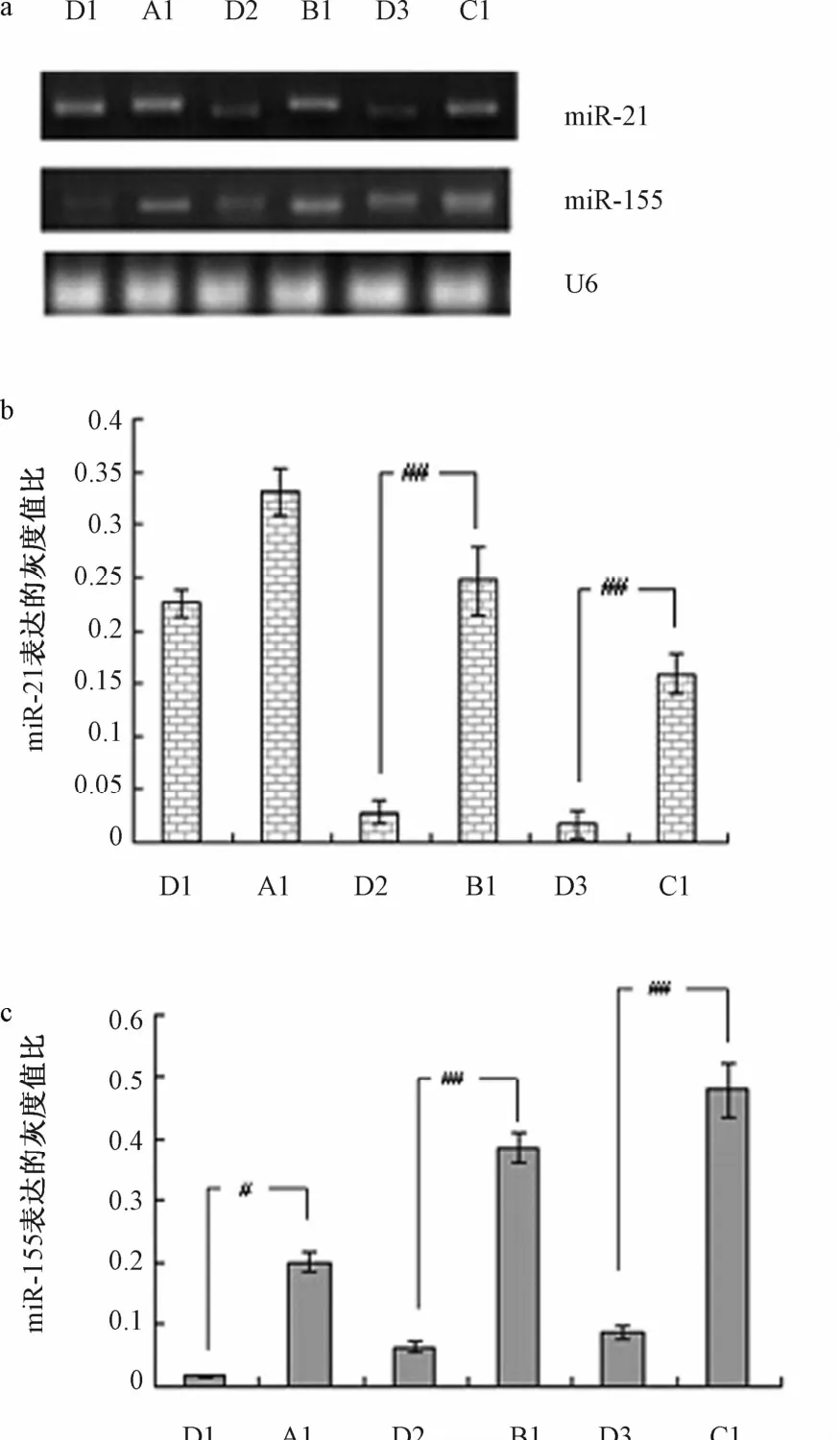
图1 吉非替尼干预前各组患者血浆miR-21、miR-155表达比较Fig.1 Comparison ofmiR-21,miR-155 expression in each group before gefitinib intervention
2.2 吉非替尼干预后各组患者血浆miR-21、miR-155表达比较 吉非替尼药物干预后,胃癌及非小细胞肺癌患者血浆中miR-21、miR-155表达与干预前相比均有所下降,差异有统计学意义(P<0.05);但食道癌组患者血浆中miR-155与干预前相比明显升高(P<0.05),miR-21表达无明显变化(见图2)。
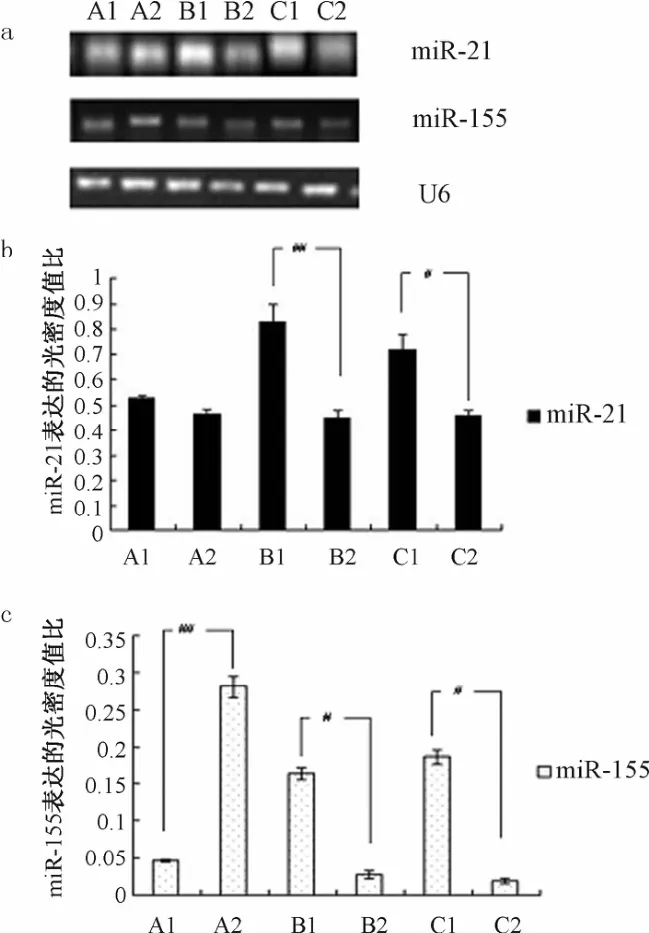
图2 吉非替尼干预后各组患者血浆miR-21、miR-155表达比较Fig.2 Comparison ofmiR-21,miR-155 expression in each group after gefitinib intervention
2.3 各组患者组织p-PI3K、p-Akt蛋白表达比较 Western blot结果显示:与对照组相比,食道癌(A1)及胃癌(B1)患者组织中p-Akt呈高表达(P<0.01),非小细胞肺癌(C1)患者组织中p-Akt无明显差异;胃癌、非小细胞肺癌患者组织中p-PI3K呈高表达(P<0.05,P<0.01),食道癌患者组织中p-PI3K无明显差异(见图3)。

图3 各组患者组织p-PI3K、p-Akt表达比较Fig.3 Comparison of p-PI3K,p-Akt expression in each group of patient organizations
3 讨论
微小RNA参与调控细胞周期以及分化等基本生理功能,目前的研究证实该类小分子并不由血细胞产生,且其在外周血中不受酸性、碱性甚至高温的影响[10]。通过RNA分子表达谱发现,miR-21、miR-155是目前在肿瘤的发生发展过程中被研究的较为成熟的小分子RNA。研究证实这2种小分子RNA在肿瘤患者血清中表达异常增高[11],而随着miR-21、miR-155表达的增高,患者癌症组织周围血管新生也较为明显[12]。有研究显示,高表达miR-21、miR-155可以不同程度的增加患者组织或者血清中血管内皮生长因子以及碱性成纤维生长因子的含量,而促进这一作用的可能途径有ERK或者PI3K/Akt信号途径[13-15]。本研究通过采集癌症患者手术后新鲜组织进行western blot检测,发现在miR-21及miR-155高表达的同时,患者组织中p-PI3K、p-Akt等蛋白表达也异常增加。PI3K是Akt上游信号分子,其强表达可以刺激p-Akt,但在本研究中非小细胞肺癌患者p-PI3K、p-Akt蛋白表达与对照组相比差异无统计学意义,可能是样本量小的缘故。
近几年来本院就诊胃肠疾病的患者同既往相比多了近3倍左右,而胃癌以及食道癌患者多了近1倍左右[16]。根据相关部门的统计发现,每年全球将近30万人死于食道癌,而肺癌已是全球死亡率最高的疾病[17-19]。本研究结果显示,胃癌患者相对于食道癌以及非小细胞肺癌患者血浆中miR-21、miR-155的表达略微要高一些,此外胃癌患者组织中血管新生因子表达也强于食道癌和非小细胞肺癌患者。
试验中有出现与预期较为较为相反的结果。非小细胞肺癌是3种肿瘤当中发病最为凶险的,但是miR-21、miR-155表达却在3者之中不算最高。且经过吉非替尼治疗后短期内其表达出现下降的趋势。本研究没有验证药物干预后患者体内p-PI3K、p-Akt等蛋白表达情况,主要原因是不能很好获得同一患者的组织。后期预从血浆中分离单核细胞或者泡沫细胞进行检测。
以往研究并未探讨微小RNA在癌症组织的表达,以及其对于癌症患者体内其他相关因子的影响。有学者研究抗肿瘤药物的耐药性与微小RNA的相关性,发现某些抗肿瘤药物的耐药性与某些微小RNA的高表达相关[15],而体外采用微小RNA抑制剂后,肿瘤增殖能力下降或者某些蛋白表达有所改善。较少有学者研究抗肿瘤药物是不是对所有微小RNA均无作用,还是使用到一定阶段后才产生的耐药性。本研究发现:吉非替尼可以抑制胃癌以及非小细胞肺癌患者血浆中miR-21、miR-155,而对食道癌中的作用较小,这一结果一定程度上反映了抗肿瘤药物出现的耐药性与miR-21、miR-155高表达是在使用之后出现的。值得提出的是,后期尚需要做随访及时检测miR-21、miR-155与患者生存率的相关性,以及抗肿瘤药物在什么时间段出现的耐药性以及此时miR-21、miR-155的表达情况。
综上所述,miR-21、miR-155在3种不同肿瘤患者血浆均呈明显的升高趋势,吉非替尼干预后3种癌症患者血浆中miR-21、miR-155均有不同程度的降低。
[1] lorio MV,Croce CM.MicroRNA dysregulation in cancer:diagnostics,monitoring and therapeutics.A comprehensive review[J].EMBO Mol Med,2012,4(3):143-159.
[2] Lee JH,Voortman J,Dingemans AM,et al.MicroRNA expression and clinical outcome of small cell lung cancer[J].PLOSONE,2011,6(6):e21300.
[3] Flynt AS, Lai EC.Biological principles of microRNA-mediated regulation:shared themes amid diversity[J].Nat Rev Genet,2008,9(11):831-842.
[4] Bal H,Xu R,Cao Z,et al.Involvement of miR-21 in resistance to daunorubicin by regulating PTEN expression in the leukaemia K562 cell line[J].FEBS Lett,2011,585(2):402-408.
[5] Li X,Zhang Y,Ding J,et al.Survival prediction of gastric cancer by a seven-microRNA signature[J].Gut,2010,59(5):579-585.
[6] 秦安东,周涯,盛美霞,等.MicroRNA-155对人肺癌95D细胞生长的影响[J].中国肺癌杂志,2011,14(7):575-580.
[7] Rao E,Jiang C,Ji M,et al.The miRNA-17 ~92 cluster mediates chemoresistance and enhances tumor growth inmantle cell lymphoma via PI3K/AKT pathway activation [J].Leukemia,2012,26 (5):1064-1072.
[8] Tian Y,Nan Y,Han L,et al.MicroRNA miR-451 downregulates the PI3K/AKT pathway through CAB39 in human glioma[J].Int JOncol,2012,40(4):1105-1112.
[9] Noguchi S,Yasui Y, Iwasaki J, et al.Replacement treatment with microRNA-143 and-145 induces synergistic inhibition of the growth of human bladder cancer cells by regulating PI3K/Akt and MAPK signaling pathways[J].Cancer Lett,2013,328(2):353-361.
[10] Tsukamoto Y, Nakada C, Noguchi T, et al.MicroRNA-375 is downregulated in gastric carcinomas and regulates cell survival by targeting PDK1 and 14-3-3zeta[J].Cancer Res,2010,70 (6):2339-2349.
[11] Greither T,Grochola LF,Udelnow A,et al.Elevated expression of microRNAs155,203,210 and 222 in pancreatic tumors is associated with poorer survival[J].Int JCancer,2010,126(1):73-80.
[12] Jiang S,Zhang HW,Lu MH,et al.MicroRNA-155 functions as an OncomiR in breast cancer by targeting the suppressor of cytokine signaling 1 gene[J].Cancer Res,2010,70(8):3119-3127.
[13] Zheng SR,Guo GL,Zhang W,et al.Clinical significance of miR-155 expression in breast cancer and effects ofmiR-155 ASO on cell viability and apoptosis[J].Oncol Rep,2012,27(4):1149-1155.
[14] Jiang S,Zhang HW,Lu MH,et al.MicroRNA-155 functions as an OncomiR in breast cancer by targeting the suppressor of cytokine signaling 1 gene[J].Cancer Res,2010,70(8):3119-3127.
[15] 葛甜甜,梁勇,付蓉,等.淋巴瘤患者血浆中 miR-21、miR-155、miR-210的表达及临床意义[J].中国实验血液学杂志,2012,20(2):305-309.
[16]徐登诚,刘宝瑞,沈洁.胃癌组织和循环miR-21与胃癌伊立替康敏感性关系的初步研究[J].中国癌症杂志,2013,23(9):744-750.
[17]杨晓辉,葛箭,蔡慧珍,等.回族人群饮食习惯与胃癌发生的相关性研究[J].现代预防医学,2012,39(11):2674-2677.
[18] Tsujiura M,Ichikawa D,Komatsu S,et al.Circulating microRNAs in plasma of patientswith gastric cancers[J].Br JCancer,2010,102(7):1174-1179.
[19] Huang Z,Huang D,Ni S,et al.PlasmamicroRNAs are promising novel biomarkers for early detection of colorectal cancer[J].Int J Cancer,2010,127(1):118-126.
(编校:吴茜)
Effect of gefitinib on m iR-21,m iR-155 expression and PI3K/Akt pathway in patients w ith three different tumor
ZHU Jian-mei,JIN Ke
(Department of Hematology and Oncology,East Department of Sichuan Academy of Medical Sciences&Sichuan Provincal People'Hospital,Chengdu 610110,China)
Objective To investigate themiR-21,miR-155 in three different tumor patients plasma and the expression of p-PI3K、p-Akt in tissue,then to study the intervention by gefitinib.Methods 75 cases patientswith cancerwere selected and treated in the Sichuan Provincial People's Hospital from March 2011 to February 2014,28 cases ofesophagus cancer(A group),25 cases ofgastric carcinoma(group B),22 cases of nonsmall-cell lung cancer(C group),the other 56 cases as control group(no tumor personnel divided into D1 D2,3,D group),the serum and tissue of patients with Western blot and RT-PCR detection in p-PI3K,p-Akt and miR-21,miR-155 expression,and the results were statistically analyzed.Results Western blot results showed that:the expression of p-Akt in esophageal and gastric carcinoma patients was significantly higher,the difference was statistically significant(P<0.01),while expression of p-Akt of non-small cell lung cancer tissue compared with control group was no significant difference;expression of p-PI3K in gastric cancer,non-small cell lung cancer tissuewas higher,the difference was statistically significant(P<0.05,P<0.01);tissue expression levels of p-PI3K in patients with esophageal cancer were compared with the control group,and the difference was not statistically significant.Compared with the control group,miR-21,miR-155 expression in plasma of gastric cancer and non-small cell lung cancer were higher,the difference was statistically significant(P<0.01),plasma miR-155 expression in patients with esophageal cancer were higher than control group(P<0.01),but no differences in the expression ofmiR-21;after using gefitinib to intervene,miR-21,miR-155 expression in plasma of gastric cancer and non-small cell lung cancer was significantly decreased,and the difference was statistically significant(P<0.05),plasma miR-155 in patients with esophageal cancer was significantly higher(P<0.05),miR-21 expression did not change.Conclusion miR-21,miR-155 are highly expressed in three different patientswith cancer,while gefitinib after intervention for patientswith gastric cancer and non-small cell lung cancer effect is better,but for the intervention of esophagus cancer patientswith somewhat less effect.
miR-21;miR-155;gefitinib;gastric cancer;esophagus cancer;nonsmall-cell lung cancer
朱剑梅,本科,主治医师,研究方向:肿瘤的化疗及姑息治疗,E-mail:zhujianmei@2008.sina.com。
R733.1
A
1005-1678(2014)06-0153-05
