功能化离子液体对2-苯乙醇萃取性能研究
2014-09-18邹双双李长平尹静梅
邹双双,李长平*,尹静梅*
(大连大学 环境和化学工程学院,辽宁 大连 116622)
2-苯乙醇(2-PEA)是一种具有玫瑰花香的芳香醇,它在康乃馨、玫瑰、天竺葵及矮牵牛花等花类中普遍存在。它广泛应用于化妆品、糖果、蛋糕及饮料等工业产品中[1]。同时,2-苯乙醇也常作为中间体,用以合成苯乙醛[2]和羟基酪醇[3]等物质。目前,大多采用生物转化法合成 2-苯乙醇,此方法生产的 2-苯乙醇属于天然产品,可以取代从玫瑰或其它植物精油中提取的天然 2-苯乙醇,克服了化学合成法生产 2-苯乙醇中存在的诸多不足,如产品纯度低、合成过程污染大等。因此,具有广阔的开发前景[4-5]。然而,生物转化过程中,2-苯乙醇的原位分离还面临诸多挑战。同时,传统有机萃取剂一方面无法有效的实现2-苯乙醇提取分离,另一方面,对微生物又具有很强的抑制作用。因此,2-苯乙醇高效、绿色萃取剂的研发已成为亟待解决的科学问题。
离子液体(ILs)是完全由离子组成的在室温或近室温下呈液态的盐[6-7]。离子液体具有很多优异的物理化学性质,如较好的化学稳定性、热稳定性、蒸汽压低、可设计性和可循环使用等。近年来,离子液体作为一种“绿色”溶剂,在有机合成[8],化学催化[9],电化学[10],生物催化[11]和萃取分离[12-15]等领域受到了广泛的关注。尤其是对很多有机物都具有很好的溶解特性。因此,离子液体在萃取分离过程中收到广泛的关注。
本论文设计、合成功能化离子液体和常规离子液体,在此基础上,对2-苯乙醇的萃取过程进行了系统研究。合成了功能化离子液体 1-N,N-二乙基乙酰胺基-3-乙基咪唑双三氟甲基磺酰亚胺盐([EDCmim]NTf2),以及常规离子液体 1-丁基-3-甲基咪唑六氟磷酸盐([BMIM]PF6),采用模拟富含2-苯乙醇的水相体系,系统研究初始浓度,萃取时间,旋转速度,相比和系统温度等主要影响因素对2-苯乙醇萃取过程的影响。同时,对离子液体多次使用进行了研究。本研究为2-苯乙醇的原位分离提供了新方法和新工艺。
1 实验
1.1 主要仪器和试剂
仪器:恒温循环槽,上海一恒科学仪器有限公司;HANGPING FA110电子天平,上海天平仪器厂;756MC紫外可见分光光度计,上海菁华科技仪器有限公司。
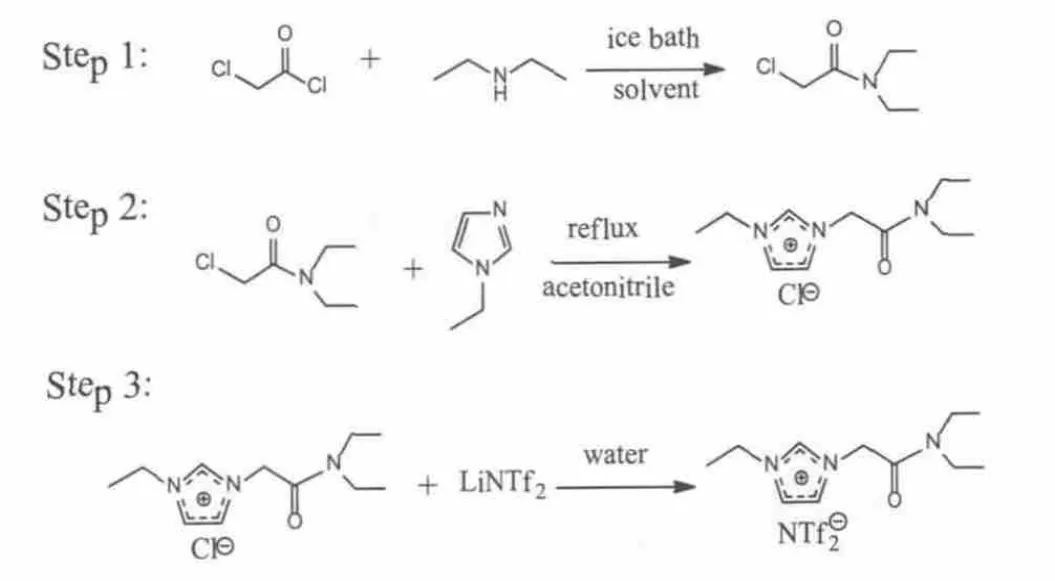
图1 功能化离子液体[EDCmim]NTf2的合成路线
试剂:2-苯乙醇:化学纯98%;双三氟甲烷磺酰亚胺锂(LiNTf2)、二乙胺、1,2-二氯乙烷、乙基咪唑、乙腈、乙酸乙酯、氢氧化钠、碳酸氢钠:分析纯;氯乙酰氯:化学纯;实验中用水为去离子水。
1.2 离子液体的合成与表征
[EDCmim]NTf2在文献[14,16]的基础上进行了改进,合成路线如图1所示。在500 mL三口烧瓶中分别加入0.5 mol二乙胺,150 mL 1,2-二氯乙烷和100 ml ω(NaOH)=20%的水溶液,冰浴搅拌下以每3秒1滴的速度滴加0.5 mol氯乙酰氯。滴加完成后,室温搅拌2 h,静置分层,水层用1,2-二氯乙烷萃取3次,合并有机层。有机层用 ω(NaHCO3)=5%的水溶液以及蒸馏水洗涤至中性,无水硫酸镁干燥,过滤,再旋蒸脱除1,2-二氯乙烷,真空干燥,得浅黄色液体N,N-二乙基氯乙酰胺。
将0.4 mol乙基咪唑溶于80 mL乙腈,再滴加0.4 mol N,N-二乙基氯乙酰胺, 75℃回流48 h后,蒸馏脱除乙腈,乙酸乙酯洗三次,真空干燥,得到化合物[EDCmim]Cl。
将0.3 mol[EDCmim]Cl用50 ml蒸馏水溶解后,加入0.3 mol LiNTf2,常温下搅拌24 h,静置分层,有机层用蒸馏水洗涤三遍,再在80 ℃真空干燥12 h,得到化合物[EDCmim]NTf2。通过1HNMR表征和分析,确定了目标产物。
1.3 萃取实验
2-苯乙醇浓度由紫外分光光度计在256 nm波长下,采用标准曲线法进行测定。离子液体与苯乙醇溶液按一定的比例混合,实验在茄形瓶中进行。该体系在磁力搅拌器下搅拌。搅拌一定时间后,两相分离。除另行定义,大多数实验在初始浓度为 10000 ppm,相比为 1:4(离子液体体积/2-苯乙醇体积),25 ℃,1000 rpm条件下搅拌30 min。本研究中所有因素均进行两次平行试验,其实验误差在3%以内。

E代表萃取率,Ci代表溶液的初始浓度,Cf代表溶液的最终浓度。
2-苯乙醇溶液的萃取率的计算公式:
2 结果与讨论
2.1 萃取时间对2-苯乙醇萃取影响
由图2可知,随着时间的增加,[EDCmim]NTf2对2-苯乙醇的萃取效率也随之升高,30 min后可达到萃取平衡。[BMIM]PF6的平衡时间较短,10 min即达到萃取平衡,与[EDCmim]NTf2相比,其平衡时间大幅缩短,可能原因在于,离子液体的功能化,使其粘度有所增加,因此降低了萃取过程中的传质速度,使萃取平衡时间增加。而酰胺功能化离子液体的萃取效率则高于常规离子液体,可能原因在于:酰胺基团的引入,功能化离子液体对苯乙醇萃取过程中,一方面如常规离子液体和有机溶剂萃取过程一样,存在着物理萃取过程,同时,功能化离子液体中酰氨基团与2-苯乙醇之间发生氢键作用,从而使萃取率提高。
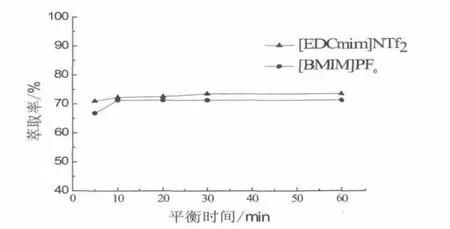
图2 萃取时间对萃取过程影响
2.2 转速对2-苯乙醇萃取影响
由图3可知,随着转速的增加,2-苯乙醇的萃取率没有明显变化,转速对两种离子液体萃取效果没有显著影响。因此,为其应用于2-苯乙醇的原位萃取工艺的简化提供了有利条件。同时,功能化的离子液体[EDCmim]NTf2在相同转速下,对2-苯乙醇的萃取率高于传统离子液体[BMIM]PF6。
2.3 初始浓度对2-苯乙醇萃取影响
初始浓度对萃取效果的影响如图4所示。随着初始浓度的升高,2-苯乙醇的萃取率逐渐上升。当初始浓度为2000 ppm时,[BMIM]PF6对2-苯乙醇的萃取效率高于[EDCmim]NTf2;而当初始浓度大于 4000 ppm时,[EDCmim]NTf2的萃取率则高于[BMIM]PF6。由于2-苯乙醇生物萃取制备过程中,高浓度对反应的抑制作用更强,同时,两种离子液体对2-苯乙醇的萃取率最高,因此,整个实验过程中,10000 ppm作为初始浓度。
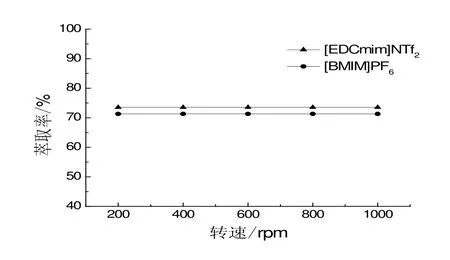
图3 转速对萃取过程影响
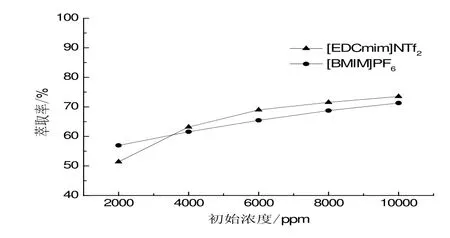
图4 初始浓度对萃取效率影响
2.4 温度对2-苯乙醇萃取影响
温度是影响萃取过程的重要因素。研究结果表明,随着温度的升高,2-苯乙醇的萃取率随之下降(如图5所示)。由此可见,与大多数有机物萃取过程一样,2-苯乙醇的萃取过程也是一个放热过程。因此,其可在常温下实现高效萃取过程,有利于2-苯乙醇的原位高效提取,有利于其进一步的实际应用。
2.5 相比对2-苯乙醇萃取影响
由图6可知,随相比的增加,2-苯乙醇的萃取率随之增大。当相比为 1:2时,[EDCmim]NTf2和[BMIM]PF6的萃取率可达80%以上。而当相比是1:10时其萃取率已下降到50%以下。虽然,相比较大可以达到较高的萃取效率。但是,萃取过程中也要消耗大量的离子液体,使萃取过程成本增加,因此,综合萃取效率和成本,本研究均采用相比1:4。
2.6 离子液体的多次使用
离子液体萃取完成后,是否可以继续使用是衡量离子液体是否饱和的重要指标。因此对其多次使用进行了系统研究。由图7可以看出,随着离子液体使用次数的增加,2-苯乙醇的萃取率逐渐降低。原因在于:随着离子液体使用次数增加,离子液体逐渐饱和,萃取效率逐渐减低。三次萃取后,两种离子液体[BMIM]PF6和[EDCmim]NTf2的萃取率均降到40%以下。
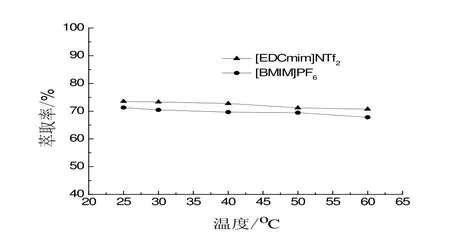
图5 温度对萃取效率影响

图6 相比对萃取效率影响
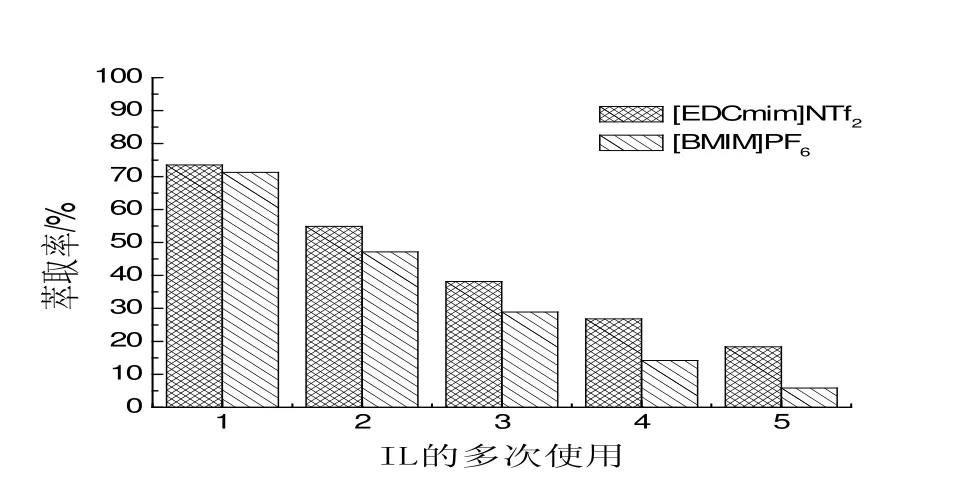
图7 离子液体多次使用对萃取效率影响
3 结论
总之,与传统离子液体[BMIM]PF6相比,酰胺功能化离子液体[EDCmim]NTf2对2-苯乙醇具有更高的萃取效率,最优条件下,萃取率可达到 81.48%。萃取平衡时间较短,30 min均可达到萃取。2-苯乙醇的萃取不受转速的影响。随着初始浓度的升高,2-苯乙醇的萃取率逐渐上升。随着温度的升高,萃取效率随之降低,因此2-苯乙醇萃取过程是一个放热过程。随着相比越大,萃取率随之升高。随着离子液体使用次数的增加,2-苯乙醇的萃取率也逐渐降低。
[1]Etschmann M M, Bluemke W, Sell D, et al. Biotechnological production of 2-phenylethanol [J]. Applied Microbiology and Biotechnology, 2002, 59(1): 1-8.
[2]Celik D, Bayraktar E, Mehmetoglu U. Biotransformation of 2-phenylethanol to phenylacetaldehyde in a two-phase fedbatch system [J]. Biochemical Engineering Journal, 2004,17(1): 5-13.
[3]Brouk M, Fishman A. Protein engineering of toluene monooxygenases for synthesis of hydroxytyrosol [J]. Food Chemistry, 2009, 116(1): 114-121.
[4]梅建凤, 陈虹. 生物转化法生产 β-苯乙醇[J]. 微生物学通报, 2005, 32(2): 114-118.
[5]Schrader J, Etschmann M M, Sell D, et al. Applied biocatalysis for the synthesis of natural flavor compoundscurrent industrial processes and future prospects [J].Biotechnoloy Letters, 2004, 26(6): 463-472.
[6]Rogers R D, Seddon K R. Ionic liquids-solvents of the future[J]. Science, 2003, 302(5646): 792-793.
[7]Weingartner H. Understanding ionic liquids at molecular level:facts, problems, and controversies [J]. Angewandte Chemie International Edition, 2008, 47(4): 654 -670.
[8]Subbiah S, Cheng C I, Chu Y H. Ionic liquids for green organic synthesis [J]. Current Organic Synthesis, 2012, 9(1):74-95.
[9]Zhang Q H, Zhang S G, Deng Y Q. Recent advances in ionic liquid catalysis [J]. Green Chemistry, 2011, 13(10): 2619-2637.
[10]Aal A A, Voigts F, Chakarov D, et al. Electrodeposition of selenium from 1- butyl-1-methylpyrrolidinium trifluoromethylsulfonate [J]. Electrochimica Acta, 2012, 59(1): 228-236.
[11]Van Rantwijk F, Sheldon R A. Biocatalysis in ionic liquids[J]. Chemical Reviews, 2007, 107(6): 2757-2785.
[12]Cao Y F, Xing H B, et al. High performance separation of sparingly aqua-/lipo- soluble bioactive compounds with a ionic liquid-based biphasic system [J]. Green Chemistry,2012, 14(9): 2617-2625.
[13]Han X X, Armstrong D W. Ionic liquids in separation [J].Accounts of Chemical Research, 2007, 40(11): 1079-1086.
[14]Li H X, Li Z, Yin J M, et al. Liquid-liquid extraction process of amino acids by a new amide-based functionalized ionic liquid [J]. Green Chemistry, 2012, 14(6): 1721-1727.
[15]Petkovic M, Seddon K R, Rebeloa L P N, et al. Ionic liquids:a pathway to environmental acceptability [J]. Chemical Society Reviews, 2011, 40(3): 1383- 1403.
[16]王剑, 李长平, 尹静梅, 等. 基于功能化离子液体的苯丙氨酸双水相萃取性能研究[J]. 河南师范大学学报, 2012,40(3): 73-76.
