Gal-3与急性心肌梗死后心功能的相关性及瑞舒伐他汀的干预作用
2014-09-18李兆欣翟朝晖李耀民郭园园李臣文
李兆欣 翟朝晖 李耀民 郭园园 李臣文
急性心肌梗死(AMI)是引起慢性心力衰竭的重要原因。心肌梗死后梗死区域和非梗死区域均会发生炎症反应和纤维化,这些变化会恶化心室重构和心功能不全[1]。半乳糖凝集素-3(Galectin-3,Gal-3)是心力衰竭的新生标志物,在心室重构及心力衰竭的病理生理过程中起着重要作用[2]。研究发现血液中Gal-3的水平与心力衰竭的发生率、心室重构的发生发展呈正相关[3-4]。本研究通过测定AMI患者Gal-3、血浆脑钠肽前体(NT-proBNP)、左室射血分数(LVEF)的变化,来探讨Gal-3与AMI后心功能的相关性及瑞舒伐他汀的干预作用。
1 资料与方法
1.1 一般资料 选择2012年1月-2013年12月在本院急诊科住院治疗的急性ST段抬高型心肌梗死患者共60例,所有患者发病均在12 h内。将所有患者随机分为A组、B组,患者均接受急诊PCI术,两组患者在性别、年龄、发病时间、梗死相关动脉及部位、心功能分级、D-B时间、伴随疾病及用药等方面比较差异均无统计学意义(P>0.05)。所有入选患者均签署试验知情同意书并均符合2010年中华医学会心血管病学分会制定的《急性心肌梗死诊断和治疗指南》中STEMI诊断标准。纳入标准:(1)符合AMI的诊断标准;(2)符合AMI急诊PCI的标准。排除标准:(1)脑出血、感染性疾病及免疫性疾病;(2)明显肝肾功能不全;(3)凝血功能异常、对抗凝及他汀药物治疗存在过敏体质及明显禁忌;(4)严重的心脏瓣膜病变及严重的先天性心脏病;(5)严重心律失常、心源性休克、血容量不足;(6)1个月内服用过抗炎药和降血脂药。试验剔除标准:服药期间出现肌痛同时肌酸激酶≥正常高限5倍、天门冬酸氨基转移酶≥正常高限3倍等严重不良反应时需停药。
1.2 方法 所有患者入院后接受急诊PCI治疗,术前口服负荷剂量阿司匹林及氯吡格雷,术后口服阿司匹林肠溶片、氯吡格雷、β受体阻滞剂、血管紧张素转换酶抑制剂/血管紧张素Ⅱ受体拮抗剂,皮下注射依诺肝素等药物。A组口服瑞舒伐他汀10 mg,qn,B组口服瑞舒伐他汀20 mg,qn。
所有患者入院后在PCI术前、治疗后第1周、4周抽取肘静脉血,检测Gal-3、NT-proBNP水平。入院24 h、1周、4周由同一超声科医师采用同一台彩色多普勒超声诊断仪测定左室射血分数(LVEF)。
1.3 统计学处理 采用SPSS 16.0统计软件包处理,计量资料以(±s)表示,组间比较、组内比较采用单因素方差分析,计数资料采用 字2检验,相关分析采用直线相关,P<0.05为差异有统计学意义。
2 结果
2.1 治疗前后两组患者Gal-3水平比较 两组患者入院时Gal-3水平差异无统计学意义(P>0.05);两组患者治疗后1周Gal-3水平较PCI术前明显升高(P<0.05),两组间比较差异无统计学意义(P>0.05);治疗后4周Gal-3水平较治疗后1周降低,B组降低更明显(P<0.05)。见表1。
2.2 治疗前后两组患者NT-proBNP水平比较 两组患者入院时NT-proBNP水平差异无统计学意义(P>0.05);两组患者治疗后1周NT-proBNP水平较PCI术前明显降低(P<0.05),两组间比较差异无统计学意义(P>0.05);治疗后4周NT-proBNP水平较治疗后1周降低(P<0.05),B组降低更明显(P<0.05)。见表2。
表1 治疗前后两组患者Gal-3水平(±s) ng/mL

表1 治疗前后两组患者Gal-3水平(±s) ng/mL
*与治疗后1周相比,P<0.05;△与A组相比,P<0.05;#与PCI术前相比,P<0.05
组别 PCI术前 治疗后1周 治疗后4周A 组(n=30) 4.44±0.74 8.63±1.29# 6.37±1.36*B 组(n=30) 4.56±0.90 8.01±1.32# 5.48±1.31*△
表2 治疗前后两组患者NT-proBNP水平(±s) pg/mL

表2 治疗前后两组患者NT-proBNP水平(±s) pg/mL
*与治疗后1周相比,P<0.05;△与A组相比,P<0.05;#与PCI术前相比,P<0.05
?
2.3 治疗前后两组患者LVEF水平比较 两组患者入院时LVEF水平差异无统计学意义(P>0.05);两组患者治疗后1周LVEF水平较PCI术前明显升高(P<0.05),两组间比较差异无统计学意义(P>0.05);治疗后4周LVEF水平较治疗后1周升高(P<0.05),B组升高更明显(P<0.05)。见表3。
表3 治疗前后两组患者LVEF水平(±s) %
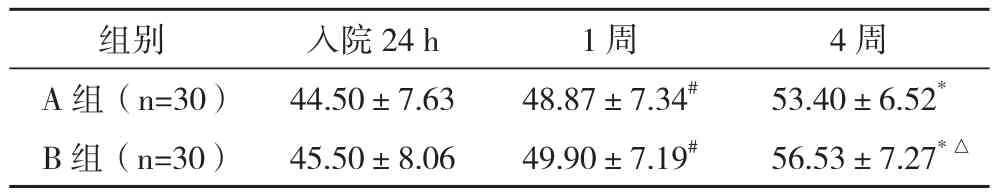
表3 治疗前后两组患者LVEF水平(±s) %
*与治疗后1周相比,P<0.05;△与A组相比,P<0.05;#与PCI术前相比,P<0.05
组别 入院24 h 1周 4周A 组(n=30) 44.50±7.63 48.87±7.34# 53.40±6.52*B 组(n=30) 45.50±8.06 49.90±7.19# 56.53±7.27*△
2.4 Gal-3与 NT-proBNP、LVEF的相 关 性分析相关性分析提示,Gal-3与NT-pro-BNP呈正相关(r=0.72,P<0.05), 与 LVEF呈 负 相 关(r=-0.761,P<0.05)。
3 讨论
心力衰竭是心血管疾病的终末阶段,心室重构是心力衰竭发生与发展的重要病理生理基础,是心功能逐渐恶化的关键,如何减慢或延缓心室重构的进展成为心力衰竭治疗的主要方向。BNP、NT-proBNP能很好地反映心功能的情况,因而被应用于诊断心力衰竭、评估心衰治疗效果及判断心衰预后的指标。近年来以BNP为心力衰竭治疗靶点的大型临床试验结果不乐观,同时由于BNP和NT-proBNP水平受到性别、年龄、肾功能、感染等多种因素影响,使其诊断心力衰竭的价值有所下降。此外期待特异性的生化指标或与其配合使用来指导患者的治疗。Gal-3被认为是心肌细胞纤维化的新型生物标志物[4],与心力衰竭的病理生理过程有关,是新的心力衰竭标志物。
半乳糖凝集素(Galectins)属于外源性凝集素家族,Gal-3是半乳糖凝集素家族的重要成员之一,由巨噬细胞激活分泌,在细胞浆、细胞核和细胞外均有表达。Gal-3参与调节细胞增殖、细胞凋亡,介导细胞黏附,参与炎症反应、纤维化等[5-6]。AMI发生后,大量心肌细胞坏死,大量释放炎症因子,诱导巨噬细胞迁移、纤维母细胞活化、成纤维细胞增生,导致心肌纤维化,出现心功能不全。Gal-3可通过促进心脏巨噬细胞浸润、刺激纤维母细胞活化进而参与心肌纤维化的形成。研究发现,AMI大鼠心脏梗死区域,Gal-3 mRNA表达明显增加,并且在梗死后1周达高峰;非梗死区域 Gal-3 mRNA表达明显增加,但较梗死区域减少。Sanchez等[7]向正常大鼠心包中灌注Gal-3,发现心肌细胞过度纤维化,出现心功能不全;进一步研究发现Gal-3可以影响胶原蛋白的增生,表现为I型、III型胶原增加不协调,I型胶原的增多率是III型胶原增多率的3倍,而I型、III型胶原的表达增加且增加比率不协调是导致左心功能不全发生的原因之一。此外,Gal-3还可以通过基质金属蛋白酶(MMPs)和金属蛋白酶组织抑制剂(TIMPs)抑制细胞外基质的降解,从而导致心肌成纤维细胞增生,胶原蛋白合成增加。有研究表明,MMPs/TIMPs平衡是维持心肌成纤维细胞胶原合成与降解代谢平衡的关键[8-9]。如果MMPs的活性过度增加或者MMPs/TIMPs(比例)严重失调,将导致心室重构、心肌纤维化的发生[10],恶化心功能。本研究显示在心肌梗死后患者Gal-3水平明显升高,相关性分析表明,Gal-3与NT-proBNP呈正相关,与LVEF呈负相关,说明AMI后Gal-3与心功能变化密切相关,Gal-3与心功能呈负相关,随心功能好转,Gal-3水平降低。
近年来的研究证实,他汀类药物除调脂作用以外,还有抗炎、抗氧化、改善内皮功能、抑制血小板聚集、调节自主神经系统等作用,被称为“他汀的多效性”[11],从理论上讲可能减少或延缓心力衰竭的发生、发展。资料提示他汀类药物可改善和逆转心肌梗死后心室重构。Hayashidani等[12]发现氟伐他汀可抑制左室胶原酶、MMP-2、MMP-13的表达,减少心脏胶原容积分数,减轻心梗后大鼠心II肌肥厚和间质纤维化,说明他汀可能会引起MMPs/TIMPs比率的变化,进而影响心肌纤维化。Sheng等[13]研究发现辛伐他汀通过TLR4途径改善心肌梗死大鼠的心室重构。研究发现他汀治疗可以通过增加内源性NO恢复冠状动脉内皮功能,明显改善AMI后的左心室重构,从而改善心功能[14]。本研究发现应用瑞舒伐他汀治疗后1周、4周Gal-3、NT-proBNP均降低,LVEF升高,并且瑞舒伐他汀高剂量组变化更明显,说明长期大量瑞舒伐他汀更能改善心肌细胞的纤维化及心室重构,改善心功能。
[1] Sun Y.Myocardial repair/remodelling following infarction:roles of local factors[J].Cardiovasc Res,2009,81(3):482-490.
[2] Yu L, Ruifrok W P, Meissner M, et al. Genetic and pharmacological inhibition of galectin-3 prevents cardiac remodeling by interfering with myocardial fibrogenesis[J].Circ Heart Fail,2013,6(1):107-117.
[3] Ho J E, Liu C, Lyass A, et al. Galectin-3, a marker of cardiac fibrosis, predicts incident heart failure in the community[J]. J Am Coll Cardiol,2012,60(14):1249-1256.
[4] Lok D J, Lok S I, Bruggink-Andre de la Porte P W, et al. Galectin-3 is an independent marker for ventricular remodeling and mortality in patients with chronic heart failure[J].Clin Res Cardiol,2013,102(2):103-110.
[5] Kim H,Lee J,Hyun J W,et al. Expression and immunohistochemical localization of Galectin-3 in various mouse tissues[J].Cell Biol Int,2007,31(7):655-662.
[6] Elola M T,Wolfenstein -Todel C,Troncoso M F,et al. Galectins:matricellular glycan-binding proteins linking cell adhesion,migration,and survival[J]. Cell Mol Life Sci,2007,64(13):1679-1700.
[7] Sanchez-Mas J, Lax A, Asensio-Lopez M C, et al. Galectin-3 expression in cardiac remodeling after myocardial infarction[J]. Int J Cardiol,2014,172(1):e98-e101.
[8] Liu YH, D’Ambrosio M, Liao T D, et al. N-acetyl-seryl-aspartyllysyl-proline prevents cardiac remodeling and dysfunction induced by galectin-3, a mammalian adhesion/growth-regulatory lectin[J]. Am J Physiol Heart Circ Physiol,2009,296(2):H404-412.
[9] Naito K, Takaliashi M, Kushida K, et al.Measurement of matrix metalloproteinases (MMPs) and tissue inhibitor of nietalloproteinases-1(TIMP-l) in patients with knee osteoarthritis:comparison with generalized osleoarthriiis[J]. Rheumatology (Oxford),1999, 38(6):510-515.
[10] Symeonidis C, Papakonstanlinou E, Galli A, et al. Matrix rnetalloproteinase(MMP-2,-9) and tissue inhibitor (TIMP-1,-2) activity in tear samples of pediatric type 1 diabetic patients:MMPs in tear samples from type 1 diabetes[J].Graefes Arch Clin Exp Ophthalmol,2013,251(3):741-749.
[11] Mathur N,Ramasubbu K,Mann D L.Spectrum of pleiotropic effects of statins in heart failure[J].Heart Fail Clin,2008,4(2):153-161.
[12] Hayashidani S,Tsutsui H, Ikeuchi M,et al. Targeted deletion of MMP-2 attenuates early LV rupture and late remodeling after experimental myocardial infarction[J]. Am J Physiol Heart Circ Physiol,2003,285(3):H1229-235.
[13] Sheng F Q, Xu R, Cheng L X,et al. In rats with myocardial infarction, interference by simvastatin with the TLR4 signal pathway attenuates ventricular remodelling[J]. Acta Cardiol,2009,64(6):779-785.
[14]Ishida K, Geshi T,Nakano A,et al. Beneficial effects of statin treatment on coronary microvascular dysfunction and left ventricular remodeling in patients with acute myocardial infarction[J]. Int J Cardiol,2012,155(3):442-447.
