周剂量紫杉醇联合表阿霉素治疗晚期乳腺癌的临床观察
2014-09-18高鹏
高鹏
乳腺癌是女性恶性肿瘤中最为常见的一类,据报道,全球每年新发乳腺癌者高达130万,而死于乳腺癌者达到50万[1]。近年来,部分调查数据显示,乳腺癌发生率呈现逐渐上涨的趋势,对广大女性的身心健康形成了严重威胁。对于晚期乳腺癌患者来讲,化疗是延长其生存期的主要治疗方案[2]。研究者为了提升晚期乳腺癌患者生存质量,针对化疗药物的剂量、密度、用药周期、化疗间隔等开展了诸多临床试验,但尚未形成统一的认识[3]。本院此次以1周剂量紫杉醇与表阿霉素联合为56例晚期乳腺癌患者施治,对临床疗效及化疗药物毒副作用进行了重点观察,现报告如下。
1 资料与方法
1.1 一般资料 选取2008年1月-2014年1月本院收治的56例晚期乳腺癌患者,其中,初治者28例,复治者28例,全部经细胞学检查或组织病理学检查确诊,治疗前未曾使用紫杉醇类药物,复治者曾以CAF方案施治。病灶的客观评价显示,患者的Karnofsky评分不低于70分,预计生存期不少于3个月,心电图、肝肾常规、血常规基本正常,复治者与上次治疗的时间间距超过1个月。患者年龄36~70岁,中位年龄56.5岁;12例为肝转移,10例为肺转移,12例为骨转移,11例为淋巴结转移,5例为其他转移,4例多脏器转移,2例为局部复发。
1.2 方法 56例患者使用周剂量PTX与EPI的联合方案施治,具体方法如下:PTX(商品名:安泰素;生产企业:F. H. Faulding & Co.Ltd.Trading as David Bull Lab;注册证号X20010120):前1~7 d,用量为75 mg/m2,静脉滴注,3周为一个周期,连续用药至少2个周期。EPI(通用名:注射用盐酸表柔比星;生产企业:山东新时代药业有限公司;批准文号:国药准字0202H3216):前1 d,用量为80 mg/m2,静脉滴注。联合用药注意事项如下:治疗前,测定患者的血小板、白细胞计数,可根据具体情况,对化疗药物剂量加以调整。用药期间,观察患者肿瘤病灶变化,若为CR、PR或SD,则继续用药,可以延长至6~8个周期。静脉滴注紫杉醇期间,密切关注患者心电监护指标变化。每次使用紫杉醇之前,为患者进行毒副作用预处理,用药如下:前6、12 h,口服地塞米松(10 mg/次);前30 min,肌注25 mg异丙嗪,静注300 mg西咪替丁。在化疗期间,给予患者地塞米松、甲氧氯普胺、昂丹司琼等药物,以预防呕吐反应。若患者出现高于Ⅱ度的血液学毒性反应,则立即采用粒细胞集落刺激因子行升白治疗。
1.3 疗效评定标准 临床疗效评价依照实体瘤评价标准(RECIST)[4],共分为4级,肿瘤完全缓解为CR,肿瘤部分缓解为PR,肿瘤病灶稳定存在为SD,肿瘤病灶进展为PD,CR以及PR均为有效,计算并统计比较两组患者的RR(CR+PR)率。化疗药物毒副作用采用WHO颁布的抗癌药物毒性标准加以评定,毒副作用程度分为Ⅰ度、Ⅱ度、Ⅲ度、Ⅳ度。
1.4 统计学处理 采用SPSS 17.0统计学软件处理数据,计数资料以%表示,比较采用 字2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效 初治者与复治者的RR率比较差异无统计学意义( 字2=0.07,P>0.05),见表 1。
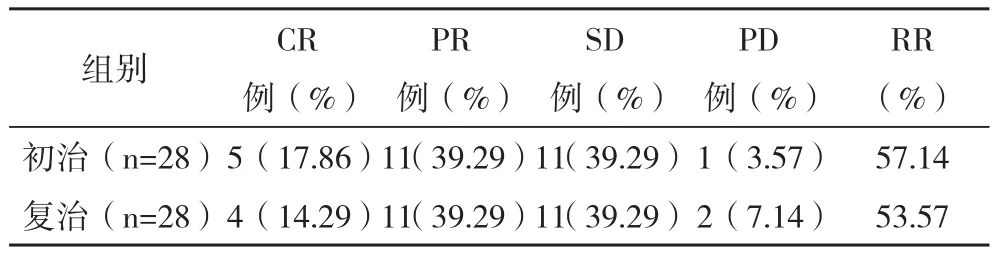
表1 初治者与复治者疗效的比较
2.2 毒副作用 56例患者的各类毒副作用见表2,其中白细胞减少发生率为71.43%(40/56),脱发发生率为73.21%(41/56),明显高于其他毒副作用的发生率(P<0.05),两者间无显著差异( 字2=0.04,P>0.05)。3 讨论

表2 56例患者的各类毒副作用
研究发现,乳腺癌发展到晚期后,其瘤体的体积往往明显增大,而癌细胞经过皮下淋巴管的扩散造成皮肤水肿,或者经过腋窝淋巴结的转移融合与周围组织发生粘连,部分患者还会累及皮肤诱发皮癌性溃疡[5]。这一问题使得根治性手术的难度明显增加,手术切除乳腺不仅无法达到彻底控制肿瘤病灶的目的,还会引起诸多严重并发症[6-7]。因此,目前的研究者多主张以化疗方案为晚期乳腺癌患者施治,紫杉醇、表阿霉素常用的化疗药物。
紫杉醇作为一种新型抗微管药物,可以有效与小管β位结合,从而使微管聚合为束状或者团块状,得以稳定[8]。而且,紫杉醇还可以进一步阻断微观网的重建路径,将癌细胞的分裂控制在G2/M阶段,抑制癌细胞扩散,最终得到抗癌作用[9-10]。表阿霉素作为阿霉素异构体,用于肿瘤化疗,具有抗癌活性强、脱发反应轻以及心脏毒性低等优势。近年来,表阿霉素逐步得到推广。将紫杉醇与表阿霉素相互联合,为患者实施化疗,成为一组高效化疗方案[11]。
部分研究者认为紫杉醇的使用剂量以及周期皆会影响化疗的效果,周剂量紫杉醇用药方案是其中疗效最为显著的一类,此方案可以有效延长其与肿瘤病灶的接触时间,增强剂量强度[12]。而且,鉴于紫杉醇的细胞毒性受到药物作用时间控制,将药物持续时间延长,还能够降低类似神经毒性、骨髓抑制等严重毒副作用的发生几率[13]。
本院此次将周剂量的紫杉醇和表阿霉素联合,用于56例晚期乳腺癌患者的化疗,结果显示,28例初治者与28例复治者RR率均达到50%以上,差异无统计学意义(P>0.05)。而毒副作用主要表现为白细胞减少和脱发,严重程度则主要为Ⅰ度、Ⅱ度、Ⅲ度、Ⅳ度。验证了临床报道中谈及的周剂量紫杉醇所具有的临床应用优势。
综上所述,临床医师采用周剂量紫杉醇和表阿霉素为晚期乳腺癌患者实施治疗,具有较高的肿瘤控制效果,且能够有效降低毒副作用的发生率及毒副作用等级,提升患者化疗的安全度。因此,这一方案具有推广价值。
[1]蔡伟,刘丹丹,康骅,等.ET方案新辅助化疗对乳腺癌组织中CXCR4表达的影响及临床意义[J].中国普外基础与临床杂志,2010,16(8):812-815.
[2] 江漫,吴燕,马亚中,等. 表阿霉素和紫杉醇单用或联合使用对乳腺肿瘤细胞ZR75-1的体外细胞毒性[J].解放军药学学报,2012,4(4): 342-344.
[3] 梁良,王晓珊,刘迪. 不同化疗方案对乳腺癌近期疗效的影响[J].中国肿瘤临床与康复,2014,21(3): 299-301.
[4] 田忠成,邵飞飞,邱实. 不同化疗方案治疗三阴乳腺癌的疗效对比分析[J].中国实用医药,2014,8(2): 80-81.
[5] 盛树海,赵楚敏,郑进,等. 多西紫杉醇、表阿霉素、环磷酰胺联合化疗与序贯化疗对乳腺癌患者空腹血糖的影响[J]. 实用医学杂志, 2013,42(2): 302-304.
[6] 王梅,王雅杰,施俊义,等. 局部晚期乳腺癌新辅助化疗每周方案与三周方案疗效分析[J]. 临床肿瘤学杂志, 2010,15(4):336-338.
[7] 郜娜娜,邹明雷. 两种不同新辅助化疗方案治疗局部晚期乳腺癌的临床观察[J]. 中国临床研究,2014,22(5): 567-569.
[8] 徐扬,白云潮,胡超. 新辅助化疗对局部晚期乳腺癌组织中雌激素受体孕激素受体和人表皮生长因子受体2表达的影响[J]. 中国肿瘤临床与康复,2014,21(10): 1158-1160.
[9] 季明华,吴建中,唐金海. 亚甲基四氢叶酸还原酶基因多态性与乳腺癌新辅助化疗敏感性关系的研究探讨[J]. 实用临床医药杂志,2012,15(1): 1-4.
[10] 马天江,张国耀,陈素华,等. 周剂量紫杉醇联合表阿霉素治疗晚期乳腺癌的临床观察[J].中国社区医师(医学专业),2011,27(32): 72.
[11] 刘春萍,栗东雪,马锌. 紫杉醇联合表阿霉素治疗乳腺癌不良反应的护理[J]. 临床合理用药杂志, 2013,5(30): 68-69.
[12] 李翔,赵新汉,赵晓艾. 三阴性乳腺癌化疗方案疗效统计分析 [J]. 中国现代医药杂志, 2014,15(1): 5-6.
[13] 丘志超. 参芪扶正注射液联合化疗治疗晚期乳腺癌临床观察[J].辽宁中医药大学学报,2010,11(11): 174-175.
