干扰素辅助治疗病毒性肝炎引发肝癌患者的M eta分析和系统评价
2014-09-18张勤良关琪
张勤良,关琪
(1.沈阳医学院附属中心医院 普外科,辽宁 沈阳 110024;2.沈阳医学院附属中心医院 检验科,辽宁 沈阳 110024)
干扰素辅助治疗病毒性肝炎引发肝癌患者的M eta分析和系统评价
张勤良1,关琪2Δ
(1.沈阳医学院附属中心医院 普外科,辽宁 沈阳 110024;2.沈阳医学院附属中心医院 检验科,辽宁 沈阳 110024)
目的评价干扰素辅助治疗经手术切除或经动脉化疗栓塞治疗的病毒性肝炎相关肝癌患者的疗效和安全性。方法在Medline、PubMed、Cochrane Library和EMBASE数据库上检索2000年~2012年发表的关于干扰素辅助治疗病毒性肝炎相关肝癌患者的临床试验文献,根据生物异质性,用固定效应和随机效应2种模型来分析检索结果。结果根据纳入和排除标准,共检索到10篇临床试验文章,包括8篇随机对照实验和2篇非随机对照实验。10篇实验文章共1029位受试者被纳入最终的Meta分析中,其中,528名病毒性肝炎相关肝癌患者接受干扰素辅助治疗,501名患者接受安慰剂治疗。与对照组相比较,干扰素组病毒性肝炎相关肝癌的复发率较低[相对危险性值(odds ratio,OR)=0.66,95%可信区间(confidence interval,CI=0.50~0.86,P=0.02)],尤其是肝动脉栓塞化疗后,根据亚组分析,手术切除后复发率显著下降(OR=0.73,95%CI=0.52~1.01,P=0.06);肝动脉栓塞化疗后复发率显著下降(OR=0.54,95%CI=0.33~0.86,P=0.01)。与对照组相比较,根据总事件分析和亚组分析显示干扰素组死亡率显著降低(OR=0.42,95%CI=0.32~0.56,P<0.01),根据亚组分析,手术切除后死亡率(OR=0.51,95%CI=0.36~0.72,P=0.0002),肝动脉栓塞化疗后死亡率(OR=0.33,95%CI=0.2~0.50;P<0.00001)。结论干扰素辅助治疗能有效降低病毒性肝炎相关肝癌患者的复发率,并且能有效提高患者手术切除或者肝动脉栓塞化疗后的生存率。理想的剂量为3m IU/mL,每周3次,它可以使患者耐受干扰素的不良反应,更好的,长时间的维持有效浓度。
干扰素;辅助治疗;病毒性肝炎;肝癌;Meta分析
原发性肝癌主要由肝细胞癌(hepatocellular carcinoma,HCC)组成,是世界上第15个最常见的癌症和第3个最常见的癌症死亡率原因[1]。由于恶性肿瘤早期诊断的困难程度高,大多数患者在首次就医时病变已经发生转移[2]。但是,只有大约10%~30%的患者可有机会接受根治性治疗,如肝移植[3]。肝脏反式种植由于它的高成本和严格的选择标准只适用于一小部分患者。因此,大多数患者接受手术切除或经肝动脉栓塞化疗[4]。不幸的是,肝癌3年后纯手术切除或肝动脉栓塞化疗复发率超过50%,这也是治疗后死亡的主要原因[5]。大多数肝癌患者携带有乙肝病毒(hepatitis B virus,HBV)和丙型肝炎病毒(hepatitis C virus,HCV)。由于干扰素能抑制乙肝病毒的复制和丙型肝炎病毒,并杀死癌细胞,有研究认为干扰素可以减少治疗后的肝癌患者复发,但结论并不一致[6-8]。本文通过循证医学系统评价提出的临床资料,采用固定/随机效应模型进行荟萃分析以研究射频消融术和肝切除在小肝癌治疗中的疗效,并为循证医学提供基础。
1 材料与方法
1.1 检索策略
1.1.1 文献检索 回顾所有关于干扰素辅助治疗肝细胞癌患者疗效的实验结果。计算机检索 MEDLINE,PubMed,Cochrane Library和EMBASE数据库(2000年~2012年)。检索词“肝细胞癌”、“肝癌”、“肝肿瘤”、“干扰素””。这些术语分别以不同的组合检索文献。此外,审阅相关原创文章和评论的参考文献目录,以找出其他可能的合格试验。
1.1.2 资料检索 纳入标准:①所有病例经病理检查均确诊为肝癌结合病毒性肝炎(HBV/HCV);②无论是干扰素组还是对照组均采用手术切除或肝动脉栓塞化疗治疗;③第一次治疗(手术切除或肝动脉栓塞化疗)后,接受干扰素辅助治疗,持续时间超过3个月;④随访时间超过1年,对照组用安慰剂治疗;⑤研究对象都是临床对照试验病例;⑥样本量>20。
排除标准:①已治疗的转移性肝癌,或者复发性肝癌;②重复性文章和比例数较小的文章;③随访时间少于1年;④样本量≤20。
1.1.3 数据提取 所有文献检索均由本文的研究作者审查,以确定相关试验符合纳入标准,并且所有文献均由独立审稿人进行检查。通过讨论解决差异,并邮寄给作者做解释。
被纳入的研究用随机方法,盲法和跟进的分配计划进行审查。根据Cochrane系统评价手册,所有研究的可信性可分为3个等级[9]:A级的研究符合所有评估标准和正确的方法,大大降低了偏倚风险;B级研究有1个或多个标准未被描述而存在中度偏倚风险;C级研究有1个或多个不正确的标准,从而存在高度偏倚风险。根据该方法质量评估标准,2项研究为A级和8项研究为B级,研究的质量由2位专家独立评估(见表1)。
1.2 数据分析 采用审查管理软件(RevMan5.2,Cochrane协作网,牛津,英国)进行统计分析。干扰素组和对照组连续的描述性数据用“x±s”表示,病例数(n)用二元数据记录。
Mantel-Haenszel Q统计用来评估研究的异质性,计算I2检验研究的全变差的比例,估算异质性。用固定效益模型进行分析,P>0.10或P≤0.10,I2≤50%代表各实验间差异性没有显著意义。积分结果以P<0.05为差异有统计学意义。
消除迄今发表的研究中的所有重复的数据。对结果中的发表偏倚率进行评估,并使用标准方法处理。用漏斗图从视觉上检查2组样品的尺寸和治疗效果之间的关系。
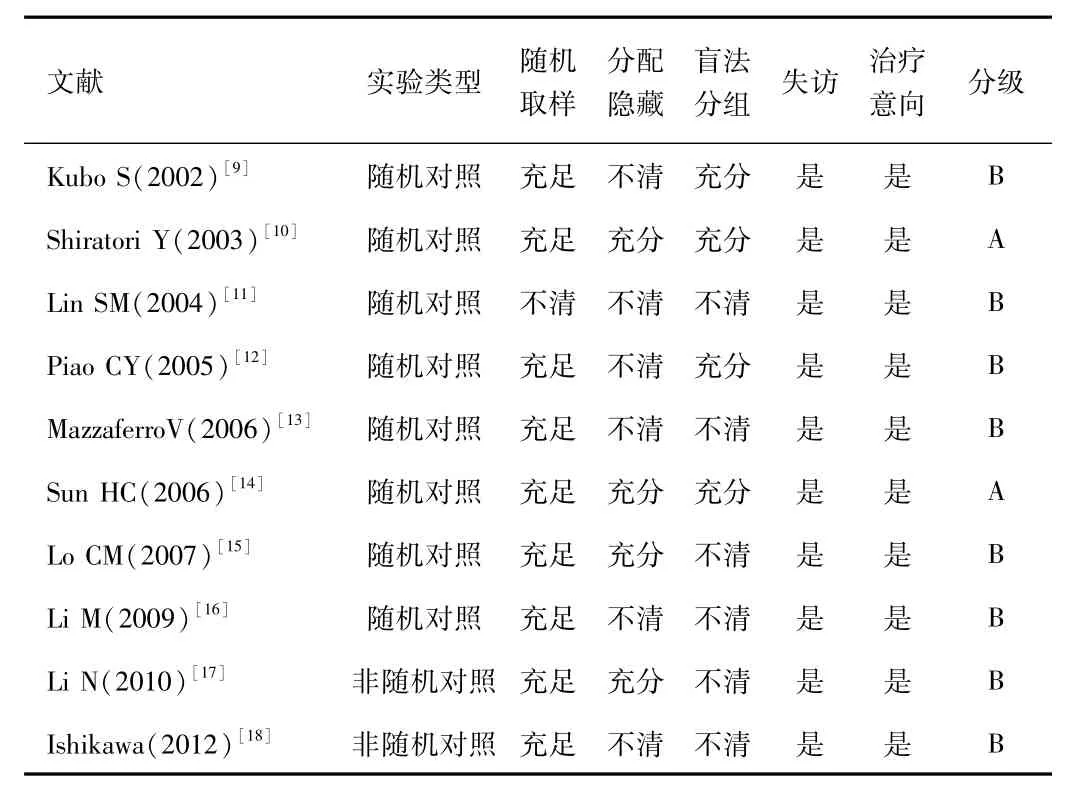
表1 纳入研究的质量评估Tab.1 Quality evaluation on the included studies
2 结果
2.1 检索结果 用手动和计算机联合检索2000年~2012年 MEDLINE,PubMed,Cochrane Library和 EMBASE数据库(检索之前被引用的文章和被鉴定过的文章的参考文献目录),共检索到403篇相关文章。368篇文章被排除,因为文题和摘要与这一Meta分析的目的无关。35篇纳入的文章中有14篇文章不提供全文。余下的21篇提供全文的有11篇被排除在外(原因见图1)。最终,10篇文章,共1029名受试者被纳入系统审查,其中包括8个随机对照试验和2个非随机对照试验(见图1)。
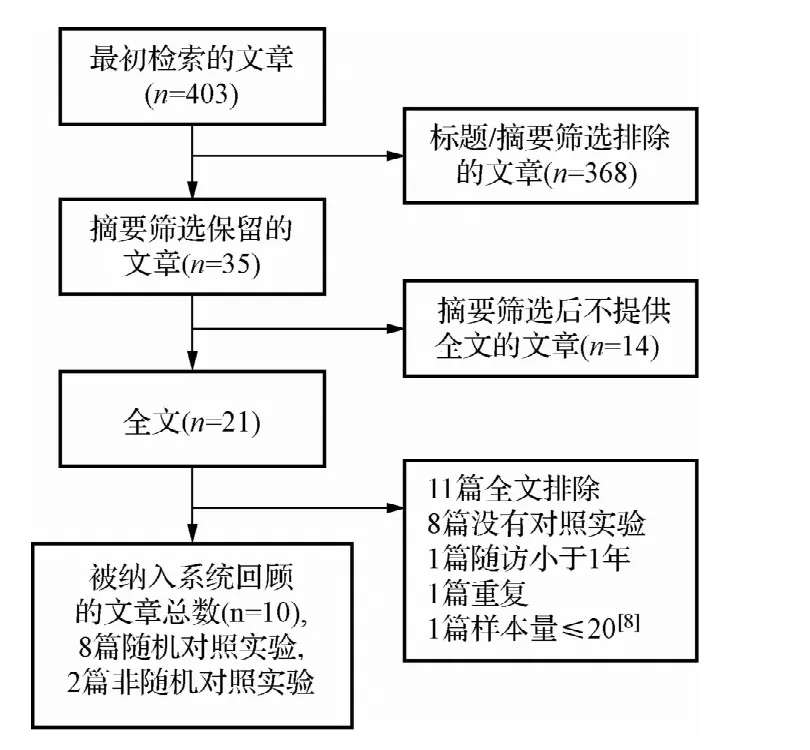
图1 文献筛选过程Fig.1 Literature screening process
总共有1029名受试者被纳入最终的Meta分析:包括528例接受干扰素辅助治疗的肝细胞癌患者和501例接受安慰剂治疗的患者。最长的随访时间为85.2个月,最短的随访时间为24.0个月。最大样本量为236,最小样本量为30。纳入的10项研究的特性列于表2中,干扰素组中干扰素辅助治疗的应用见表3。
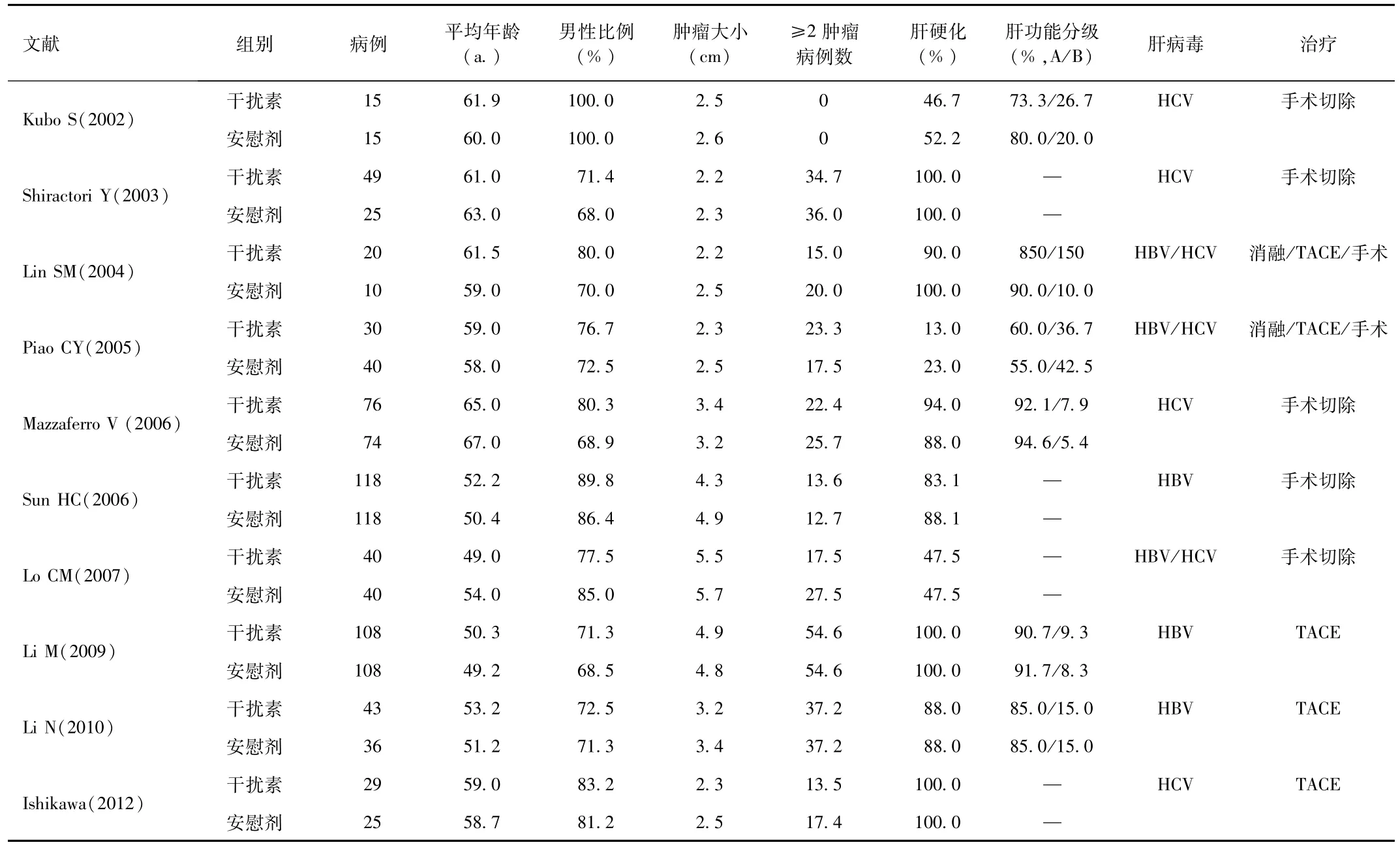
表2 纳入Meta分析文献的特点Tab.2 Characteristics of the included Meta analysis

表3 干扰素辅助治疗在干扰素组中的应用Tab.3 Applications of adjuvant treatmentwith interferon in IFN group
2.2 荟萃分析 比较肝癌射频消融(radiofrequency ablation,RFA)和肝切除术(hepatic resection,HR)在小肝细胞癌治疗之中的复发率和死亡率。为进一步检测不同类型治疗方法的复发率和死亡率的差异,根据治疗类型的不同(手术切除和肝动脉栓塞化疗)进行亚组分析。各荟萃分析数据结果如下所示。
2.2.1 肝细胞癌的复发率 9篇文章[9-17],包括975例患者,比较了干扰素组和对照组中肝细胞癌的复发率。把比值比(OR)作为检测治疗效果方法的指标,用χ2检验异质性,其结果为P=0.67(>0.10),I2=0%(<50%),这表明 2组间无异质性。采用固定效应模型进行Meta分析。结果(比值=0.66,95%可信区间=0.50~0.86,P=0.02)表明,干扰素辅助治疗能显著降低初次治疗后肝癌的复发率。
为了进一步加强上述结论,根据治疗类型的不同(手术切除和肝动脉栓塞化疗)进行了亚组分析。用χ2检验异质性,结果分别为 P=0.60(>0.10),I2=0%(<50%)和 P=0.57(>0.10),I2=0%(<50%),表明2种方法间不存在异质性。因此,可以采用固定效应模型。结果(手术切除法OR=0.73,95%可信区间=0.52~1.01,P=0.06;肝动脉栓塞化疗比值=0.54,95%可信区间=0.33~0.86,P=0.01)表示经过肝动脉栓塞化疗和手术切除的干扰素组和对照组肝癌的复发率差异无统计学意义(见图2)。
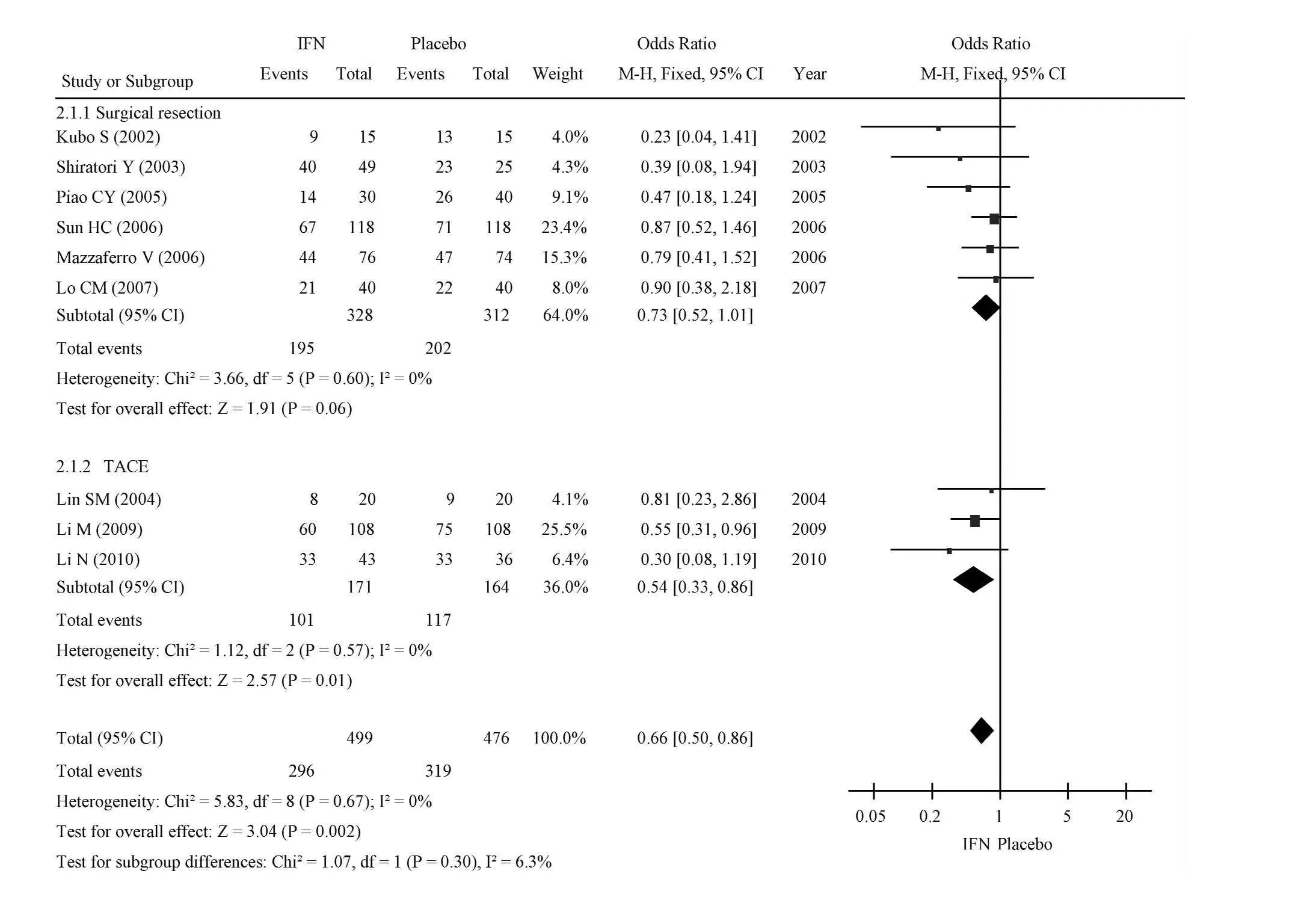
图2 干扰素组与对照组肝癌复发率比较Fig 2 Comparison of liver cancer recurrence rate between INF group and control group
2.2.2 肝细胞癌的死亡率 9篇文章[9-11,13-18],包括949例患者,比较了干扰素组和对照组中肝细胞癌的死亡率。把比值比(OR)作为检测治疗效果方法的指标,用χ2检验异质性,其结果为P=0.54(>0.10),I2=0%(<50%),这表明2组间无异质性。因此,采用固定效应模型进行Meta分析。结果(相对危险性值(odds ratio,OR)=0.42,95%CI=0.32~0.56,P=0.00001)表明,干扰素辅助治疗能显著降低初次治疗后肝癌的死亡率。
为了进一步加强上述结论,根据治疗类型的不同(手术切除和肝动脉栓塞化疗)进行了亚组分析。用χ2检验异质性,结果分别为 P=0.91(>0.10),I2=0%(<50%)和 P=0.29(>0.10),I2=0%(<50%),表明2种方法间不存在异质性。因此,可以采用固定效应模型。结果(手术切除法,OR=0.73,95%CI=0.52~1.01,P=0.06;肝动脉栓塞化疗,OR=0.54,95%CI=0.33~0.86,P=0.01)表示无论是经过肝动脉栓塞化疗或者手术切除的干扰素组和对照组肝癌的死亡率没有显著差异(见图3)。
2.2.3 敏感性分析和出版偏倚 采用固定/随机效应模型来测试每个指标,发现结果彼此相关。我们做了一个漏斗图用来做比较(见图4),包括亚组比较。这2个漏斗图的特点基本上是倒置的漏斗形,双侧对称,这表明没有发表偏倚,得出的结论是可靠的。
3 讨论
这篇荟萃分析评估了干扰素辅助治疗经手术切除或经动脉化疗栓塞治疗的病毒性肝炎相关肝癌患者的疗效和安全性。所有病例均合并为病毒性肝炎。结果表明,无论是肝癌的复发率还是死亡率,在干扰素组与对照组之间均存在显著差异。临床工作中,治疗肝癌的主要方法是手术和肝动脉栓塞化疗[19]。为了排除不同治疗方法引起的偏差,本文选择了手术和肝动脉栓塞化疗方法治疗肝癌,在2者之间进行了亚组分析,以确定这2种方法之间的差异。
只有2篇纳入的研究报告了干扰素辅助治疗的不良事件[11,15]。主要不良反应为高烧,疲倦,白细胞和血小板减少,肝毒性和甲状腺功能亢进症,等等。干扰素的不良反应呈现剂量依赖性。Lo CM等[15]的随机对照试验分低剂量干扰素组,高剂量干扰素组和对照组,但高剂量组(30 m IU/mL,每周3次)的患者均因不良事件退出了实验。Sakaguchi Y等[20]研究表明,长期使用低剂量干扰素辅助治疗病毒性肝炎可改善患者的耐受性,从而改善预后。

图3 比较干扰素组和对照组肝癌死亡率Fig.3 Comparison of liver cancermortality between INF gropup and control group

图4 各比较漏斗图Fig.4 Funnel plot of each comparison
干扰素具有多种生物学功能,如抗病毒,抗细胞增殖,抗血管生成和免疫调节等,并广泛应用于多种疾病的治疗中[21-22]。体外实验表明[23],α-干扰素能抑制人脐静脉内皮细胞的增殖,并且其抑制功能随着剂量和作用时间的延长而增强。体内实验表明[24],α-干扰素辅助治疗后,肿瘤直径明显降低,并且微血管密度明显比对照组低,有显著差异。因此,可以推测,α-干扰素通过抑制肿瘤血管生成和抗细胞增殖来实现其抗肿瘤作用。上面的生物学特性可以解释干扰素辅助治疗有利于肝癌的治疗。
研究发现干扰素诱导乙型肝炎E血清转换的效果差强人意[25],但干扰素的主要作用为抗病毒,免疫调节和抗增殖剂,而不是集成乙肝病毒基因的抑制剂[26]。干扰素治疗通过减轻活动性肝炎,改善肝纤维化和肝功能[27],以及降低复发肿瘤的严重程度来提高总生存期,因此适用于二次治疗性消融或切除[28]。通过上述描述可以得出结论:虽然干扰素并不能防止乙型肝炎相关肝癌,但对病毒性肝炎相关肝癌仍有长期有效影响。
本研究有以下限制:①虽然大部分纳入研究是随机对照试验,但是样本规模相对较小;②纳入病例的基本特点是各不相同的,且影响肝细胞癌临床预后的效果因素(包括临床分期、病理类型、治疗方法、肿瘤的大小和机体免疫能力)也可能影响荟萃分析的结果;③纳入的研究大多报告了复发率和死亡率,有关干扰素辅助治疗的整体生存率和无病生存期的报道较少。
总之,基于10篇纳入文献的荟萃分析表明,干扰素辅助治疗可以显著减轻患者病毒性肝炎相关肝癌的复发率,提高患者手术切除或肝动脉栓塞化疗后的生存率。治疗的理想剂量为3 MIU/m L,每周3次,而且干扰素的剂量依赖性使患者能够更好地耐受干扰素的不良反应和长时间保持有效浓度。
[1]El-Serag HB,Rudolph KL.Hepatocellular carcinoma:epidemiology and molecular carcinogenesis.Gastroenterol 2007,132(7):2557-2576.
[2]Llovet JM,Burroughs A,Bruix J.Hepatocellular carcinoma[J].Lancet 2003,362(9399):1907-1917.
[3]Paquet KJ,Koussouris P,Mercado MA,et al.Limited hepatic resection for selected cirrhotic patients with hepatocellular or cholangiocellular carcinoma:a prospective study[J].Br JSurg 1991,78(4):459-462.
[4]Fan ST,Lo CM,Liu CL,et al.Hepatectomy for hepatocellular carcinoma:toward zero hospital deaths[J].Ann Surg 1999,229(3):322-330.
[5]Llovet JM,Schwartz M,Mazzaferro V.Resection and liver transplantation for hepatocellular carcinoma[J].Semin Liver Dis,2005,25(2):181-200.
[6]von Marschall Z,Scholz A,Cramer T,et al.Effects of interferon alpha on vascular endothelial growth factor gene transcription and tumor angiogenesis[J].JNatl Cancer Inst,2003,95(6):437-448.
[7]Wu WZ,Sun HC,et al.Mechanism of interferon alpha on inhibition of metastasis and angiogenesis of hepatocellular carcinoma after curative resection in nudemice[J].JGastrointest Surg,2003,7(5):587-594.
[8]Ikeda K,Arase Y,Saitoh S,et al.Interferon beta prevents recurrence of hepatocellular carcinoma after complete resection or ablation of the primary tumor-a prospective randomized study of hepatitis C virusrelated liver cancer[J].Hepatol,2000,32(2):228-232.
[9]Kubo S,Nishiguchi S,Hirohashi K,et al.Randomized clinical trial of long-term outcome after resection of hepatitis C virus-related hepatocellular carcinoma by postoperative interferon therapy[J].Br J Surg,2002,89(4):418-422.
[10]Shiratori Y,Shiina S,Teratani T,et al.Interferon therapy after tumor ablation improves prognosis in patients with hepatocellular carcinoma associated with hepatitis C virus[J].Ann Intern Med,2003,138(4):299-306.
[11]Lin SM,Lin CJ,Hsu CW,etal.Prospective randomized controlled study of interferon-alpha in preventing hepatocellular carcinoma recurrence aftermedical ablation therapy for primary tumors[J].Cancer2004,100(2):376-382.
[12]Piao CY,Fujioka S,Iwasaki Y,et al.Lamivudine treatment in patients with HBV-related hepatocellular carcinoma-using an untreated,matched control cohort[J].Acta Med Okayama,2005,59(5):217-224.
[13]Mazzaferro V,Romito R,Schiavo M,et al.Prevention of hepatocellular carcinoma recurrence with alpha-interferon after liver resection in HCV cirrhosis[J].Hepatol,2006,44(6):1543-1554.
[14]Sun HC,Tang ZY,Wang L,et al.Postoperative interferon alpha treatment postponed recurrence and improved overall survival in patients after curative resection of HBV-related hepatocellular carcinoma:a randomized clinical trial[J].JCancer Res Clin Oncol,2006,132(7):458-465.
[15]Lo CM,Liu CL,Chan SC,et al.A randomized,controlled trial of postoperative adjuvant interferon therapy after resection of hepatocellular carcinoma[J].Ann Surg,2007,245(6):831-842.
[16]Li M,Lu C,Cheng J,et al.Combination therapy with transarterial chemoembolization and interferon-alpha compared with transarterial chemoembolization alone for hepatitis B virus related unresectable hepatocellular carcinoma[J].JGastroenterol Hepatol,2009,24(8):1437-1444.
[17]Li N,Lai EC,Shi J,et al.A comparative study of antiviral therapy after resection of hepatocellular carcinoma in the immune-active phase of hepatitis B virus infection[J].Ann Surg Oncol,2010,17(1):179-185.
[18]Ishikawa T,Higuchi K,Kubota T,et al.Combination PEG-IFN a-2b/ribavirin therapy following treatment of hepatitis C virus-associated hepatocellular carcinoma is capable of improving hepatic functional reserve and survival[J].Hepatogastroenterology,2012,59(114):529-532.
[19]Marrero JATM.Current Treatment Approaches in HCC[J].Clin Adv Hematol Oncol,2013,(4):15-18.
[20]Sakaguchi Y,Kudo M,Fukunaga T,et al.Low-dose,long-term,intermittent interferon-alpha-2b therapy after radical treatment by radiofrequency ablation delays clinical recurrence in patients with hepatitis C virus-related hepatocellular carcinoma[J].Intervirology 2005,48(1):64-70.
[21]Chen RY,Bowden S,Desmond PV,et al.Effects of interferon alpha therapy on the catalytic domains of the polymerase gene and basal core promoter, precore and core regions of hepatitis B virus[J].J Gastroenterol Hepatol,2003,18(6):630-637.
[22]Li J,Liu K,Liu Y,etal.Exosomesmediate the cell-to-cell transmission of IFN-α-induced antiviral activity[J].Nat Immunol,2013,14(8):793-803.
[23]Wang CJ,Xiao CW,You TG,et al.Interferon-alpha enhances antitumor activities of oncolytic adenovirus-mediated IL-24 expression in hepatocellular carcinoma[J].Mol Cancer,2012,11(1):31.
[24]Wang L,Tang ZY,Qin LX,etal.High-dose and long-term therapywith interferon-alfa inhibits tumor growth and recurrence in nude mice bearing human hepatocellular carcinoma xenograftswith highmetastatic potential[J].Hepatol,2000,32(1):43-48.
[25]纪永健,李菲菲,任万华,等.HBeAg早期下降对聚乙二醇干扰素α-2a治疗HBeAg阳性慢性乙型肝炎的疗效预测[J].中华肝脏病杂志,2013,21(5):335-339.
[26]Ormeci N.Short-and long-term effectsof treatmentof chronic hepatitis B and delta virus by IFN[J].Fundam Clin Pharmacol,2003,17(6):651-658.
[27]Nishiguchi S,Shiomi S,Nakatani S,et al.Prevention of hepatocellular carcinoma in patientswith chronic active hepatitis C and cirrhosis[J].Lancet,2001,357(9251):196-197.
[28]Murata M,Nabeshima S,Kikuchi K,et al.A comparison of the antitumor effects of interferon-alpha and beta on human hepatocellular carcinoma cell lines[J].Cytokine,2006,33:121-128.
(编校:吴茜)
M eta-analysis and systematic review:ad juvant interferon therapy for patients w ith viral hepatitis-related hepatocellular carcinoma
ZHANG Qin-liang1,GUAN Qi2
(1.Department of anorectal disease,Central Hospital Affiliated to Shenyang Medical College,Shenyang 110024,China;2.Department of Medical Laboratory,Central Hospital Affiliated to Shenyang Medical College,Shenyang 110024,China)
ObjectiveTo evaluate the efficacy and safety of adjuvant IFN therapy for viral hepatitis-related hepatocellular carcinoma(HCC)after treatmentwith surgical resection or transarterial chemoembolization(TACE).MethodsControlled trials of adjuvant treatmentwith IFN for patientswith HCC published between 2000 and 2012 were searched electronically in MEDLINE,PubMed,Cochrane Library,and EMBASE databases.According to the heterogeneity of the studies,two differentmodels-the fixed-effectmodeland the random-effectmodel-were applied to analyze the results.ResultsTen trials were screened according to inclusion and exclusion standards.Eight randomized,controlled trials and two non-randomized,controlled trials were included.These ten trials with a total of 1,029 subjects were eventually involved in the meta-analysis;528 HCC patients were treated with adjuvant treatmentwith IFN and 501 patients with placebo.Compared to the control group,the recurrence rates of HCC in IFN group were significantly lower CR=0.66;95%CI=0.50 to 0.86;P=0.02),especially after TACE treatment according to subgroup analysis(OR=0.73;95%CI=0.52 to 1.01;P=0.06 for surgical resection;and OR=0.54;95%CI=0.33 to 0.86,P=0.01 for TACE).The death rates in the IFN group also significantly decreased according to not only total events analysis(OR=0.42;95%CI=0.32 to 0.56;P<0.01)but also subgroup analysis(OR=0.51;95%CI=0.36 to 0.72;P=0.0002 for surgical resection;and OR=0.33;95%CI=0.21 to 0.50;P<0.01 for TACE).ConclusionAdjuvant IFN therapy may significantly reduce the recurrence rates of patients with viral hepatitis-related HCC and improve the survival of patients after surgical resection or TACE.The ideal dosemostly selected is 3 MIU/mL,three times per week,which can make patients tolerate the adverse reactions of IFN better and maintain effective concentrations for a long time.
interferon;adjuvant treatment;viral hepatitis;hepatocellular carcinoma;Meta-analysis
R195.1
A
1005-1678(2014)03-0068-07
辽宁省自然科学基金资助(201102150)
张勤良,男,硕士,副主任医师,研究方向:中西医结合治疗普外科疾病,E-mail:zql_1681@163.com;关琪,通信作者,男,博士,主任检验师,研究方向:抗肿瘤及抗病毒免疫,E-mail:2428600886@qq.com。
