Clara细胞分泌蛋白对创伤性休克肺损伤的保护作用
2014-09-18翟宏鹏张春阳张健李金晖
翟宏鹏,张春阳,张健,李金晖
(沈阳医学院奉天医院 普外3科,辽宁 沈阳 110024)
Clara细胞分泌蛋白对创伤性休克肺损伤的保护作用
翟宏鹏,张春阳,张健,李金晖
(沈阳医学院奉天医院 普外3科,辽宁 沈阳 110024)
目的探讨Clara细胞分泌蛋白(Clara cell secretion protein 16,CC16)对创伤性休克大鼠模型继发性肺损伤的保护作用及其机制。方法选择30只成年雄性SD大鼠,随机均分为3组:假手术组、对照组、CC16处理组(n=10)。采用创伤性休克动物模型,假手术组均完成基本手术操作,但不放血和复苏;对照组放血后在液体复苏前雾化吸入与CC16处理组等容量的生理盐水;CC16处理组在复苏前给予雾化吸入0.1μg/mL的重组人Clara细胞分泌蛋白(reconstituted Clara cell secretion protein,rh-CCSP)。实验结束后监测动脉血气分析及肺湿/干重比等指标变化,并测定肺组织中丙二醛(malondialdehyde,MDA)、髓过氧化物酶(myeloperoxidase,MPO)及肺组织病理学的改变。结果与对照组相比,CC16处理组的pH、PaO2值显著升高,BE值显著降低(P<0.05),肺湿/干重比显著减少(P<0.05);CC16处理组与假手术组间各项指标比较无统计学意义;与对照组相比,CC16处理组的MDA、MP0含量明显降低(P<0.05),肺组织病理学形态也有改善(P<0.05)。结论雾化吸入rh-CCSP可减轻创伤性休克大鼠继发性肺损伤的炎症反应,对肺组织具有保护作用,机制可能与其抗氧化应用有关。
Clara细胞分泌蛋白;创伤性休克;肺损伤;大鼠
1 材料与方法
1.1 动物分组及创伤性休克动物模型的制备 动物分组:健康成年SD大鼠30只,雄性,体质量300~350 g,由沈阳军区总医院动物实验中心提供,动物许可证号:SCXK(沈)2013-0004。随机分为3组:假手术组、对照组、CC16处理组,每组10只动物。
创伤性休克动物模型的制备[4]:各组动物在手术前禁食过夜,自由饮水,10%水合氯醛(0.3 mL/100 g,腹腔注射)麻醉后,颈部正中线左右2mm处做切口,以20号动静脉留置针穿刺右侧颈动静脉置管,动脉连接多参数生理监测仪,监测动脉血压,静脉插管用于补液,假手术组操作至此;其他2组:在监测血压情况下,用外科咬骨钳于左侧股骨中段下1/3处钳断、止血、包扎,待血压稳定后,颈动脉快速放血5 mL,使平均动脉压降至35~40mmHg。对照组在血压稳定后雾化吸入0.9%生理盐水10min;CC16处理组于血压稳定后雾化吸入50μg/mL的重组人Clara细胞分泌蛋白(rh-CCSP)10min。两组分别于90 min后,回输自体抗凝血与乳酸林格氏液进行复苏,补液量为失血量的2倍。
1.2 检测方法 复苏后4 h,大鼠麻醉处死。各组取动脉血1mL,血气分析仪进行分析,记录pH值、PaO2值、BE值。取大鼠右肺中、下叶,用冷DEPC水对肺组织进行灌洗后,立即取右肺中、下叶放入冻存管于-80℃冰箱中保存,以备测定肺组织丙二醛(malondialdehyde,MDA)含量和髓过氧化物酶(myeloperoxidase,MPO)活性,方法按试剂盒所述。另取大鼠右肺上叶,称取湿重,经烤箱干燥后称取干重,计算肺湿/干重比。再取大鼠左肺,10%福尔马林固定后,经过脱水透明、石蜡包埋、切片染色后,分别于光镜下观察组织病理形态学变化。
1.3 统计学处理 采用SPSS13.0统计软件进行数据分析,正态计量数据以“x±s”表示,各组计量数据之间采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 血气分析指标的变化 从表1可以看出,与对照组相比,CC16处理组的pH、PaO2值显著升高,BE值降低(P<0.05)。CC16处理组与假手术组间比较无统计学意义。
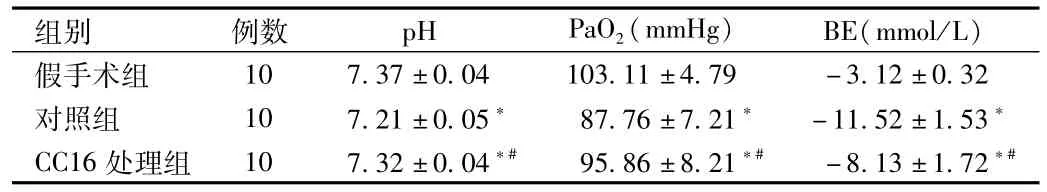
表1 各组血气分析指标的变化Tab.1 Analysis of the changes of blood gas of different groups
2.2 肺湿/干重比及MPO、MDA活性的测定 从表2可以看出,与假手术组比较,对照组肺湿/干重比显著增高(P<0.05);与对照组相比,CC16处理组肺湿/干重比明显降低(P<0.05)。与假手术组相比,对照组MPO及MDA活性显著增高(P<0.05);而CC16处理组MPO及MDA活性虽然较假手术组有显著增高,但显著低于对照组(P<0.05)。
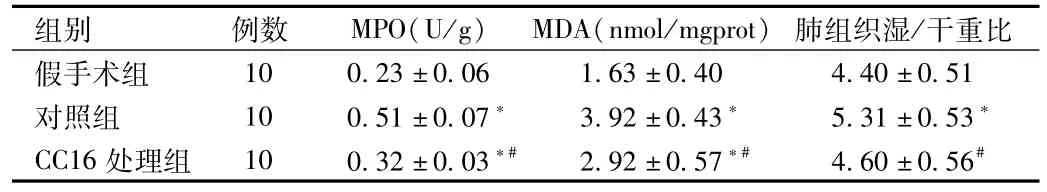
表2 各组肺组织MPO、MDA活性以及肺湿/干重比Tab.2 MPO、MDA and wet/dry weight of different groups
2.3 肺组织病理形态学改变 正常大鼠肺泡壁完整,无明显病变;复苏后对照组大鼠部分肺泡壁完整性破坏,间质水肿、增宽,肺泡腔内有大量炎症细胞浸润聚集;而CC16处理组大鼠肺泡间隔略有增宽,肺间质少量炎症细胞浸润,充血及间质水肿较对照组减轻(见图1)。

图1 肺叶组织病理学变化(×100)Fig.1 Pathological changes of lung tissue pathology(×100)
3 讨论
创伤性休克病程发展复杂多变,病理过程尚未完全清楚。创伤性休克肺损伤的发病机制,现在普遍认为是由于机体大量失血造成的肺组织微循环功能障碍,体内的代偿作用使肺组织内动、静脉直接大量的联通,从而造成动脉血中的氧含量严重不足,且全身代谢产物经过血液可能储留于肺[5-6]。这种作用可逐渐损伤肺泡上皮细胞,使肺泡表面活性物质减少,肺泡功能损害。另外血管通透性增加可以造成肺水肿、肺出血、肺泡萎缩和肺不张,使肺部通气和血液灌注比例失调。低氧血症持续性加重和呼吸困难造成肺部不可逆损伤引发急性呼吸窘迫综合征,形成休克肺。机体对外部创伤和休克的急性应激引发全身炎症反应综合征。以上2种综合征均为引起创伤性休克患者死亡的主要原因。因此,研究如何进行创伤后休克早期肺功能保护成为当前急需解决的问题之一。
Clara细胞分泌蛋白作为肺部新的敏感标志物,其功能多样,具有抗炎、抗肿瘤、免疫调节等保护肺组织的作用[4],被越来越多的研究者所重视。Rosenberger[7]等人研究发现,通过糖皮质激素作用于鼠、兔肺,其肺内的CC16明显升高水平,说明CC16对肺部具有抗炎和免疫调节的作用。罗佛全等[7]将SD大鼠用内毒素致急性肺损伤后,发现静脉注射内毒素后0.5 h开始肺组织匀浆液中CC16蛋白含量和肺组织CC16mRNA表达水平均进行性下降,于6 h达最低水平,伤后24 h两者均有所回升。致伤后6 h内,随着肺组织CC16蛋白和CC16mRNA表达水平的恢复,肺组织炎性损害程度明显恢复。大鼠静脉注射脂多糖后支气管肺泡灌洗液中CC16的含量有明显变化,脂多糖作用于大鼠24 h后CC16表达明显降低,结果表明CC16对急性肺损伤有保护作用[7]。最近对青少年吸烟状况的研究发现,在每天吸烟次数不同的情况下,吸烟最为频繁的人群中CC16在支气管肺泡灌洗液中的含量明显降低,而且CC16在支气管肺泡灌洗液中的含量随着每天吸烟次数的增多逐渐降低[8]。Saha等研究发现:在肺部黑色素瘤患者中,CC16含量降低,黑色素瘤细胞大量浸润,炎症反应增强[9]。Katavolos等学者最近研究发现提取马的血液,使CC16作用于马血后,能使马血中的中性粒细胞促炎功能显著降低,同时使中性粒细胞具有抗炎作用[10]。这些结果均提示CC16对肺局部炎症反应有调控作用,可抑制肺部过度炎症反应的发生。
在本实验中,创伤失血性休克复苏后对照组动脉血pH及Pa02值明显降低,而BE值升高,反映存在明显的呼吸功能障碍及酸中毒。随着给予外源性rh-CCSP后处理组血气分析及湿干重比等各指标均得到不同程度改善,这提示内源性CC16浓度的减少在创伤失血性休克的损伤过程中具有重要意义。在肺组织病理形态学观察发现在创伤失血性休克液体复苏后,肺泡壁的完整性被破坏,肺间质和肺泡壁内有大量炎细胞浸润和渗出,结合肺湿/干重比升高提示肺组织损伤严重。而在CC16处理组,肺组织病理损伤及水肿程度均有不同程度的减轻。已有研究表明CC16抗炎作用可能的机制如下:①CC16可以抑制磷脂酶A2和前列腺素D2的作用,减少引发炎症的级联反应,从而减少花生四烯酸的产生,抑制炎症的发生[11]。②CC16还有抑制血液中单核细胞、中性粒细胞迁移的作用,这些细胞的迁移与一些细胞因子的诱导有关[12-15]。本实验结果提示:在创伤失血性休克中,对照组中反映体内氧化应激及炎症程度的指标MDA含量增加、MPO活性增加,表明机体清除氧自由基能力下降,自由基损伤程度加重,机体内大量CC16可能被消耗于清除氧自由基的过程中。CC16处理后大鼠肺组织MDA含量及MPO活性降低,从而推测CC16抗炎机制还可能通过抑制髓过氧化物酶活力,清除氧自由基,降低脂质过氧化物反应,减轻肺损伤。
综上所述,外源性rh-CCSP可在创伤失血性休克模型中对继发性肺组织损伤起到一定的保护作用,而且这种保护作用的机制可能与CC16的抗氧化应激作用有关。
[1]Hsieh YC,Yang SL,Choudhry MA,et al.Flutamide restores cardiac function after trauma-hemorrhage via an estrogen-dependent pathway through upregulation of PGC-1[J].Am JPhysiol Heart Circ Physiol,2006,290(1):416-423.
[2]Lannuzzi MC.Clara cell protein in sarcoidosis:another job for the respiratory tract protector[J].Am JRespir Crit Care Med,2004,169(2):143-144.
[3]Mutti A,Corradi M,Goldoni M,et al.Exhaled metallic elements and serun pneumoproteins in asymptomatic smokersand patientswith COPD or asthma[J].Chest,2006,129(5):1288-1297.
[4]Briana DD,Gourgiotis D,Boutsikou M,et al.Clara cell protein in fullterm pregnancies:the influence of intrauterine growth restriction[J].Pediatr Pulmonol,2010,45(12):1186-1191.
[5]Wang SZ,Rosenberger CL,Bao YX,et al.Clara cell secretory protein modulates lung inflammatory and immune responses to respiratory syncytial virus infection[J].J Immunol,2003,171(2):1051-1060.
[6]罗佛全,傅华群.急性肺损伤大鼠肺组织CC16的表达及其对肺局部炎症反应的调控[J].现代免疫学,200525(6):502-506.
[7]宋秀梅,王月兰,李成.机械通气对大鼠肺组织中CC10表达的影响[J].山东大学学报(医学版),2008(11):132-133.
[8]李晓红,黄元云.体外循环后肺损伤和肺保护的研究进展[J].中国体外循环杂志,2008(1):23-25.
[9]Katavolos P,Ackerley CA,Clark ME,et al.Clara cell secretory protein increases phagocytic and decreases oxidative activity of neutrophils[J].Vet Immunol Immunopathol,2011,139(1):1-9.
[10]Van Miert E,Sardella A,Bernard A,et al.Biomarkers of early respiratory effects in smoking adolescents[J].Eur Respir,2011,38(6):1287-1293.
[11]Saha A,Lee YC,Zhang Z,et al.Lack of an endogenous antiinflammatory protein in mice enhances colonization of B16F10 melanoma cells in the lungs[J].Biol Chem,2010,285(14):10822-10831.
[12]Katavolos P,Ackerley CA,Clark ME,et al.Clara cell secretory protein increases phagocyticand decreases oxidative activity of neutrophils[J].Vet Immunol Immunopathol,2011,39(1):1-9.
[13]Ohchi T,Shijubo N,Kawabata I.Polymorphism of Clara cell 10-KD protein gene of sarcoidosis[J].Am JRespri Crit Care Med,2004,169(2):180-186.
[14]李禄,黄平.Clara细胞分泌蛋白CC16与支气管哮喘的关系[J].国际内科学杂志,2007,9(34):542-555.
[15]张悦,王惠萱,陈忠明,等.哮喘患者血清CC16蛋白检测的临床价值研究[J].现代检验医学杂志,2012(4):34-36.
(编校:李璐璐)
Protective effects of Clara cell secretory protein on lung injury in traumatic shock model
ZHAIHong-peng,ZHANG Chun-Yang,ZHANG Jian,LIJin-Hui
(The Third Department of General Surgery,Fengtian Hospital of Shenyang Medical College,Shenyang 110024,China)
ObjectiveTo investigate the effect and mechanism of Clara cell secretory protein(CC16)on lung injury of traumatic shock rats.MethodsThirty SDmale rats were randomly assigned to three groups:sham-operation group,control group and CC16-treatment group.The rat model of traumatic shock was used in this study.Rats of sham-operation group were operated,but not treated by depletion and recovery.Rats of control group inhaled the physiological saline before fluid resuscitation.Rats of CC16-treatment group inhaled 0.1μg/mL of recombinant human Clara cell secretory protein(rh-CCSP)before fluid resuscitation.Arterial blood gas analysis and wet/dry weight were detected in each group.The contents of malondialdehyde(MDA),myeloperoxidase(MPO)of lung tissues and lung tissue pathology changeswere also studied.ResultsCompared with control group,pH and PaO2value in CC16-treatment group increased significantly.Meanwhile,BE value and lung wet/dry weight ratio also decreased significantly(P<0.05).Compared with control group,contents of MDA and MPO in CC16-treatment group decreased significantly(P<0.05).Lung tissue pathology improved in the CC16 group compared with that of control group(P<0.05).ConclusionInhaled Rh-CCSP may have potential protective effect on lung injury tissues of traumatic shock ratsmodel through its antioxidative effect.
Clara cell secretory protein;traumatic shock;lung injury;rat
R641
A
1005-1678(2014)03-0061-03
创伤性休克[1]多由于机体遭受严重创伤使有效循环血量锐减,微循环灌注不足,导致机体代偿失调,因此较单纯失血性休克的病因、病理更加复杂。细胞代谢障碍造成乳酸堆积,液体复苏的同时诱导大量炎症因子的释放,造成凝血障碍和缺血-再灌注损伤,继而并发急性全身炎症综合征和多器官功能衰竭。肺作为最易受损的重要器官之一,肺微循环功能障碍,使肺泡上皮细胞损伤,肺泡表面活性物质减少,血管通透性增加造成肺水肿和出血肺泡萎缩和肺不张,使通气和血液灌注比例失调。Clara细胞分泌蛋白(Clara cell secretion protein 16,CC16)是肺泡上皮分泌的20种蛋白之一,随着人们对CC16的研究逐渐加深,发现CC16对肺局部炎症反应有很好的调控作用,可抑制肺部过度炎症反应的发生[2-3]。本实验应用创伤失血性休克模型,观察给与外源性重组人Clara细胞分泌蛋白后对于创伤后继发性肺损伤的保护作用,并探讨其可能的机制。
全军医学科技“十二五”科研项目(CSY12J002)
翟宏鹏,男,硕士,主治医师,研究方向:普外疾病治疗,E-mail:zhaihongpeng12@163.com。
