超声对纳米多聚体靶向释放D N A影响的实验性研究
2014-09-18范海波张海李莹张园唐建熹陈俊汇李本义
范海波,张海△,李莹,张园,唐建熹,陈俊汇,李本义
(1.深圳市人民医院 暨南大学 第二临床医学院 超声科,广东 深圳 518020;2.香港大学 深圳医院 放射科,广东 深圳518020;3.深圳市人民医院 暨南大学 第二临床医学院 内科,广东 深圳 518020;4.珠海市卫生局科技处,广东 珠海 519000;5.湖北省中山医院 外科,湖北 武汉 430033;6.美国堪萨斯大学医学中心,堪萨斯州 堪萨斯市 66160)
超声对纳米多聚体靶向释放D N A影响的实验性研究
范海波1,张海1△,李莹2△,张园3,唐建熹4,陈俊汇5,李本义6
(1.深圳市人民医院 暨南大学 第二临床医学院 超声科,广东 深圳 518020;2.香港大学 深圳医院 放射科,广东 深圳518020;3.深圳市人民医院 暨南大学 第二临床医学院 内科,广东 深圳 518020;4.珠海市卫生局科技处,广东 珠海 519000;5.湖北省中山医院 外科,湖北 武汉 430033;6.美国堪萨斯大学医学中心,堪萨斯州 堪萨斯市 66160)
目的通过超声照射纳米多聚体实验,了解超声对纳米多聚体靶向可控释放DNA的影响。方法实验用溶剂蒸干法制备纳米多聚体——聚乳酸/乙醇酸共聚物(Polylactic/poly glycolic acid, PLGA),为表面携带雄激素受体PLGA纳米颗粒,其包裹有编码荧光蛋白(GFP)的DNA。配制PLGA溶液2 h后,用2种超声方式,不同占空比及不同时间辐照后将溶液离心,定量观察DNA释放情况及细胞荧光表达效果。结果超声能破坏PLGA纳米壳,并释放DNA。辐照组的多聚体DNA释放量均高于对照组;DNA释放量随超声辐照的声强、时间增加变化不显著;连续超声波辐照降解作用略强于脉冲波;胰淀粉酶对DNA释放影响不大。结论体外实验证实超声有促进PLGA纳米多聚体降解及DNA释放的作用。
超声降解;纳米多聚体;聚乳酸/乙醇酸共聚物;脱氧核糖核酸
1.2 方法 甘露醇干燥保存的PGLA纳米粒加PBS稀释,配制成每样本500µL数十份后静置2 h,在37℃环境下进行超声辐照试验。第1组是超声辐照组样本制作,用脉冲波、50%占空比,分别对制备的PLGA溶液辐照1.5、9、20 min,对照组(不加超声辐照)。第2组分别以10%、30%、50%的占空比辐照
PLGA溶液9 min。第3组分别用30%占空比和50%占空比、同频率分别采用连续波和脉冲波辐照PLGA溶液9 min。第四组设立无辐照对照组及连续波和脉冲波辐照组,并将部分辐照后的PLGA溶液分别加2µL的冰醋酸,氢氧化钠置于不同酸碱环境或加入胰淀粉酶。以500µL PLGA离心3 min取上清,先予100µL氯仿清除脂溶杂质,振荡30 s,14000 r/min离心机离心3 min后,取上清抽提基因DNA,以Nanodrop仪定量观测DNA浓度。对照组:双蒸水阴性对照。部分采用紫外分光光度计(uvND-1000 UV spoetrophotometer)验证,方法是:500µL离心后1 mL水离心法冲洗2遍,加入400µL氯仿清除杂质,加1 mL TE缓冲液(pH 8.0)提取DNA,UV 260波长测量,并计算DNA浓度。
1.3 统计学方法 4组实验均重复3次,并取其平均值采用t检验进行统计分析。SPSS 13.0采用单因素方差分析,组间两两比较采用SNK的方法。
2 结果
2.1 超声辐照PLGA靶向释放DNA定性实验 在试管中,以超声辐照含纳米粒溶液,大部纳米壳破裂,使得溶液上清中DNA含量增加,证实超声具有降解PLGA纳米粒作用(见图1)。
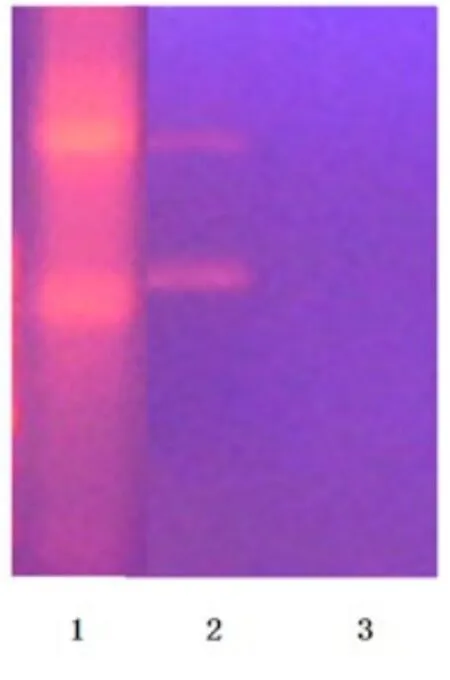
图1 PLGA靶向释放DNA定性实验图1.苯酚提取DNA;2.超声处理后;3.无超声处理Fig.1 Degradation of PLGA Released DNA1.Phenol extraction DNA;2.After Ultrasound treatment;3.No Ultrasound treatment
2.2 超声辐照下胰淀粉酶、酸碱对PLGA纳米粒控释的关系 有无超声辐照以及胰淀粉酶、酸碱处理后对PLGA纳米粒控释的关系结果见图2。直接超声组辐照后DNA测值与对照组比较,差异具有统计学意义(P<0.05)。胰淀粉酶组DNA测值与直接超声组比较,差异无统计学意义。10%占空比下,pH偏酸性时PLGA释放DNA增多,与直接超声组比较,差异具有统计学意义(P<0.05);pH偏碱性时释放DNA破坏,测值消失。30%占空比下,酸环境下的数据丢失。
2.3 对照组与同强度超声组辐照时间与DNA释放量关系重复实验3次,对照组与同强度超声组辐照时间与DNA释放量关系结果见表1。从中可以看出,在有无超声辐照2组间DNA释放量有显著性差异(P<0.05),说明超声能促进DNA的释放。但不同辐照时间的DNA释放量无明显差异。
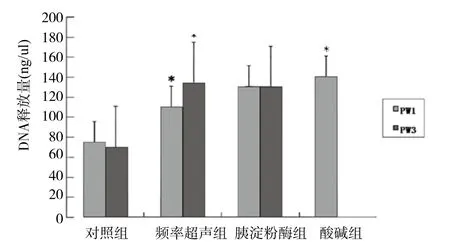
图2 超声降解PLGA控释DNA测定PW1:10%的占空比辐照样本;PW3:30%的占空比辐照样本*P<0.05,与对照组比较Fig.2 Ultrasonic Irradiation on Degradation of PLGA Released DNA PW 1:10% duty cycle irradiation samples;PW 3:30% duty cycle irradiation samples*P<0.05,compared with control group
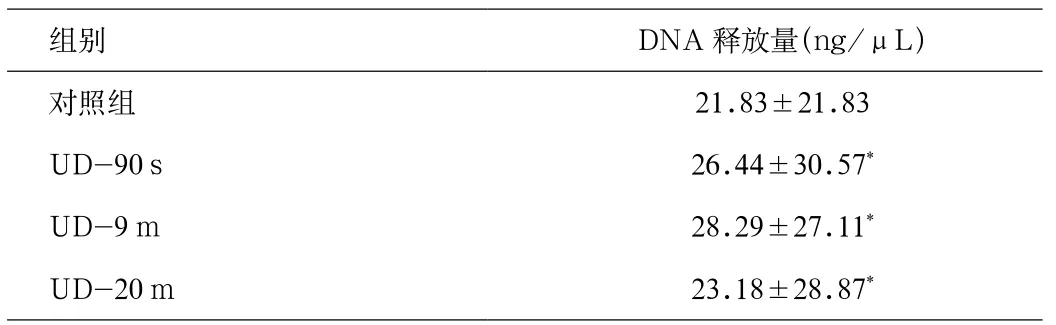
表1 DNA释放量随对照组和同强度超声不同辐照时间组的变化Tab.1 Ultrasonicat ion irradiation time - the release of DNA
2.4 超声参数占空比不同与DNA释放量间的关系 用不同占空比超声处理各组,其DNA释放量间的数值变化见图3。超声辐照强度与DNA释放量间的关系(相同时间)为用不同占空比超声处理各组后DNA释放量的变化,超声各组均选脉冲波,作用时间均为9 min,结果显示:随占空比增加DNA释放量增加趋势不明显。
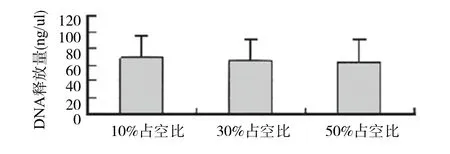
图3 不同占空比与DNA释放量Fig.3 Different duty cycle and the release of DNA
2.5 超声脉冲波/连续波与DNA释放量间的关系 用30%占空比,9 min;50%占空比,9 min,同频同时间分别采用连续波和脉冲波处理各组DNA释放量间的数值变化见图4。由图可知,在占空比、作用时间相同的情况下,不同超声发射波对DNA的释放量无差异。

图4 超声脉冲波/连续波与DNA释放量Fig.4 US pluse /continuous wave and the release of DNA
3 讨论
乳酸羟基乙酸共聚物(PLGA)在体内降解为乳酸单体,作为能量代谢物质参与体内三羧酸循环,终产物为水和二氧化碳,是目前美国FDA批准可用于临床的,机体内生物可降解的,无害清除的功能纳米多聚体新材料[1]。直径为纳米的微球,特别是100 nm以下的纳米粒子,是目前公认的摄入效果最好的、具有良好的透过血管内皮间隙,通过细胞吞噬作用,能增加细胞对核苷酸摄取的并持久停留在靶细胞内、被动靶向进入细胞内的药物与基因载体纳米粒子[2]。PLGA表面联结的具有肿瘤靶向的基团或抗体使得其主动附集在肿瘤,选择杀死肿瘤细胞[5,6]。这个研究表明:多聚体降解、基因、药物释放除与微球大小、基质多聚体材料多孔等材料因素外,在特定时间使用超声波辐照,能提高体外模拟状态下纳米多聚体颗粒降解率与DNA基因释放。超声辐照纳米溶液靶向释放DNA定性实验中用与不用超声、与苯酚提取DNA三者电泳差异明显,超声辐照有局部靶向促纳米粒降解、增强基因在肿瘤细胞内释放的潜能。
超声微泡靶向控释技术(ultrasoun-targeted microbubble destruction,UTMD),是一种靶向、高效有广阔应用潜力的非病毒基因与药物输送系统[2,7]。其机制与超声通过空化与声孔、声流(acoustic streaming)效应增加降解有关[8]。国内外近期开始研究含气多功能纳米粒,特别是能发生谐波共振增大背散射面积的含气胶粒,它对回波信号增强明显,并能在超声谐振下爆裂、释放DNA与内部药物,因而持续受到关注,很有研究与应用前景[2-12]。本实验结果表明:超声体外对纳米PLGA多聚体有促进生物降解与靶向控释DNA作用。超声辐照与否,各组别纳米微粒DNA释放量差异明显;而超声波的种类(同声强、同时间;不同占空比超声波;PW与CW、和同占空比延长照射时间,对转基因纳米粒的DNA释放量差异无统计学意义。
该研究还表明,超声安全的靶向触发,可控降解、释放基因同时受众多因素影响。外分泌胰淀粉酶组对释放影响不大;偏碱性pH下,PLGA纳米粒释放DNA少,这是由于PLGA聚合物末端为未封闭的羧基,在生理和偏碱性pH下,导致DNA释放少、且表面呈负电荷。这样当其被细胞内摄取后到达酸性的溶酶体中(pH 4),纳米粒释放DNA多、表面发生选择性的电荷逆转,即由负电荷转变成正电荷,这一转变有利于纳米粒与负电荷的溶酶体囊泡膜的相互作用,造成瞬间局部的囊泡膜去稳定化,纳米粒逃逸溶酶体而进入细胞质发挥作用[7]。超声波具有众多参数,而具有开发靶向治疗的潜能,对肿瘤的非侵入靶向药物与基因治疗意义重大。
此研究证实超声在体外对纳米PLGA多聚体有促进生物降解与靶向可控释DNA作用;超声辐照下纳米PLGA多聚体使DNA在细胞内分布更集中、自然降解无细胞毒性、稳定性能好,是一种基因与药物传递的新方法[8-10-11];以此基础构建转染效率高、含气声学增强效果好的质粒[2-12-13],使质粒DNA包裹、附着于微泡,应用范围广,能有效输送基因的非病毒分子靶向多功能载体系统[10-14-15]任重道远。UTMD纳米微粒多功能载体系统前景较好,有待更深入的研究。
[1] Nolsφe CP.US-Guided Ablation Techniques Review and Future Aspects.The 12 th Congress of the World Federation for Ultrasound in Medicine and Biology. 30 August - 3 September 2009 Sydney,Australia.
[2] 陈智毅.超声微泡靶向破坏技术应用与基因传输的研究进展[J].中国超声医学杂志,2011,27(1):88-90.
[3] Turk CT, Oz UC, Serim TM, et al.Formulation and Optimization of Nonionic Surfactants Emulsified Nimesulide-Loaded PLGA-Based Nanoparticles by Design of Experiments[J].AAPS PharmSciTech,2014,15(1):161-76.
[4] Feng Q,Wu J,Fan Q,et al.Preparation of uniform-sized exenatide-loaded PLGA microspheres as long-effective release system with high encapsulation efficiency and bio-stability[J].Colloids Surf B Biointerfaces,2013,112(12):492-498.
[5] 张海,李莹,唐建熹,等.超声辐照促生物可降解纳米多聚体体内释放DNA的研究[J].中华超声影像医学杂志,2011,20(6):533-536
[6] Kost J, Leong K, Langer R,et al.Ultrasound enhanced polymer degradation and release of incorporated substances[J].Proc. Nati Acad,1989,86(10):7663-7666.
[7] 王刚,潘丽,张永光.PLGA纳米/微球作为核酸载体的研究进展[J].微生物学通报,2009,36(12):1901-1908
[8] Aspreet J,Vasira K,Labhasetwar V.Biodegradable nanoparticles for cytosolic delivery of therapeutics[J].Advanced Drug Delivery Reviews,2007,59(8):718-728.
[9] 张海,李莹,陈善义,等.超声与造影剂促,VEGF siRNA抑制鼻咽癌的实验研究[J].中华超声影像医学杂志,2008,18(6):85-88.
[10] 张海,李莹,李富荣,等.超声辐照纳米聚合物体外控释DNA效果的研究[J].中国超声医学杂志,2012,28(9):773-777.
[11] Zhang H.Ultrasound exposure enhances gene delivery with PLGA-based nanoparticles.12 th Congress of the World Federation for Ultrasound in Medicineand Biology 30 August-3 September 2009 oral speech attend the congress held the sponsorship of the 12 th WFUMB in Sydney, Australia.
[12] Na Z,Chuda C,Cory B.PLGA anoparticle-peptide conjugate effectively targets intercellular cell-adhesion molecule-1[J].Bio conjugate Chem,2008,19(1):145-152.
[13] El-Sherif DM,Lathia JD,Le NT,et al.Ultrasound degradation of novel polymer contrast agents[J].J Biomed Mater Res A,2004,68(1):71-78.
[14] Jiang GB,Lin ZT,Xu XJ,et al.Stable nanomicelles based on chitosan derivative:In vitro antiplatelet aggregation and adhesion properties Carbohydrate polymer[J]Accepted Manuscript,2012,88(1):232-238.
[15] 张园,朱惠明,李银鹏,等.超声靶向微泡破碎介导EGFP质粒转染肝癌细胞的研究[J].广东医学,2011,32(22):2920-2923.
The Experimental Research in the Effects of Ultrasonication on Degradation of PLGA Released DNA
FAN Hai-bo1, ZHANG Hai1△,LI Ying2△, ZHANG Yuan3, TANG Jian-xi4, CHEN Jun-hui5, LI Ben-yi6
(1.Department of Ultrasound, Second Medical College of Jinan University, Shenzhen People’s Hospital, Shenzhen 518020,China;2.Radiology Department,Hong Kong university Shenzhen Hospital,Shenzhen 518000, China;3.Medical Department, Second Medical College of Jinan University,Shenzhen People’s Hospital, Shenzhen 518020,China;4.Zhuhai city health administration technology,Zhuhai 519000,China; 5.Surgery,Hubei Zhongshan Hospital, Wuhan 430000,China; 6.Kansas University Medical Center, Kansas 66160,USA)
Objective To identify the effective results of ultrasound in degradation of polymeric nanoparticles released DNA .Polymeric nanoparticles was made by dehydration of polyacetylglutamicacid (PLGA, polylactic-co-glycolic acid)solution。MethodGreen Fluorescent Protein (GFP) was enclosed by PLGA. Different kinds of ultrasound mode and different duct cycle and power ones were used to radiate PLGA solution for 90 s, 9 min, 20 min separately after the solution prepared for 2 hrs,then putted the solution on centrifugal machine at 13000 r/m. Using Choloroform to get rid of fat-soluble impurity, then applied nanodrop to survey the releasing rate of DNA. Finally the effect of cell expression were observed by fl uorescent microscope。ResultsThe amount of DNA released from PLGA in groups which were exposed to ultrasound were signi fi cantly different from the groups which were not exposed to ultrosound. The releasing amount of former groups had upper limitation. The releasing rate was increased with the increment of the irradiation time,frequency of ultrasound;The effect of the DNA releasing and PLGA degradation by continuous-wave irradiation was stronger than pulsed-wave ultrasound。ConclusionUltrasound can promote the degradation of PLGA, and do help in DNA releasing and expression in vitro.
ultrasonication; nano-particle; polylactic-co-glycolic acid; deoxyribonucleic acid
Q 681
A
1005-1678(2014)01-0035-03
现代介入影像与治疗已发展到基因纳米水平[1],PLGA具有包裹DNA,携基因被胞饮进入细胞内,继而进行功能表达的作用,且能够于体内生物降解而得到广泛关注[2-4]。超声波具有体内促绿色荧光蛋白表达的作用,我们前期的分子影像学研究与体内实验亦证实[1-2,5]带标识的PLGA纳米多聚体颗粒孵育2 h可到达细胞内,并维持其高浓度。此实验模拟被胞饮的纳米球时相,进行体外超声促雄激素受体纳米多聚体颗粒(NP-PLGA-GFPAR)降解释放DNA的试验,以了解不同超声辐照的时间、声强、频率等各种因素对NP-PLGA-GFP-AR的影响,有无促多聚体降解与瞬时释放功能。
1 材料与方法
1.1 仪器 德迈超声仪(1)频率:(1±0.18)MHz。(2)输出声强:≤1.0 w/cm2,峰值超声声强:1.0 w/cm2,探头有效辐照面积3 cm2±5%,PW平均声强按占空系数10%;20%;30%;40%;50%分为PW 1-5档(声强:0.05~0.25 w/cm2),CW:按占空系数10%;20%;30%;40%;50%分为CW 1-5档(声强:0.1~0.5 w/cm2);美国泰克Tektronix示波器(TDS 1002);微量离心机转速1~18000转/min;微量紫外/可见分光光度计(美国Nanodrop ND-1000);将药学院定制的NP-PLGAGFP-AR,配制成不同浓度实验样本备用。
深圳市战略性新兴产业发展专项(JCYJ20130402101926971);深圳市科技创新二批基础项目(JCYJ 20120829170525005);深圳市科技创新国家和省科研项目配套计划(ZYC 201105170257 A);国家自然科学基金面上项目(81270857)
范海波,女,硕士,副主任医师,E-mail:fhb 123456 abc@163. com;张海,通信作者,男,主任医师,硕士生导师,研究方向:分子影像,E-mail:szzhhans@Gmail.com;李莹,通信作者,女,硕士,主任医师,研究方向:功能影像,E-mail:282251870@qq.com。
