多浪羊mtDNA D-loop区遗传多样性及系统发育分析
2014-09-15王世锋王玉涛
王世锋, 李 静, 王玉涛
喀什师范学院生物与地理科学系, 叶尔羌绿洲生态与生物资源研究重点实验室, 新疆 喀什 844006
绵羊(Ovisaries)是世界上最重要的经济动物之一,为人类社会提供了大量的产品(如,肉、奶和羊毛纤维等),同时也是人类驯养最早的动物之一[1]。
过去关于家养绵羊起源与进化研究主要依靠比较形态学、考古形态学和经典遗传学方法。近年来,分子遗传学和生物信息学的迅猛发展,推动了家养动物起源的全基因组研究;而考古证据的进一步挖掘以及古DNA技术的不断发展,摆脱了相关研究的时空、时序限制,推动了家养绵羊起源进化研究的进展[2]。
在距今大约8 000~9 000年前(新石器时代),人类开始驯养绵羊[3]。可见,家养动物的驯化(驯化和驯养)是较近期的遗传事件,所以分子遗传标记选择上应具有进化速率快、多态性高的基本特点。目前,分子遗传标记研究主要包括基于mtDNA遗传标记研究,基于父系遗传特征的Y染色体研究和基于核基因组的微卫星标记研究。
线粒体DNA(mitochondrial DNA,mtDNA)是核外遗传物质,具有分子量小、进化速度快(mtDNA的突变速率是核DNA进化速率的5~10倍)、遗传自主(无重组)、无组织特异性及严格的母系遗传等特性,在近缘种间和种内群体间具有丰富的多态性,是研究物种起源进化和分类的重要分子遗传标记之一[4,5]。绵羊线粒体基因组长约16 600 bp,编码线粒体氧化磷酸化呼吸链组成酶所必需的13种多肽、12S rRNA、16S rRNA和 22个tRNA,而其中位于编码脯氨酸tRNA和苯丙氨酸tRNA之间的长约1 182 bp的mtDNA-环控制区(mtDNA D-loop)是线粒体基因组中进化速率最高、最具多态性的区域[6,7]。mtDNA D-loop分为三个部分,分别为左功能区、中间保守区和右功能区,其中左右功能区富含A碱基,在遗传上为高变区。环控制区受自然选择影响较大,存在巨大的变异,如插入、缺失,是整个线粒体基因组序列组成和长度变异最大的区域,其进化速度最快,常用于种群间的系统进化分析[8~10]。通过测定家养绵羊群体的线粒体D-loop区的部分序列,预期能了解家养绵羊的野生祖先、起源以及驯化时间等核心问题,分析现代家养绵羊的起源与品种形成以合理保护和持续利用种质资源,对我国畜牧业的可持续发展有重要意义[11]。
mtDNA D-loop在研究牛[12]、猪[13]、马[14]和山羊[15]等畜种起源中应用较多,然而对于绵羊的起源与进化涉及较少。Wood和Phua[16]分析了新西兰5个绵羊品种的mtDNA D-loop序列,发现了两类主要的单倍型(定义为A和B),从而证明新西兰家养绵羊有两个不同的母系起源。Hiendleder等[17]对3个中亚、5个欧洲和2个非洲绵羊品种的239只个体进行了mtDNA的RFLP测定,也只发现了这两类单倍型。张仲葛[18]、谢成侠[19]认为阿尔卡羊(赤盘羊)和盘羊及其若干亚种与中国现代家养绵羊最可能有血缘关系;常洪[20]认为乌利尔羊、盘羊和摩弗伦羊对中国绵羊血统均有贡献;罗玉柱等[5]对中国9个绵羊群体和蒙古24个绵羊群体的mtDNA D-loop序列进行系统发育分析,结果显示中国和蒙古绵羊均有3个母系起源,对91个绵羊品种的进行网络关系分析,没有发现羱羊、盘羊和东方盘羊对中国和蒙古两国家养绵羊有遗传贡献的证据;线粒体细胞色素b基因序列分析则表明,中国绵羊有多个母系起源或经过多次驯化而来,但未发现盘羊、东方盘羊和亚洲摩佛伦羊与绵羊的母系祖先形成有关的分子证据[21]。
多浪羊(Dolang sheep)是新疆的一个优良肉脂兼用型绵羊品种,因其中心产区在麦盖提县,故又称麦盖提羊。麦盖提羊是当地土种羊(多浪羊)与阿富汗引进的瓦格吉尔羊杂交,经过麦盖提县当地农牧民近百年的精心选育而成,具有较高经济利用价值[22,23]。多浪羊适宜舍饲喂养,体格高大粗壮、生长发育快、产肉率高且肉质鲜嫩,被毛含绒毛多,毛质较好,性情温顺,繁殖率高,遗传性稳定,是羊肉生产的理想品种[24]。本研究以多浪羊为研究对象,采取PCR扩增、基因测序方法研究其线粒体D-loop区核酸序列,探讨多浪羊的起源和遗传多样性,以期为绵羊品种的分类提供合理的依据,同时也为家养绵羊遗传资源的保护和利用提供基础资料。
1 材料与方法
1.1供试材料
多浪羊样本总量82只(麦盖提县种羊场32只、麦盖提兽医站20、喀什屠宰场30只),为雄性个体。颈静脉采血,每10 mL血液加入1.75 mL ACD抗凝剂,混匀后1 h内放入-20℃冰箱中保存,备用[25]。
1.2主要试剂
Tris饱和酚购自北京鼎国生物技术发展中心;琼脂糖为BIOWEST公司产品;TaqDNA聚合酶、dNTP为北京天根生化科技有限公司产品。
1.3总DNA提取
采用酚-氯仿常规法提取样品总DNA[26]。
1.4mtDNAD-loop序列分析
绵羊mtDNA D-loop区扩增所用引物根据绵羊线粒体全序列(GenBank登录号:AF010406.1)设计。上游引物(位于15 983~16 004 bp)mtCR-F:5′-AACTGCTTGACCGTACATAGT-3′;下游引物(位于592~612 bp)mtCR-R:5′-AGAAGGGTATAAAGCACCGCC-3′。由北京三博远志公司合成。PCR反应体系总体积50 μL:绵羊总基因组DNA 4 μL,6×buffer(含Mg2+)5 μL, 上下游引物各1 μL,2.5 mmol/L dNTPs 4 μL,TaqDNA 聚合酶1 μL,ddH2O 34 μL。PCR反应条件为:94℃ 5 min;94℃ 40 s,56℃ 30 s,72℃ 1 min,35个循环;72℃ 10 min。将PCR扩增产物经1%琼脂糖电泳检测后送北京三博远志公司测序。
1.5数据分析
MEGA 6.0软件确定计算碱基组成、转换/颠换比(Ts/Tv)、核苷酸差异和序列差异、Kimura双参数模型计算遗传距离、建立系统发育树。
用DNAsp软件计算多态位点、核苷酸总变异位点、简约信息位点和点突变位点,单倍型、单倍型频率及其在各群体的分布、群体的单倍型多样性及其标准差。
2 结果与分析
2.1PCR扩增结果
对多浪羊mtDNA D-loop区序列进行PCR扩增,获得大小约1 100 bp片段,产物经1%琼脂糖凝胶电泳检测,结果见图1。经测序分析,片段长1 039 bp,确定为目标产物。
2.2多浪羊mtDNAD-loop的核苷酸组成
对多浪羊mtDNA D-loop区序列进行测序,所测mt DNAD-loop区的序列长度为1 039 bp。通过对82个多浪羊个体mtDNA D-环区碱基组成分析,发现A、T、G和C碱基含量分别为29.4%、27.7%、17.7%和25.1%,其中A+T为57.1%,G+C为42.8%。并且对不同采集地的碱基含量进行了比较,发现麦盖提县种羊场的多浪羊G+C含量较其他采集地的要高(见表1)。
2.3多浪羊mtDNAD-loop区序列多样性分析
对多浪羊群体的82个个体 mtDNA D-loop序列进行分析,共发现56个多态位点。在 56个多态位点中,单一多态位点 (只有一个序列在该位点出现了变异)有42个,其中两碱基变异位点有39个,占变异位点数的 69.64%,三碱基变异位点3个,占变异位点数的5.36%。简约信息位点有14个,其中两碱基变异位点 13个,三碱基变异位点 1个。
2.3.1mtDNA D-loop区序列转换/颠换 在56 个多态性位点中,转换与颠换比例见表2,C转换为T的比例最高,为31.84;T转换为C的比例为31.65,较高;T颠换为G的比例最低,为1.29。可以明显看出转换比例高于颠换比例,这可能与碱基的结构有关。转换与颠换比值为6.626。
2.3.2mt DNA D-loop序列单倍型 本实验获得82只多浪羊的mtDNA D-loop序列,共发现了26种单倍型,单倍型比例较低,说明这3个绵羊群体序列遗传多样性较单一。单倍型多样度Hd为0.892,方差为0.000 43,单倍型多样度标准差为0.021。平均核苷酸差异数k为5.289。核苷酸多样度Pi为0.024 15。
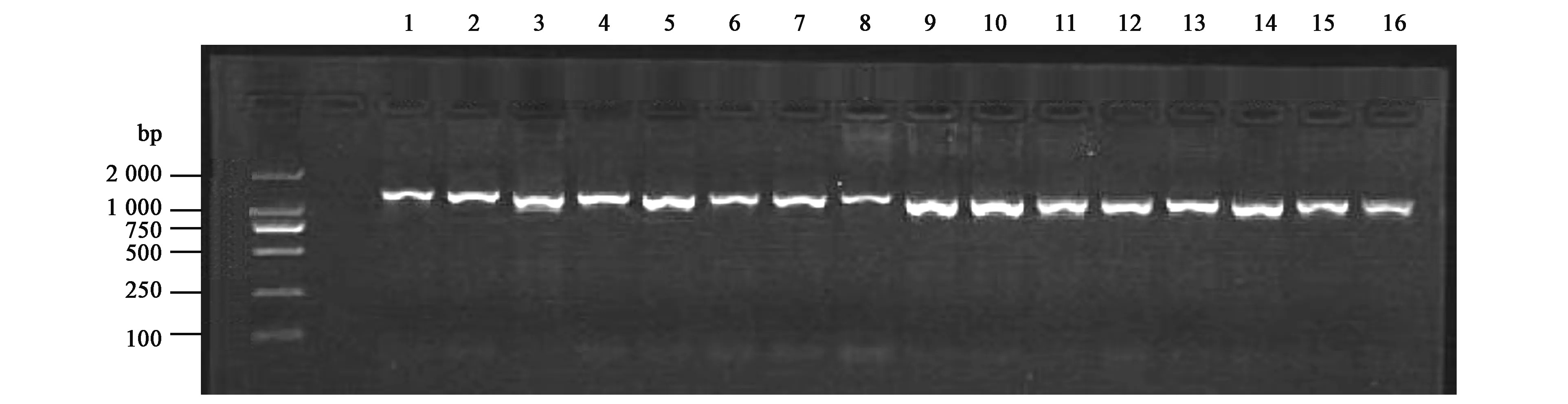
图1 多浪羊mt DNA D-loop区PCR扩增产物1%琼脂糖凝胶电泳结果
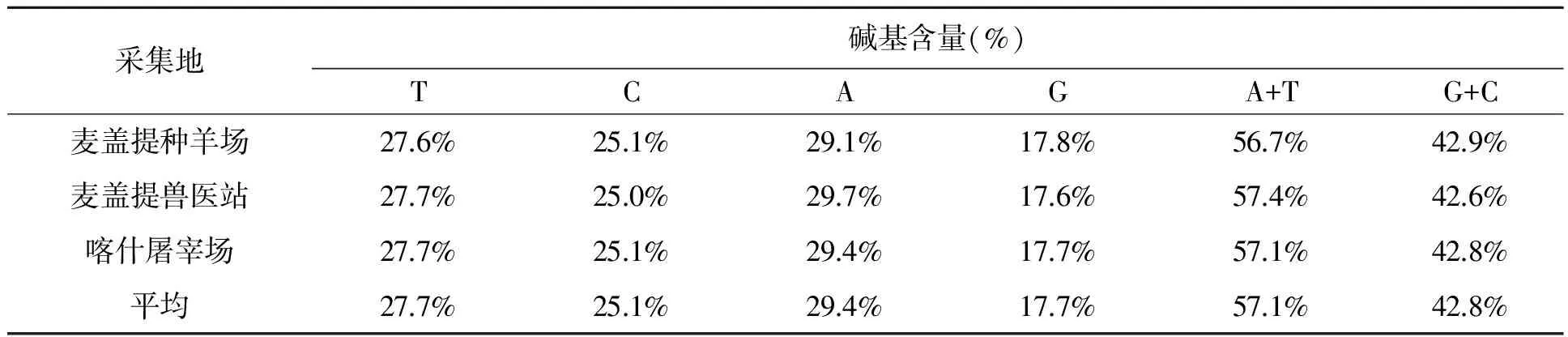
表1 不同采集地多浪羊mtDNA D-loop碱基组成比较
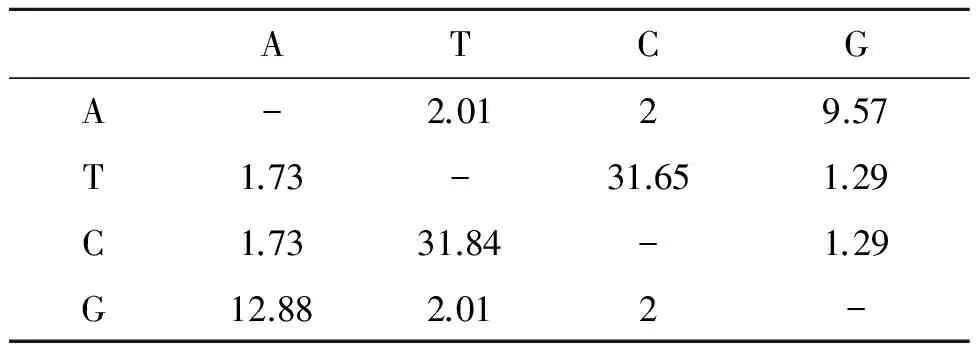
表2 mtDNA D-loop区序列转换/颠换
2.4系统发育分析
根据绵羊母系起源世系判定标准:亚洲A世系(AF039578、AY829405)、欧洲B世系(AF039577、AY829403)和中亚C世系(AY829404)[27],分析多浪羊起源及单倍型分布。
通过对82个序列与5个标准相比较建立系统发育树(见图2)。
由图2可知,多浪羊的起源可能来自于A、B和C三个世系。其中A世系占26.8%,B世系占28.01%,C世系占 29.3%,剩下12只羊可能来自独立的一个分支D或E世系,占15.9%。
2.5群体扩张检测
应用DnaSP软件对82只多浪羊进行中性检验(Tajima’s D):-1.842 60,显著性水平,P<0.05,及Fu和Li氏检验统计量(Fu and Li′s F*test statistic):-5.238 57,显著性水平P<0.02,由此可知多浪羊群体经历过扩张。
3 讨论
本实验所获得的82 条多浪羊mtDNA D-loop序列,共发现了26种单倍型,56个变异位点,其中单一多态位点有42个,简约信息位点有14个。转换比例远远大于颠换比例,绵羊品种间的碱基存在较高的转换偏倚,这符合线粒体基因组DNA进化过程中,通常发生转换频率远高于颠换频率的规律。通过对82只绵羊个体mtDNA D-loop 区序列核苷酸A、C、T和G碱基含量分析发现,以A、T 含量占优势,说明绵羊mtDNA D-loop为A、T富集区,可能是由于CG含量越丰富序列越趋于稳定,而mtDNA D-loop变异率较高。Li 等[28]研究发现GC含量与系统发育有关,亲缘关系接近的动物可能有着类似的GC含量。脊椎动物的基因组GC含量相当一致,在40%~45%的范围中,本研究结果为42.8%,符合这一规律,这说明它们相互分岐的时间还不够长,所以还不能在GC含量上积累较大的差异。
核苷多样度Pi是衡量一个种群mtDNA遗传变异的重要指标。本研究表明多浪羊核苷酸多样度为0.024 15,虽高于牛华锋等[29]研究的0.014 75,但多浪羊的核苷酸多样度仍较低,说明多浪羊纯度较高,但多样性较低、亲缘关系较近,可能由于长期闭锁繁育的结果,应采取重点措施予以保护。
系统发育分析表明多浪羊至少有A、B和C三个母系起源,另外可能还存在独立的一个分世系D或E,但还需进一步的研究验证。
[1]蔡大伟,汤卓炜,周 慧,等.中国绵羊起源的分子考古学研究[J]. 边疆考古研究,2010,9:291-300.
[2]王玉涛,王世锋,罗玉柱. 现代家养绵羊起源进化的分子遗传学研究进展[J]. 生物技术通报,2013,(12):15-19.
[3]Ryder M L. Sheep [A]. In: Mason I L(ed). Evolution of domestic animals[M]. New York :Longman,1984,63-85.
[4]王存芳,曾勇庆,杜立新,等.线粒体DNA(mtDNA)的研究进展[J]. 动物科学与动物医学.2001,18(1):16-18.
[5]罗玉柱,成述儒,Lkhagva B,等. 用mtDNA D-环序列探讨蒙古和中国绵羊的起源及遗传多样性[J]. 遗传学报,2005,32(1):1256-1265.
[6]杨会国,於建国,郝 耿,等.和田羊线粒体DNA D-loop区序列研究[J]. 新疆农业科学,2013 ,50(5) :959-962.
[7]刘银梅. 线粒体DNA在动物遗传育种中的应用[J]. 江西畜牧兽医杂志.2005,(6):6-7.
[8]冯 政,刘贵生,武华玉,等.藏绵羊mtDNA-D-loop区的长度异质性研究[J]. 湖北农业科学,2011,40(17):3577-3580.
[9]王金玲,王 永,刘鲁蜀,等.草地藏系绵羊mtDNA D-loop区多态性分析[J]. 绵阳师范学院学报,2011,30(11):79-80.
[10]成述儒,韩建林,Hanotte O,等.中国绵羊群体mtDNA D-loop的遗传多样性分析[J]. 甘肃农业大学学报,2005,40(4):440-447.
[11]郭彦斌,王 慧,刘 刚,等.利用mtDNA D-loop区研究中国10个绵羊品种的遗传多样性与起源[J]. 农业生物技术学报,2012,20(7):799-806.
[12 ] Loftus R T, MacHugh D E,Bradley D G,etal.. Evidence for two independent domestications of cattle[J]. Proc. Natl. Acad. Sci. USA,1994,91:2757-2761.
[13] Giuffra E,Kijas J M H,Amarger V,etal.. The origin of the domestic pig: Independent domestication and subsequent introgression[J]. Genetics,2000,154: 1785-1791.
[14] Vila C,Leonard J A,Marklund S,etal.. Widespread origins of domestic horse lineages[J]. Science,2001,291:474-477.
[15]Luikart G,Gielly L,Excoffier L,etal.. Multiple maternal origins and weak phylogeographic structure in domestic goats[J]. Proc. Natl. Acad. Sci. USA, 2001,98:2757-5932.
[16]Wood N J,Phua S H. Variation in the control region sequence of the sheep mitochondrial genome[J]. Anmi. Genet.,1996,27:25-33.
[17]Hiendleder S,Mainz K,Plante Y,etal.. Analysis of Mitochondrial DNA indicates that domestic sheep are derived from two different ancestralmaternal sources:No evidence for contributions from urial and argali sheep[J]. Hered,1998,89:113-120.
[18]张仲葛,黄惟一. 祖国的畜牧与畜产资源[M]. 上海:永详印书馆,1953.
[19]谢成侠.中国牛羊史(附养鹿简史)[M]. 北京:中国农业出版社,1985.
[20]常 洪. 动物遗传资源学[M]. 北京:科学出版社,2009.
[21]赵倩君.中国部分绵羊群体的起源、遗传多样性及保护研究[D]. 北京:中国农业科学院,博士学位论文,2007.
[22]买买提明巴拉提,阿布拉,哈德尔肉孜.大有开发潜力的麦盖提羊[J]. 中国草食动物科学.1999,(3):24-25.
[23]史洪才,牛志刚,白 洁,等.新疆多浪羊FecB突变检测及与产羔羊数的关系[J]. 农业生物技术学报,2010,19(2):330-334.
[24]蒋文生. 新疆多浪羊品种资源的保护与开发利用[J]. 中国草食动物,2006,(2):28-30.
[25]李钧敏. 分子生物学实验[M]. 杭州:浙江大学出版社,2010.
[26]Sambrook J,Fritsh E F,Manlatis T. Molecular Cloning:A Laboratory Manual[M]. (2nd edn). New York:Cold Spring Harbor Laboratory Press,1989.
[27]郭 军.中国部分绵羊品种mtDNA多态性及其遗传分化的研究[D]. 北京:中国农业科学院,硕士学位论文,2004.
[28]Li W H, Graur D. Foundamentals of molecular evolution[M]. Sunderland:Sinauer Associates,Inc.,1991,245-253.
[29]牛华锋,陈玉林,任战军,等.中国绵羊品种mtDNA遗传多态性与系统进化研究[J]. 中国农学通报,2011,27(17):21-25.
